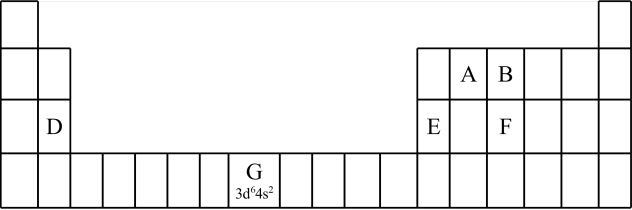
1 . 下图是元素周期表的一部分。
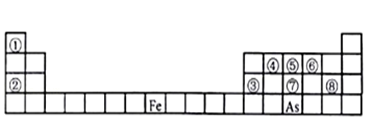
Ⅰ、用化学用语回答下列问题:
(1)由②、⑥两元素形成的强氧化性物质的电子式为_______ ,由①、⑤两元素构成的10电子化合物的形成过程为_______ 。
(2)⑦、⑧的最高价含氧酸的酸性较弱的是_______ 。(化学式表示)
(3)As在元素周期表中位置为__ ;氢化物的沸点:NH3 _______ AsH3(填“>”或“<”)
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为_______ ,当消耗75g还原剂时,电子转移了__ mol。
Ⅱ、A、B、C、D、E、X是上述周期表给出元素组成的常见单质或化合物。已知A、B、C、D、E、X存在如下图所示转化关系(部分生成物和反应条件略去),若常温下A为红棕色气体,B为强酸,X为常见金属单质。
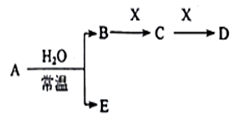
(1)A与水反应的化学方程式为_______ 。
(2)工业上常用CO热还原法冶炼X,写出其化学方程式_______ 。
(3)某温度下(>100℃)若m克X与H2O反应放出QkJ(Q>0)的热量。写出该反应的热化学方程式_______ 。
Ⅲ、由①、⑤、⑥、S和Fe五种元素组成的相对分子质量为392的化合物B,B中含有结晶水。对化合物B进行如下实验:
a.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色有刺激性气味气体;过一段时间白色沉淀变为灰绿色,最终变为红褐色。
b.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
(1)由实验a、b推知B溶液中含有的离子为_______ ;
(2)B的化学式为_______ 。

Ⅰ、用化学用语回答下列问题:
(1)由②、⑥两元素形成的强氧化性物质的电子式为
(2)⑦、⑧的最高价含氧酸的酸性较弱的是
(3)As在元素周期表中位置为
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为
Ⅱ、A、B、C、D、E、X是上述周期表给出元素组成的常见单质或化合物。已知A、B、C、D、E、X存在如下图所示转化关系(部分生成物和反应条件略去),若常温下A为红棕色气体,B为强酸,X为常见金属单质。

(1)A与水反应的化学方程式为
(2)工业上常用CO热还原法冶炼X,写出其化学方程式
(3)某温度下(>100℃)若m克X与H2O反应放出QkJ(Q>0)的热量。写出该反应的热化学方程式
Ⅲ、由①、⑤、⑥、S和Fe五种元素组成的相对分子质量为392的化合物B,B中含有结晶水。对化合物B进行如下实验:
a.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色有刺激性气味气体;过一段时间白色沉淀变为灰绿色,最终变为红褐色。
b.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
(1)由实验a、b推知B溶液中含有的离子为
(2)B的化学式为
您最近一年使用:0次
2011·山西太原·三模
解题方法
2 . 已知A~N分别代表一种物质,它们之间的转化关系如图所示(部分反应的反应条件和生成物已略去)。A、B、C分别是由短周期元素组成的单质,A是金属,D是无色液体。F是一种离子化含物,其阴阳离子的个数比为1:3,且能与水反应得到两种碱。反应①是实验室检验某离子的方法,反应②是工业、生产N的重要反应。请回答下列问题:
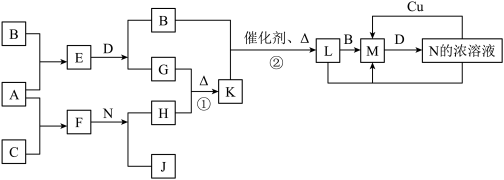
(1)B元素在元素周期表中的位置是__________ ,F的电子式是_____________ 。
(2)写出反应①的离子方程式:___________ ;
(3)Cu与足量的N的浓溶液反应得到的产物主要是M不是L,其原因是__________ (请用上图所示关系中反应的化学方程式回答)。
(4)选择性催化还原(SCR)是在有催化剂的条件下将M转变为无毒的物质,这是目前国外进行尾气治理遍采用的一种方法。亚铬酸铜(Adkin偿化剂)是极好的M催化还原的催化剂,是铜和铬的复合氧化物,成分不固定,如:aCuO·bCr2O3等,统称为亚铬酸铜。其中:CuNH4(OH)CrO4在295℃分解生成复合的氧化物(催化剂)、氮气及水,写出该反应的化学方程式:______________________ 。
(5)已知一定温度(>100℃)下,反应②的平衡常数为1。将0.8molK和1.1molB放入容积为1L的封闭容器中,发生反应②,一段时间后L的浓度为0.4mol/L,此时反应v正_____ v逆(填“>”、“<”或“=”)。当反应到达平衡后,保持温度不变,再加入一定物质的量的B,重新达到平衡,则L的平衡浓度__________ (填“增大”、“不变”或“减小”),B的转化率_________ 。(填“升高”、“不变”或“降低”),L的体积分数___________ (填“增大”、“不变”、“减小”或“无法确定”)。

(1)B元素在元素周期表中的位置是
(2)写出反应①的离子方程式:
(3)Cu与足量的N的浓溶液反应得到的产物主要是M不是L,其原因是
(4)选择性催化还原(SCR)是在有催化剂的条件下将M转变为无毒的物质,这是目前国外进行尾气治理遍采用的一种方法。亚铬酸铜(Adkin偿化剂)是极好的M催化还原的催化剂,是铜和铬的复合氧化物,成分不固定,如:aCuO·bCr2O3等,统称为亚铬酸铜。其中:CuNH4(OH)CrO4在295℃分解生成复合的氧化物(催化剂)、氮气及水,写出该反应的化学方程式:
(5)已知一定温度(>100℃)下,反应②的平衡常数为1。将0.8molK和1.1molB放入容积为1L的封闭容器中,发生反应②,一段时间后L的浓度为0.4mol/L,此时反应v正
您最近一年使用:0次
名校
解题方法
3 . I.氧化还原反应原理在研究物质性质及物质转化方面具有重要的价值。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式___________ 。
(2)火药是中国的四大发明之一,永远值得中华儿女骄傲。黑火药在发生爆炸时,发生如下反应2KNO3+3C+S=K2S+N2↑+3CO2↑,则生成1molN2反应过程中转移电子的数目为___________ 。
(3)中国古代著作中有“银针验毒”的记录,其原理为4Ag+2H2S+O2=2X+2H2O,则X的化学式是___________ ,其中 H2S在该反应中___________ (填序号)。
A.作氧化剂 B.作还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(4)砒霜(As2O3)与Zn可以发生如下反应As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O,其中氢元素的化合价未发生改变。在上述反应中As2O3,显示出来的性质是___________ (填“还原性”或“氧化性”)。
II.元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:___________ 。
(6)在①~⑨元素中,原子半径最大的元素,其某种氧化物可用于呼吸面具中氧气来源,请写出该物质与二氧化碳反应化学方程式___________ 。
(7)写出⑤、⑦两种元素所形成的最高价氧化物对应的水化物反应的离子方程式是___________ 。
(8)比较④与⑨的简单气态氢化物的稳定性___________ >___________ (填化学式)。
(9)由下列元素形成的化合物中含有离子键的是___________。
(10)写出⑤在空气中燃烧产物的电子式:___________ 。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式
(2)火药是中国的四大发明之一,永远值得中华儿女骄傲。黑火药在发生爆炸时,发生如下反应2KNO3+3C+S=K2S+N2↑+3CO2↑,则生成1molN2反应过程中转移电子的数目为
(3)中国古代著作中有“银针验毒”的记录,其原理为4Ag+2H2S+O2=2X+2H2O,则X的化学式是
A.作氧化剂 B.作还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(4)砒霜(As2O3)与Zn可以发生如下反应As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O,其中氢元素的化合价未发生改变。在上述反应中As2O3,显示出来的性质是
II.元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:

(6)在①~⑨元素中,原子半径最大的元素,其某种氧化物可用于呼吸面具中氧气来源,请写出该物质与二氧化碳反应化学方程式
(7)写出⑤、⑦两种元素所形成的最高价氧化物对应的水化物反应的离子方程式是
(8)比较④与⑨的简单气态氢化物的稳定性
(9)由下列元素形成的化合物中含有离子键的是___________。
| A.①③ | B.②③ | C.①④ | D.⑥⑨ |
您最近一年使用:0次
解题方法
4 . 砷 在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗
在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗 ,流程如下:
,流程如下:
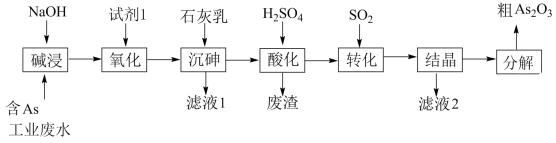
已知:
①含 工业废水主要以亚砷酸(
工业废水主要以亚砷酸( )形式存在,
)形式存在, 为三元弱酸,受热分解为
为三元弱酸,受热分解为 ;
;
② 微溶于水,
微溶于水, 难溶于水。
难溶于水。
回答下列问题:
(1)砷元素在元素周期表中的位置为_______ 。
(2)“碱浸”中发生反应的离子方程式为_______ 。
(3)从绿色化学角度考虑,“试剂1”可以选择_______ (填化学式)。
(4)“沉砷”在流程中的目的是_______ ;“沉砷”的最佳温度是 ,温度高于
,温度高于 时,随温度升高转化率下降,可能的原因是
时,随温度升高转化率下降,可能的原因是_______ 。
(5)“废渣”的主要成分是_______ ,“转化”中发生反应的化学方程式为_______ 。
(6)从综合利用的角度考虑“滤液2”可返回_______ 步骤中循环再利用。
 在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗
在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗 ,流程如下:
,流程如下:
已知:
①含
 工业废水主要以亚砷酸(
工业废水主要以亚砷酸( )形式存在,
)形式存在, 为三元弱酸,受热分解为
为三元弱酸,受热分解为 ;
;②
 微溶于水,
微溶于水, 难溶于水。
难溶于水。回答下列问题:
(1)砷元素在元素周期表中的位置为
(2)“碱浸”中发生反应的离子方程式为
(3)从绿色化学角度考虑,“试剂1”可以选择
(4)“沉砷”在流程中的目的是
 ,温度高于
,温度高于 时,随温度升高转化率下降,可能的原因是
时,随温度升高转化率下降,可能的原因是(5)“废渣”的主要成分是
(6)从综合利用的角度考虑“滤液2”可返回
您最近一年使用:0次
名校
5 . 1869年,俄国化学家门捷列夫提出了元素周期律,并在此基础上发表了第一张元素周期表。为了纪念元素周期表诞生150年,联合国将2019年定为“国际化学元素周期表年”,并认为元素周期表是“科学共同的语言”。
(1)认识元素周期表的结构:___________ 区。
②2017年5月9日我国发布了113号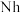 、115号
、115号 、117号
、117号 、118号
、118号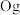 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是___________ (填字母序号)。
a.113号元素在周期表中的位置是第七周期 族
族
b.117号元素 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体
c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:
(2)认识原子结构与元素周期表的关系:见表中元素 的信息,其中 “
的信息,其中 “ ”称为该元素原子的
”称为该元素原子的___________ ,该元素 能层上具有
能层上具有___________ 种不同运动状态的电子。
(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D_______ E(填“>” “<”或“=”)。
②气态氢化物的沸点:B_____ F (填“>”“<”或“=”),理由是___________ 。B的另一种氢化物可以作为火箭推进剂的燃料之一,其电子式为___________ 。
(1)认识元素周期表的结构:
②2017年5月9日我国发布了113号
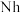 、115号
、115号 、117号
、117号 、118号
、118号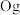 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是a.113号元素在周期表中的位置是第七周期
 族
族b.117号元素
 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:

(2)认识原子结构与元素周期表的关系:见表中元素
 的信息,其中 “
的信息,其中 “ ”称为该元素原子的
”称为该元素原子的 能层上具有
能层上具有(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D
②气态氢化物的沸点:B
您最近一年使用:0次
2024-04-26更新
|
46次组卷
|
2卷引用:安徽省淮南第二中学2023-2024学年高二下学期期中测试化学试题
名校
解题方法
6 . 回答以下关于元素及其化合物的问题。
(1)Na原子核外有________ 种不同能量的电子,其离子最外层电子的轨道表示式________ 。
(2)相同压强下,部分元素氟化物的熔点见下表:
①试解释上表中氟化物熔点差异的原因:___________ 。
② 分子的空间构型为
分子的空间构型为___________ , 中Si—F键间的键角是
中Si—F键间的键角是___________ 。
(3)元素周期表有多种形式。下图分别是三种不同形式元素周期表的局部区域。

①图A中,数值越大,则该元素的___________ (填“金属性”或“非金属性”)越强。写出能说明O、F两元素该性质强弱的化学方程式___________ 。
②根据图B预测,整个周期表中位置最低的元素应位于___________ (放射性元素除外)。图B所示第二周期主族元素中,某元素该性质反常偏高,则该元素原子核外电子排布式为___________ 。
③图C表示的意义是___________ 。
(4)元素周期表中,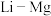 、
、 、
、 处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
(1)Na原子核外有
(2)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 |  |  |  |
| 熔点/℃ | 1266 | 1534 | 183 |
②
 分子的空间构型为
分子的空间构型为 中Si—F键间的键角是
中Si—F键间的键角是(3)元素周期表有多种形式。下图分别是三种不同形式元素周期表的局部区域。

①图A中,数值越大,则该元素的
②根据图B预测,整个周期表中位置最低的元素应位于
③图C表示的意义是
(4)元素周期表中,
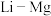 、
、 、
、 处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。A. 易溶于水 易溶于水 | B. |
C. 熔点高 熔点高 | D.晶体硼为分子晶体 |
您最近一年使用:0次
7 . Ⅰ.金属单质及其化合物的应用非常广泛。
(1)铁元素在元素周期表中位置为___________ 。
(2)反应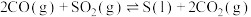
 ,其他条件相同,催化剂不同时,反应相同时间
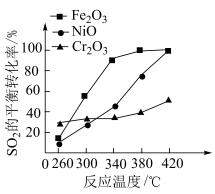
,其他条件相同,催化剂不同时,反应相同时间 的转化率随反应温度的变化如图所示,260℃条件下选择
的转化率随反应温度的变化如图所示,260℃条件下选择___________ (填“ ”“
”“ ”或“
”或“ ”),作催化剂时反应速率最快。不考虑价格因素,与NiO相比,选择
”),作催化剂时反应速率最快。不考虑价格因素,与NiO相比,选择 作催化剂的优势是
作催化剂的优势是___________ 。
(3)上述反应的正反应速率方程为 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中 、
、 分别为正、逆反应的速率常数,只受温度影响,
分别为正、逆反应的速率常数,只受温度影响,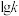 (速率常数的对数)与温度(T)的关系符合图中的两条线,其中表示
(速率常数的对数)与温度(T)的关系符合图中的两条线,其中表示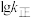 的是
的是___________ (填序号)。

(4)泡沫灭火器灭火时发生反应的离子方程式是___________ 。
(5)要使 溶液中
溶液中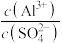 的比值增大,可加入的物质是___________。
的比值增大,可加入的物质是___________。
(1)铁元素在元素周期表中位置为
(2)反应
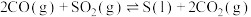
 ,其他条件相同,催化剂不同时,反应相同时间
,其他条件相同,催化剂不同时,反应相同时间 的转化率随反应温度的变化如图所示,260℃条件下选择
的转化率随反应温度的变化如图所示,260℃条件下选择 ”“
”“ ”或“
”或“ ”),作催化剂时反应速率最快。不考虑价格因素,与NiO相比,选择
”),作催化剂时反应速率最快。不考虑价格因素,与NiO相比,选择 作催化剂的优势是
作催化剂的优势是
(3)上述反应的正反应速率方程为
 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中 、
、 分别为正、逆反应的速率常数,只受温度影响,
分别为正、逆反应的速率常数,只受温度影响,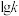 (速率常数的对数)与温度(T)的关系符合图中的两条线,其中表示
(速率常数的对数)与温度(T)的关系符合图中的两条线,其中表示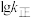 的是
的是
(4)泡沫灭火器灭火时发生反应的离子方程式是
(5)要使
 溶液中
溶液中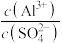 的比值增大,可加入的物质是___________。
的比值增大,可加入的物质是___________。| A.少量硫酸 | B.少量NaOH溶液 |
C.少量 固体 固体 | D.适量蒸馏水 |
您最近一年使用:0次
名校
解题方法
8 . (I)俄美科学家联合小组宣布合成出114号元素(Fl)的一种同位素,该原子的质量数是289,试回答下列问题:
(1)该元素在周期表中的位置为:_______ ,属于_______ 元素(填“金属”或“非金属”)。
(II)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:
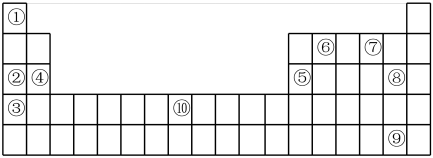
(2)②③④三种元素最高价氧化物的水化物碱性由强到弱的顺序是_______ (填化学式)。
(3)元素⑦的简单氢化物与③的单质反应的离子方程式为_______ ;
(4)元素②和⑤的最高价氧化物的水化物反应的离子方程式为_______ ;
(5)元素⑩的名称为_______ ,其单质与⑧的单质反应的化学方程式为_______ ;
(6)部分短周期元素的原子半径及主要化合价如下表,判断以下叙述不正确的是_______
A.L2+、R2-的核外电子数相等
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物具有两性
D.简单氢化物的沸点为HnT>HnR
E.T与R可形成的化合物TR2、TR3
F.Q与M的单质均能与盐酸、NaOH溶液反应放出氢气
(1)该元素在周期表中的位置为:
(II)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:

(2)②③④三种元素最高价氧化物的水化物碱性由强到弱的顺序是
(3)元素⑦的简单氢化物与③的单质反应的离子方程式为
(4)元素②和⑤的最高价氧化物的水化物反应的离子方程式为
(5)元素⑩的名称为
(6)部分短周期元素的原子半径及主要化合价如下表,判断以下叙述不正确的是
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物具有两性
D.简单氢化物的沸点为HnT>HnR
E.T与R可形成的化合物TR2、TR3
F.Q与M的单质均能与盐酸、NaOH溶液反应放出氢气
您最近一年使用:0次
名校
解题方法
9 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位置,结构和性质的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
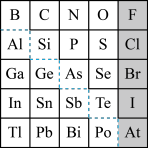
(l)Ge 的最高价氧化物对应水化物的化学式为_____ ,P、S、Cl元素对应的简单离子的还原性由强到弱的顺序为_____ 。(写离子符号)
(2)根据元素周期律,推断:
①阴影部分元素最高价氧化物对应水化物的酸性最强的是_____ 。(写化学式)
②H3AsO4、H2SeO4的酸性强弱:H3AsO4(填“> ”“< ”或“=” )_____ H2SeO4。
③镓的氯化物与氨水反应的化学方程式为_____
(3)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。:如2A1+4BaO 3Ba↑ +BaO •A12O3,利用上述方法可制取Ba的主要原因是
3Ba↑ +BaO •A12O3,利用上述方法可制取Ba的主要原因是____________
a.高温时Al 的活泼性大于Ba b.高温有利于BaO 分解
c.高温时BaO• A12O3比A12O3稳定 d.Ba的沸点比Al 的低
(4)用铝热法还原下列氧化物,制得金属各l mol,消耗铝最少的是________ 。
a.MnO2 b.WO3 c.Cr2O3 d.Co3O4

(l)Ge 的最高价氧化物对应水化物的化学式为
(2)根据元素周期律,推断:
①阴影部分元素最高价氧化物对应水化物的酸性最强的是
②H3AsO4、H2SeO4的酸性强弱:H3AsO4(填“> ”“< ”或“=” )
③镓的氯化物与氨水反应的化学方程式为
(3)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。:如2A1+4BaO
 3Ba↑ +BaO •A12O3,利用上述方法可制取Ba的主要原因是
3Ba↑ +BaO •A12O3,利用上述方法可制取Ba的主要原因是a.高温时Al 的活泼性大于Ba b.高温有利于BaO 分解
c.高温时BaO• A12O3比A12O3稳定 d.Ba的沸点比Al 的低
(4)用铝热法还原下列氧化物,制得金属各l mol,消耗铝最少的是
a.MnO2 b.WO3 c.Cr2O3 d.Co3O4
您最近一年使用:0次
10 . (I)俄美科学家联合小组宣布合成出114号元素(FI)的一种同位素,该原子的质量数是289,试回答下列问题:
(1)该元素在周期表中位于第______ 周期,_____ 族,属于金属元素还是非金属元素?____
(2)如果该元素存在最高价氧化物对应的水化物,请写出其化学式________ 。
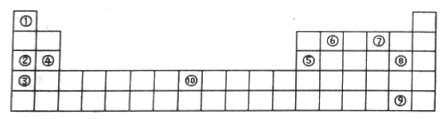
(II)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:
(1)元素⑦的氢化物与⑧的单质反应的离子方程式为__________ 。
(2)元素②和⑤的最高价氧化物的水化物相互反应的化学方程式为___________ 。
(3)元素⑩的单质与⑦的氢化物高温下反应的化学方程式为___________ 。
(III)判断以下叙述正确的是__________ 。
部分短周期元素的原子半径及主要化合价
A. L2+、R2-的核外电子数相等
B. 单质与稀盐酸反应的速率L<Q
C. M与T形成的化合物一定具有两性
D. 氢化物的沸点为HnT>HnR
E. M的单质能与盐酸、NaOH溶液反应放出氢气
(1)该元素在周期表中位于第
(2)如果该元素存在最高价氧化物对应的水化物,请写出其化学式
(II)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:
(1)元素⑦的氢化物与⑧的单质反应的离子方程式为
(2)元素②和⑤的最高价氧化物的水化物相互反应的化学方程式为
(3)元素⑩的单质与⑦的氢化物高温下反应的化学方程式为
(III)判断以下叙述正确的是
部分短周期元素的原子半径及主要化合价
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A. L2+、R2-的核外电子数相等
B. 单质与稀盐酸反应的速率L<Q
C. M与T形成的化合物一定具有两性
D. 氢化物的沸点为HnT>HnR
E. M的单质能与盐酸、NaOH溶液反应放出氢气
您最近一年使用:0次



