名校
1 . 1869年俄国科学家门捷列夫绘制出了第一张元素周期表,成为化学史上的里程碑之一,且大大地促进了化学学科的快速发展。下表是现代元素周期表的一部分,请据表回答下列问题:
(1)元素③的名称是___________ ,金属性最强的元素是___________ (填元素符号)。
(2)①②⑤三种元素原子半径由大到小的顺序为___________ (填序号)。
(3)元素⑦的单质的一种用途是___________ (填写“制造玻璃”或“制造计算机芯片”)。
(4)元素⑧⑨⑩最高价氧化物的水化物中酸性最强的是___________ (填化学式)。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
二 | ① | ② | ③ | ||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)元素③的名称是
(2)①②⑤三种元素原子半径由大到小的顺序为
(3)元素⑦的单质的一种用途是
(4)元素⑧⑨⑩最高价氧化物的水化物中酸性最强的是
您最近一年使用:0次
2022-03-16更新
|
640次组卷
|
3卷引用:湖南省长沙市长郡中学2020-2021学年高一下学期期中考试化学试题
2 . 磷元素形成的单质、化合物用途广泛。请回答下列问题。
(1)磷元素在周期表中的位置是_______ 。
(2)磷元素形成的单质白磷,在军事上可用作燃烧弹,该反应的化学方程式是_______ 。
(3)磷元素可以形成多种含氧酸。
①过多饮用含磷酸(H3PO4)的饮料,会导致人体的骨密度降低。磷酸的结构式为 ,其结构中画圈部分可电离出H+,故称为三元酸。磷酸与氢氧化钠完全中和时,反应的化学方程式是
,其结构中画圈部分可电离出H+,故称为三元酸。磷酸与氢氧化钠完全中和时,反应的化学方程式是_______ 。
②次磷酸(H3PO2)的结构式为 ,在工业上可做还原剂,请从化合价的角度解释原因是
,在工业上可做还原剂,请从化合价的角度解释原因是_______ ;100mL 1mol/L次磷酸与2mol/LNaOH溶液恰好反应,消耗NaOH溶液的体积是_______ mL。
(1)磷元素在周期表中的位置是
(2)磷元素形成的单质白磷,在军事上可用作燃烧弹,该反应的化学方程式是
(3)磷元素可以形成多种含氧酸。
①过多饮用含磷酸(H3PO4)的饮料,会导致人体的骨密度降低。磷酸的结构式为
 ,其结构中画圈部分可电离出H+,故称为三元酸。磷酸与氢氧化钠完全中和时,反应的化学方程式是
,其结构中画圈部分可电离出H+,故称为三元酸。磷酸与氢氧化钠完全中和时,反应的化学方程式是②次磷酸(H3PO2)的结构式为
 ,在工业上可做还原剂,请从化合价的角度解释原因是
,在工业上可做还原剂,请从化合价的角度解释原因是
您最近一年使用:0次
3 . 下图是元素① ~ ⑤在元素周期表中的位置。

(1)②在周期表中的位置是第___________ 周期第___________ 族,其淡黄色氧化物与CO2反应的化学方程式是___________ 。
(2)③的一种核素的中子数是10,表示该核素的符号是___________ 。
(3)非金属性:④___________ ⑤(填“>”或“<”),从原子结构角度解释其原因:___________ 。
(4)②、⑤两种元素形成的化合物有重要的用途,用电子式表示它的形成过程___________ 。
(5)下列关于①的说法正确的是___________ 。
a.原子结构示意图为
b.其单质可以和水反应生成H2
c.在同主族的元素中,①的金属性最强

(1)②在周期表中的位置是第
(2)③的一种核素的中子数是10,表示该核素的符号是
(3)非金属性:④
(4)②、⑤两种元素形成的化合物有重要的用途,用电子式表示它的形成过程
(5)下列关于①的说法正确的是
a.原子结构示意图为

b.其单质可以和水反应生成H2
c.在同主族的元素中,①的金属性最强
您最近一年使用:0次
名校
4 . 运用元素周期律和元素周期表,可以系统研究元素的性质。回答下列问题:
(1)碱金属元素中,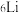 和
和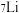 之间的关系是互为
之间的关系是互为_______ 。金属钾的氧化物有多种,其中过氧化钾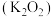 常作供氧剂,写出
常作供氧剂,写出 与
与 反应的化学方程式:
反应的化学方程式:_______ 。
(2)门捷列夫预言的“类硅”,后被发现,并命名为锗(Ge),周期表中排在硅的下一行。加上之前发现的碳(C)、铅(Pb)、锡(Sn),这一主族的元素趋于完善。
①锗在元素周期表中的位置是_______ ,根据锗在周期表中处于金属和非金属分界线附近,预测锗单质的一种用途是_______ 。
②硅和锗单质分别与 反应生成的氢化物更稳定的是
反应生成的氢化物更稳定的是_______ (填“硅”或“锗”)。
(1)碱金属元素中,
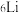 和
和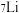 之间的关系是互为
之间的关系是互为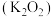 常作供氧剂,写出
常作供氧剂,写出 与
与 反应的化学方程式:
反应的化学方程式:(2)门捷列夫预言的“类硅”,后被发现,并命名为锗(Ge),周期表中排在硅的下一行。加上之前发现的碳(C)、铅(Pb)、锡(Sn),这一主族的元素趋于完善。
①锗在元素周期表中的位置是
②硅和锗单质分别与
 反应生成的氢化物更稳定的是
反应生成的氢化物更稳定的是
您最近一年使用:0次
名校
5 . 门捷列夫预言的“类硅”,多年后被德国化学家文克勒发现,命名为锗(Ge)。加上之前发现的碳(C)、铅(Pb)、锡(Sn),这一主族的元素趋于完善。回答下列问题:
(1)①硅在元素周期表中的位置是_______ ;根据锗在周期表中处于金属和非金属分界线附近,预测锗单质的一种用途是_______ 。
②硅和锗单质分别与H2反应生成的氢化物更稳定的是_______ (填“硅”或“锗”)。
(2)已知锡、铅两种元素的主要化合价是+2价和+4价,其中+2价锡元素和+4价铅元素的化合物均是不稳定的,+2价锡元素的化合物有强还原性,+4价铅元素的化合物有强氧化性,Sn2+还原性比Fe2+还原性强。
①氯气与锡共热的化学方程式_______ ;
②写出SnCl2溶液和FeCl3溶液反应的离子方程式_______ ;
③PbO2与浓盐酸共热能体现+4价Pb的强氧化性,写出离子方程式_______ 。
(1)①硅在元素周期表中的位置是
②硅和锗单质分别与H2反应生成的氢化物更稳定的是
(2)已知锡、铅两种元素的主要化合价是+2价和+4价,其中+2价锡元素和+4价铅元素的化合物均是不稳定的,+2价锡元素的化合物有强还原性,+4价铅元素的化合物有强氧化性,Sn2+还原性比Fe2+还原性强。
①氯气与锡共热的化学方程式
②写出SnCl2溶液和FeCl3溶液反应的离子方程式
③PbO2与浓盐酸共热能体现+4价Pb的强氧化性,写出离子方程式
您最近一年使用:0次
6 . 元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。表中列出了①~⑨九种元素在周期表中的位置。
请回答:
(1)这九种元素中化学性质最不活泼的是___ (填元素符号)。
(2)写出④元素单质的一种用途____ 。
(3)写出⑧元素最高价氧化物对应水化物的化学式:___ 。
(4)写出⑤元素氢化物的化学式:___ 。
(5)在①②③三种元素的最高价氧化物对应的水化物中,碱性最强的是___ (填化学式)。
(6)④③⑥三种元素按原子半径由大到小的顺序依次为____ (填元素符号)。
(7)写出③的氧化物与氢氧化钠反应的离子方程式:___ 。
(8)⑦元素与氢元素形成化合物的电子式是____ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ② | ③ | ④ | ⑧ | ⑨ | |||
| 4 | ① |
(1)这九种元素中化学性质最不活泼的是
(2)写出④元素单质的一种用途
(3)写出⑧元素最高价氧化物对应水化物的化学式:
(4)写出⑤元素氢化物的化学式:
(5)在①②③三种元素的最高价氧化物对应的水化物中,碱性最强的是
(6)④③⑥三种元素按原子半径由大到小的顺序依次为
(7)写出③的氧化物与氢氧化钠反应的离子方程式:
(8)⑦元素与氢元素形成化合物的电子式是
您最近一年使用:0次
2021高三·全国·专题练习
7 . (NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵)是一种重要的化工原料,用途广泛。完成下列填空:
(1)铁在元素周期表的第ⅦB和第ⅠB之间。铁位于第___ 周期___ 族。
(2)写出Fe与水反应的化学方程式:___ 。
(3)将(NH4)2Fe(SO4)2中非金属元素的简单阴离子按半径由小到大的顺序排列:___ 。
(4)同温度同浓度的FeSO4和(NH4)2Fe(SO4)2溶液中,c(Fe2+)是否相等___ ?为什么?___ 。
(5)设计实验,证明(NH4)2Fe(SO4)2·6H2O晶体中含有Fe2+___ 。
(6)已知:(NH4)2Fe(SO4)2·6H2O在200℃失去全部结晶水。将一定质量的粉末状该晶体置于坩埚中,保持200℃受热,经冷却、恒重等正确操作,计算得到的1mol晶体中结晶水含量总是偏低,偏低的可能原因是___ (写一条即可)。
(1)铁在元素周期表的第ⅦB和第ⅠB之间。铁位于第
(2)写出Fe与水反应的化学方程式:
(3)将(NH4)2Fe(SO4)2中非金属元素的简单阴离子按半径由小到大的顺序排列:
(4)同温度同浓度的FeSO4和(NH4)2Fe(SO4)2溶液中,c(Fe2+)是否相等
(5)设计实验,证明(NH4)2Fe(SO4)2·6H2O晶体中含有Fe2+
(6)已知:(NH4)2Fe(SO4)2·6H2O在200℃失去全部结晶水。将一定质量的粉末状该晶体置于坩埚中,保持200℃受热,经冷却、恒重等正确操作,计算得到的1mol晶体中结晶水含量总是偏低,偏低的可能原因是
您最近一年使用:0次
8 . 元素周期表是打开物质世界奥秘之门的一把金钥匙,1869年门捷列夫发现了元素周期律并发表元素周期表。下图为元素周期表的一部分回答下列问题。

(1)上述元素中化学性质最稳定的是_______ (填元素符号下同),金属性最强的是_______ 。
(2)b、c的最高价氧化物对应水化物中,酸性更强的是_______ (用化学式表示),d、e形成的简单阴离子中,还原性更强的是_______ (用离子符号表示)。
(3)h元素的原子结构示意图是_______ ,写出h元素最高价氧化物的一种用途_______ 。
(4)d、e、f三种元素原子半径由大到小的顺序是_______ (用化学符号表示)。
(5)写出j的最高价氧化物对应水化物与g的最高价氧化物对应水化物反应的离子方程式_______ 。
(6)12gb单质在足量d单质中燃烧,所得气体通入 的最高价氧化物的水化物溶液中,完全吸收后,所得溶液中主要阴离子的物质的量之比是
的最高价氧化物的水化物溶液中,完全吸收后,所得溶液中主要阴离子的物质的量之比是_______ 。

(1)上述元素中化学性质最稳定的是
(2)b、c的最高价氧化物对应水化物中,酸性更强的是
(3)h元素的原子结构示意图是
(4)d、e、f三种元素原子半径由大到小的顺序是
(5)写出j的最高价氧化物对应水化物与g的最高价氧化物对应水化物反应的离子方程式
(6)12gb单质在足量d单质中燃烧,所得气体通入
 的最高价氧化物的水化物溶液中,完全吸收后,所得溶液中主要阴离子的物质的量之比是
的最高价氧化物的水化物溶液中,完全吸收后,所得溶液中主要阴离子的物质的量之比是
您最近一年使用:0次
9 . 根据①~⑫元素的编号所在周期表中的位置,用相应的元素符号或者化学用语回答有关问题:
(1)能显+1 价,还能显-1 价的元素是___________ 。
(2)最难形成化合物的元素是___________ 。
(3)单质具有半导体性质的元素是___________ 。
(4)任意排放的氧化物溶于雨水形成酸雨的元素是___________ 。
(5)元素⑦氢化物水溶液与 SiO2反应的化学方程式为___________ 。
(6)最新发现的一种单质是由 60 个原子组成球状结构的分子。这种单质叫足球烯,它是由___________ 元素组成的。
(7)第三周期某元素氢化物(组成为 RH)能和冷水剧烈反应产生氢气,该反应的化学方程式为___________ 。
(8)元素⑤与元素⑩形成化合物化学式为___________ ,该化合物在工业上用途是 ___________ (列举一种即可)。
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 3 | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(1)能显+1 价,还能显-1 价的元素是
(2)最难形成化合物的元素是
(3)单质具有半导体性质的元素是
(4)任意排放的氧化物溶于雨水形成酸雨的元素是
(5)元素⑦氢化物水溶液与 SiO2反应的化学方程式为
(6)最新发现的一种单质是由 60 个原子组成球状结构的分子。这种单质叫足球烯,它是由
(7)第三周期某元素氢化物(组成为 RH)能和冷水剧烈反应产生氢气,该反应的化学方程式为
(8)元素⑤与元素⑩形成化合物化学式为
您最近一年使用:0次
名校
解题方法
10 . 下图为元素周期表的一部分,根据元素①~⑧在表中的位置回答下列问题。
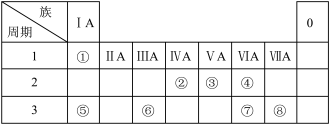
(1)元素⑧的最高价氧化物对应水化物的分子式为_______ ;
(2)元素①与④形成的18电子的化合物的结构式为_______ ;
(3)用电子式表示元素⑤与⑧形成化合物的过程_______ ;
(4)元素⑥的单质与⑤的最高价氧化物对应水化物反应的化学方程式_______ ;
(5)假设元素⑧的对应元素符号为X,若在一定条件下,X单质能够与硫反应生成一种用途广泛的硫化剂S2X2。该硫化剂S2X2与足量水反应有淡黄色沉淀生成,同时生成能够使品红溶液褪色的无色气体,则该反应的化学方程式是_______ (元素X请用具体元素符号表示)。

(1)元素⑧的最高价氧化物对应水化物的分子式为
(2)元素①与④形成的18电子的化合物的结构式为
(3)用电子式表示元素⑤与⑧形成化合物的过程
(4)元素⑥的单质与⑤的最高价氧化物对应水化物反应的化学方程式
(5)假设元素⑧的对应元素符号为X,若在一定条件下,X单质能够与硫反应生成一种用途广泛的硫化剂S2X2。该硫化剂S2X2与足量水反应有淡黄色沉淀生成,同时生成能够使品红溶液褪色的无色气体,则该反应的化学方程式是
您最近一年使用:0次
2021-03-16更新
|
685次组卷
|
6卷引用:湖南省长沙市雅礼中学2020-2021学年高一下学期开学考化学试题



