1 . 根据①~⑫元素的编号所在周期表中的位置,用相应的元素符号或者化学用语回答有关问题:
(1)能显+1 价,还能显-1 价的元素是___________ 。
(2)最难形成化合物的元素是___________ 。
(3)单质具有半导体性质的元素是___________ 。
(4)任意排放的氧化物溶于雨水形成酸雨的元素是___________ 。
(5)元素⑦氢化物水溶液与 SiO2反应的化学方程式为___________ 。
(6)最新发现的一种单质是由 60 个原子组成球状结构的分子。这种单质叫足球烯,它是由___________ 元素组成的。
(7)第三周期某元素氢化物(组成为 RH)能和冷水剧烈反应产生氢气,该反应的化学方程式为___________ 。
(8)元素⑤与元素⑩形成化合物化学式为___________ ,该化合物在工业上用途是 ___________ (列举一种即可)。
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 3 | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(1)能显+1 价,还能显-1 价的元素是
(2)最难形成化合物的元素是
(3)单质具有半导体性质的元素是
(4)任意排放的氧化物溶于雨水形成酸雨的元素是
(5)元素⑦氢化物水溶液与 SiO2反应的化学方程式为
(6)最新发现的一种单质是由 60 个原子组成球状结构的分子。这种单质叫足球烯,它是由
(7)第三周期某元素氢化物(组成为 RH)能和冷水剧烈反应产生氢气,该反应的化学方程式为
(8)元素⑤与元素⑩形成化合物化学式为
您最近一年使用:0次
2 . 摩擦剂是牙膏的主体成分,SiO2是一种常见的摩擦剂。
(1)Si在元素周期表中的位置是_____ 。
(2)根据用途推测SiO2在水中的溶解性:_____ (填“易溶”或“难溶”)。
(3)制备SiO2的方法如下:
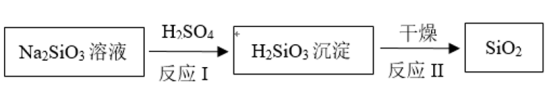
①写出反应I的离子方程式_____ 。
②比较酸性强弱:H2SO4_____ H2SiO3(填“>”或“<”)。
③结合原子结构解释②中酸性关系:Si和S电子层数相同,_____ 。
(4)为满足不同需求,牙膏中还会添加一些特殊物质,如含氟牙膏中添加氟化亚锡(SnF2)。锡的原子结构示意图如图。
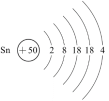
下列说法正确的是_____ (填序号)。
a.Sn元素的最高正化合价为+4
b.Sn的原子半径比Si大
c.Sn和Si均可以作半导体材料
(1)Si在元素周期表中的位置是
(2)根据用途推测SiO2在水中的溶解性:
(3)制备SiO2的方法如下:

①写出反应I的离子方程式
②比较酸性强弱:H2SO4
③结合原子结构解释②中酸性关系:Si和S电子层数相同,
(4)为满足不同需求,牙膏中还会添加一些特殊物质,如含氟牙膏中添加氟化亚锡(SnF2)。锡的原子结构示意图如图。

下列说法正确的是
a.Sn元素的最高正化合价为+4
b.Sn的原子半径比Si大
c.Sn和Si均可以作半导体材料
您最近一年使用:0次
名校
解题方法
3 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:

(1)写出元素a的元素符号___________ ,写出a元素单质的一种用途___________ 。
(2)写出元素b的原子结构示意图___________ 。
(3)在元素b、c、f形成的简单氢化物中,稳定性最强的氢化物的电子式为___________ 。
(4)元素a、d、e最高价氧化物的水化物中碱性最强的是___________ (填化学式),g与d的最高价氧化物的水化物之间发生反应的离子方程式为___________ 。
(5)f2-的半径___________ g-的半径(填“大于”、“小于”、“ 等于”或“不能确定”),从原子结构的因素进行解释:______________ 。

(1)写出元素a的元素符号
(2)写出元素b的原子结构示意图
(3)在元素b、c、f形成的简单氢化物中,稳定性最强的氢化物的电子式为
(4)元素a、d、e最高价氧化物的水化物中碱性最强的是
(5)f2-的半径
您最近一年使用:0次
名校
4 . 针对下面11种元素,完成以下各小题。
(1)地壳中含量最多的元素是________ (填元素符号)
(2)化学性质最不活泼的元素是___________ (填名称)
(3)Cl的离子结构示意图为_____________
(4)C与N相比,原子半径较小的是_______ (填元素名称)
(5)最高价氧化物对应的水化物碱性最强的是___________ (填化学式)
(6)MgO和 中,属于两性氧化物的是
中,属于两性氧化物的是_________________
(7)P、S、Cl的最高价氧化物对应水化物酸性最强的是___________ (填物质名称)
(8)可用来制造计算机芯片的物质是______ ,晶体硅的主要用途是___________ (写出一种)。
(9)在S与Cl的单质中,化学性质较活泼的单质是______________ (填化学式)可用什么化学反应说明该事实(写出反应的化学方程式):______________ 。
| 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | P | S | Cl |
(1)地壳中含量最多的元素是
(2)化学性质最不活泼的元素是
(3)Cl的离子结构示意图为
(4)C与N相比,原子半径较小的是
(5)最高价氧化物对应的水化物碱性最强的是
(6)MgO和
 中,属于两性氧化物的是
中,属于两性氧化物的是(7)P、S、Cl的最高价氧化物对应水化物酸性最强的是
(8)可用来制造计算机芯片的物质是
(9)在S与Cl的单质中,化学性质较活泼的单质是
您最近一年使用:0次
解题方法
5 . 在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是___________ (用元素符号表示)。同周期且金属性最强的元素位于周期表的第___________ 周期___________ 族,写出一种该元素与氯元素形成的化合物的用途___________ 。
您最近一年使用:0次
名校
解题方法
6 . 下表是元素周期表的一部分,根据表中给出的10种元素,按要求作答
(1)化学性质最不活泼的元素是____ (填元素名称);
(2)氮原子的一种氢化物常用作燃料电池的燃料,其电子式为________ ;
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是_________ (填化学式);
(4)碳原子的氢化物和氯气在光照条件下发生第一步反应的化学方程式是_____________ ;
(5)第3周期中气态氢化物最稳定的是________ ;(填化学式);
(6)Si是带来人类文明的重要元素之一,晶体硅的主要用途是___________ (写出一种).
(7)Na、Al最高价氧化物的水化物之间反应的产物通入少量二氧化碳,发生反应的离子方程式是_________________________________ .
(8)结构式为 的有机物分子式是
的有机物分子式是______ ,其中碳元素与氢元素的质量比m(C)∶m(H)=________ (相对原子质量:H—1 C—12)。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Al | Si | S | Cl | Ar |
(2)氮原子的一种氢化物常用作燃料电池的燃料,其电子式为
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是
(4)碳原子的氢化物和氯气在光照条件下发生第一步反应的化学方程式是
(5)第3周期中气态氢化物最稳定的是
(6)Si是带来人类文明的重要元素之一,晶体硅的主要用途是
(7)Na、Al最高价氧化物的水化物之间反应的产物通入少量二氧化碳,发生反应的离子方程式是
(8)结构式为
 的有机物分子式是
的有机物分子式是
您最近一年使用:0次
名校
解题方法
7 . 下表为元素周期表的一部分。
完成下列填空
(1)氮原子的电子排布式为_________ ,Z元素在元素周期表中的位置为______
(2)上表中原子半径最大的元素是(写元素符号)_____________ ,该原子的核外电子占有_____________ 个轨道,有___________ 种运动状态。
(3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是______________
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1moY单质比1mol硫单质得电子多
c.Y和硫两元素单最低价氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1molX的高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出:X的电子式为______________ 该反应的热化学方程式__________________
(5)简述碳的同位素中一种原子的用途___________
| 碳 | 氮 | Y | |
| X | 硫 | Z |
完成下列填空
(1)氮原子的电子排布式为
(2)上表中原子半径最大的元素是(写元素符号)
(3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1moY单质比1mol硫单质得电子多
c.Y和硫两元素单最低价氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1molX的高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出:X的电子式为
(5)简述碳的同位素中一种原子的用途
您最近一年使用:0次
8 . 硅是重要的半导体材料,构成现代电子工业的基础。硅及其化合物在工业中应用广泛,在国防和航天工业中亦有许多用途。
(1)硅原子中最外层电子排布式为___ ,该层电子的电子云有___ 种不同的伸展方向。
(2)温石棉矿是一种硅酸盐类矿物,化学式写作氧化物形式为6MgO•4SiO2•4H2O,其中原子半径最大的元素在周期表中的位置是___ 。SiO2存在与金刚石结构类似的晶体,其中硅氧原子之间以___ 相结合。
a.离子键 b.极性键 c.非极性键 d.范德华力
(3)甲硅烷(SiH4)是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下,10gSiH4自燃放出热量446kJ,请写出其燃烧的热化学方程式:___ ;
(4)SiH4的热稳定性不如CH4,其原因是___ 。
工业上硅铁可以用于冶镁。以煅白(CaO•MgO)为原料与硅铁(含硅75%的硅铁合金)混合,置于密闭设备中于1200℃发生反应:2(CaO•MgO)(s)+Si(s) Ca2SiO4(l)+2Mg(g)
Ca2SiO4(l)+2Mg(g)
(5)常温下镁的还原性强于硅。上述方法能够获得镁的原因是:___ 。
(6)若上述反应在容积为aL的密闭容器中发生,一定能说明反应已达平衡的是___ (选填编号)。
a.反应物不再转化为生成物
b.炉内Ca2SiO4与CaO•MgO的质量比保持不变
c.反应放出的总热量不再改变
d.单位时间内,n(CaO•MgO)消耗:n(Ca2SiO4)生成=2:1
若bg煅白经tmin反应后转化率达70%,该时段内Mg的生成速率是___ 。
(1)硅原子中最外层电子排布式为
(2)温石棉矿是一种硅酸盐类矿物,化学式写作氧化物形式为6MgO•4SiO2•4H2O,其中原子半径最大的元素在周期表中的位置是
a.离子键 b.极性键 c.非极性键 d.范德华力
(3)甲硅烷(SiH4)是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下,10gSiH4自燃放出热量446kJ,请写出其燃烧的热化学方程式:
(4)SiH4的热稳定性不如CH4,其原因是
工业上硅铁可以用于冶镁。以煅白(CaO•MgO)为原料与硅铁(含硅75%的硅铁合金)混合,置于密闭设备中于1200℃发生反应:2(CaO•MgO)(s)+Si(s)
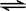 Ca2SiO4(l)+2Mg(g)
Ca2SiO4(l)+2Mg(g)(5)常温下镁的还原性强于硅。上述方法能够获得镁的原因是:
(6)若上述反应在容积为aL的密闭容器中发生,一定能说明反应已达平衡的是
a.反应物不再转化为生成物
b.炉内Ca2SiO4与CaO•MgO的质量比保持不变
c.反应放出的总热量不再改变
d.单位时间内,n(CaO•MgO)消耗:n(Ca2SiO4)生成=2:1
若bg煅白经tmin反应后转化率达70%,该时段内Mg的生成速率是
您最近一年使用:0次
9 . 碳及其化合物在生产、生活中有广泛的用途。
I.金刚砂SiC具有优良的耐磨、耐腐蚀特性,应用广泛。
(1)碳与同周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子,则Q元素在周期表中的位置为____________ ,R的电子式为______________ ;
(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收CCl4的实验操作名称为_____________ ,除去粗产品中少量钠的试剂为______________ ;
(3)碳还原制取SiC,其粗产品中杂质为Si和SiO2。先将20.0g SiC粗产品加入到过量NaOH溶液中充分反应,收集到0.1 mol氢气,过滤SiC固体11.4g,滤液稀释到1L。Si与NaOH溶液反应的离子方程式为____________________ ,硅酸盐的物质的量浓度为____________ 。
II.工业上向氨化的CaSO4悬浊液中通入适量CO2,可制取(NH4)2SO4,其流程如图所示。已知CaSO4的KSP=9.1×10-4,CaCO3的KSP=2.8×10-4。请回答:
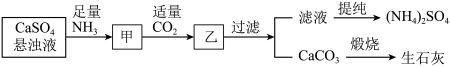
(1)向甲中通入过量CO2__________ (填“有”或“不”)利于CaCO3和(NH4)2SO4的生成,原因是_________________ 。
(2)直接蒸干滤液得到的(NH4)2SO4主要含有的杂质是____________ (填含量最多的一种)。
(3)锅炉水垢中含有的CaSO4,可先用Na2CO3溶液浸泡,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为___________________________ ;
②请分析CaSO4转化为CaCO3的原理:___________________________ 。
I.金刚砂SiC具有优良的耐磨、耐腐蚀特性,应用广泛。
(1)碳与同周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子,则Q元素在周期表中的位置为
(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收CCl4的实验操作名称为
(3)碳还原制取SiC,其粗产品中杂质为Si和SiO2。先将20.0g SiC粗产品加入到过量NaOH溶液中充分反应,收集到0.1 mol氢气,过滤SiC固体11.4g,滤液稀释到1L。Si与NaOH溶液反应的离子方程式为
II.工业上向氨化的CaSO4悬浊液中通入适量CO2,可制取(NH4)2SO4,其流程如图所示。已知CaSO4的KSP=9.1×10-4,CaCO3的KSP=2.8×10-4。请回答:

(1)向甲中通入过量CO2
(2)直接蒸干滤液得到的(NH4)2SO4主要含有的杂质是
(3)锅炉水垢中含有的CaSO4,可先用Na2CO3溶液浸泡,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为
②请分析CaSO4转化为CaCO3的原理:
您最近一年使用:0次
10 . 下表为元素周期表的一部分,列出8种元素在周期表中的位置。用化学用语 回答下列问题:
⑴8种元素中,原子半径最小的是____ ,原子半径最大的是____ ,组成物质性质最稳定的是_____ 。
⑵由⑤组成的单质存在同素异形现象,所组成的同素异形体有:_________ ;
⑶⑥、⑦两种元素最高价氧化物对应的水化物中,碱性由强到弱的的是__________ 。
⑷元素⑧的氢化物的化学式为__________ 。该氢化物的主要用途:用作试剂、航空燃料。写出该氢化物在空气中燃烧的化学方程式为____________ 。
| 族 周期 | Ⅰ A | Ⅱ A | Ⅲ A | Ⅳ A | ⅤA | ⅥA | ⅦA | 0 |
| 第1周期 | ① | ② | ||||||
| 第2周期 | ③ | ④ | ⑤ | |||||
| 第3周期 | ⑥ | ⑦ | ⑧ |
⑴8种元素中,原子半径最小的是
⑵由⑤组成的单质存在同素异形现象,所组成的同素异形体有:
⑶⑥、⑦两种元素最高价氧化物对应的水化物中,碱性由强到弱的的是
⑷元素⑧的氢化物的化学式为
您最近一年使用:0次



