名校
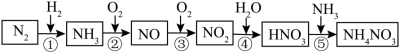
1 . 氮元素及其化合物的转化关系如图所示。___________ 。
(2)氮元素在元素周期表中的位置是___________ 。
(3)已知1molNH3发生反应②,完全反应生成NO和水蒸气时放出226 kJ的热,该反应的热化学方程式是___________ 。
(4)汽车尾气净化装置中,气体在催化剂表面吸附与解吸作用的过程如图所示。___________ 。
②催化转化过程中,理论上每生成1mol 时,转移的电子为
时,转移的电子为___________ mol。
(2)氮元素在元素周期表中的位置是
(3)已知1molNH3发生反应②,完全反应生成NO和水蒸气时放出226 kJ的热,该反应的热化学方程式是
(4)汽车尾气净化装置中,气体在催化剂表面吸附与解吸作用的过程如图所示。
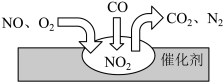
②催化转化过程中,理论上每生成1mol
 时,转移的电子为
时,转移的电子为
您最近一年使用:0次
2024-05-06更新
|
59次组卷
|
2卷引用:江苏省扬州市邗江中学2023-2024学年高一下学期三月检测化学试题
名校
解题方法
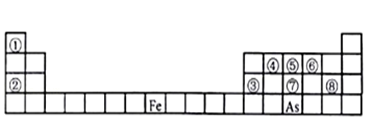
2 . 如图为元素周期表的一部分,请根据元素①~⑧在表中的位置,回答下列问题:

(1)请写出元素⑦在元素周期表中的位置___________ 。在上述元素的最高价氧化物对应的水化物中,酸性最强的是___________ (用化学式表示)。
(2)由元素①、④、⑤形成的化合物的电子式为___________ ,该物质属于___________ (填“离子”或“共价”)化合物。
(3)③、④、⑤、⑥的简单离子半径由大到小的顺序是___________ (用离子符号表示)。
(4)在发生地震后,地震灾区需要大量的“84消毒液”来消毒杀菌。84消毒液(主要成分为NaClO)和洁厕灵(主要成分为盐酸)混合使用会产生一种有毒气体,写出两者混合时发生反应的离子方程式:___________ 。
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:
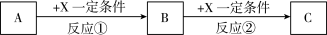
若A、B、C含同一金属元素,X为电解质溶液,可电离出 ,所有反应都在溶液中进行。B的化学式为
,所有反应都在溶液中进行。B的化学式为___________ ,X的化学式为___________ 。

(1)请写出元素⑦在元素周期表中的位置
(2)由元素①、④、⑤形成的化合物的电子式为
(3)③、④、⑤、⑥的简单离子半径由大到小的顺序是
(4)在发生地震后,地震灾区需要大量的“84消毒液”来消毒杀菌。84消毒液(主要成分为NaClO)和洁厕灵(主要成分为盐酸)混合使用会产生一种有毒气体,写出两者混合时发生反应的离子方程式:
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:

若A、B、C含同一金属元素,X为电解质溶液,可电离出
 ,所有反应都在溶液中进行。B的化学式为
,所有反应都在溶液中进行。B的化学式为
您最近一年使用:0次
3 . 下图是元素周期表的一部分。
Ⅰ、用化学用语回答下列问题:
(1)由②、⑥两元素形成的强氧化性物质的电子式为_______ ,由①、⑤两元素构成的10电子化合物的形成过程为_______ 。
(2)⑦、⑧的最高价含氧酸的酸性较弱的是_______ 。(化学式表示)
(3)As在元素周期表中位置为__ ;氢化物的沸点:NH3 _______ AsH3(填“>”或“<”)
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为_______ ,当消耗75g还原剂时,电子转移了__ mol。
Ⅱ、A、B、C、D、E、X是上述周期表给出元素组成的常见单质或化合物。已知A、B、C、D、E、X存在如下图所示转化关系(部分生成物和反应条件略去),若常温下A为红棕色气体,B为强酸,X为常见金属单质。
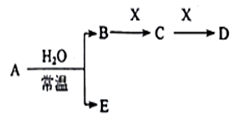
(1)A与水反应的化学方程式为_______ 。
(2)工业上常用CO热还原法冶炼X,写出其化学方程式_______ 。
(3)某温度下(>100℃)若m克X与H2O反应放出QkJ(Q>0)的热量。写出该反应的热化学方程式_______ 。
Ⅲ、由①、⑤、⑥、S和Fe五种元素组成的相对分子质量为392的化合物B,B中含有结晶水。对化合物B进行如下实验:
a.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色有刺激性气味气体;过一段时间白色沉淀变为灰绿色,最终变为红褐色。
b.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
(1)由实验a、b推知B溶液中含有的离子为_______ ;
(2)B的化学式为_______ 。

Ⅰ、用化学用语回答下列问题:
(1)由②、⑥两元素形成的强氧化性物质的电子式为
(2)⑦、⑧的最高价含氧酸的酸性较弱的是
(3)As在元素周期表中位置为
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为
Ⅱ、A、B、C、D、E、X是上述周期表给出元素组成的常见单质或化合物。已知A、B、C、D、E、X存在如下图所示转化关系(部分生成物和反应条件略去),若常温下A为红棕色气体,B为强酸,X为常见金属单质。

(1)A与水反应的化学方程式为
(2)工业上常用CO热还原法冶炼X,写出其化学方程式
(3)某温度下(>100℃)若m克X与H2O反应放出QkJ(Q>0)的热量。写出该反应的热化学方程式
Ⅲ、由①、⑤、⑥、S和Fe五种元素组成的相对分子质量为392的化合物B,B中含有结晶水。对化合物B进行如下实验:
a.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色有刺激性气味气体;过一段时间白色沉淀变为灰绿色,最终变为红褐色。
b.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
(1)由实验a、b推知B溶液中含有的离子为
(2)B的化学式为
您最近一年使用:0次
名校
4 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的元素周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位、构。性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
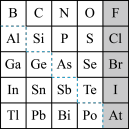
(1) 的结构示意图是
的结构示意图是___________ 。
(2)元素In在元素周期表中的位置是___________ 。
(3)P的最高价氧化物的化学式为___________ ,Al元素的最高价氧化物对应的水化物与S元素的最高价氧化物对应的水化物发生反应的离子方程式是___________ 。
(4)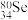 的中子数与电子数的差值是
的中子数与电子数的差值是___________ ;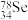 和
和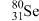 的物理性质
的物理性质___________ (填“相同”或“不同”),化学性质___________ (填“相同”或“不同”)。
(5)根据元素周期律及事实推断:
①在溶液中下列反应能发生的是___________ 。
A.
B.
C.
②氢化物的还原性:
___________  (填“>”或“<”)。
(填“>”或“<”)。

(1)
 的结构示意图是
的结构示意图是(2)元素In在元素周期表中的位置是
(3)P的最高价氧化物的化学式为
(4)
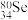 的中子数与电子数的差值是
的中子数与电子数的差值是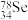 和
和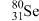 的物理性质
的物理性质(5)根据元素周期律及事实推断:
①在溶液中下列反应能发生的是
A.

B.

C.

②氢化物的还原性:

 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
5 . 元素在周期表中的位置与元素原子的结构、性质间的关系
(1)在元素周期表中,同族元素价层电子数_______ ,是同族元素性质_______ 的结构基础。
(2)长周期比短周期多出的元素,其原子的最外层电子数_______ 2(Pd除外),所以它们全部是_______ 。
(1)在元素周期表中,同族元素价层电子数
(2)长周期比短周期多出的元素,其原子的最外层电子数
您最近一年使用:0次
6 . Ⅰ.我国科学家在铁基高温超导体的研究上取得重大突破,发现了该超导体是由Fe、Ba、As三种元素组成,这为进一步理解超导配对机理及其与电荷密度波的关系提供了重要实验证据。回答下列问题:
(1)As元素属于元素周期表的________ 区元素,其价电子排布式是________ 。
(2)基态Fe原子核外电子排布式为________ 。 的稳定性强于
的稳定性强于 ,从微观角度解释其原因为
,从微观角度解释其原因为________ 。
Ⅱ.某元素原子的最外电子层只有一个电子,该电子的电子层数n=4。请回答下列问题:
(3)符合上述条件的元素共有________ 种。
(4)在符合上述条件的元素中,原子序数最小的在元素周期表中的________ 区(用符号填空),原子序数最大的在周期表位置________ 。
(5)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为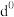 或
或 排布时,无颜色,为
排布时,无颜色,为 排布时,有颜色,如
排布时,有颜色,如 显粉红色。据此判断,
显粉红色。据此判断,
________ (填“无”或“有”)颜色。
(1)As元素属于元素周期表的
(2)基态Fe原子核外电子排布式为
 的稳定性强于
的稳定性强于 ,从微观角度解释其原因为
,从微观角度解释其原因为Ⅱ.某元素原子的最外电子层只有一个电子,该电子的电子层数n=4。请回答下列问题:
(3)符合上述条件的元素共有
(4)在符合上述条件的元素中,原子序数最小的在元素周期表中的
(5)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为
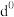 或
或 排布时,无颜色,为
排布时,无颜色,为 排布时,有颜色,如
排布时,有颜色,如 显粉红色。据此判断,
显粉红色。据此判断,
您最近一年使用:0次
名校
7 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
(1)元素 在元素周期表中的位置为第
在元素周期表中的位置为第_______ 周期第_______ 族。
(2)分别写出由第二周期元素与H元素形成的含10电子的一个分子和一个离子_______ 、_______ 。
(3)有以下几种粒子: 、
、 、
、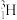 、
、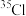 、
、 、
、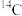 、
、 。其中含有
。其中含有_______ 种核素,互为同位素的有_______ 。由 、
、 、
、 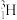 与
与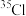 、
、  形成的氯化氢分子相对分子质量有
形成的氯化氢分子相对分子质量有_______ 种。
(4)以下说法正确的是_______。
(1)元素
 在元素周期表中的位置为第
在元素周期表中的位置为第(2)分别写出由第二周期元素与H元素形成的含10电子的一个分子和一个离子
(3)有以下几种粒子:
 、
、 、
、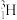 、
、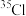 、
、 、
、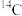 、
、 。其中含有
。其中含有 、
、 、
、 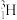 与
与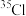 、
、  形成的氯化氢分子相对分子质量有
形成的氯化氢分子相对分子质量有(4)以下说法正确的是_______。
| A.碱金属单质和卤素单质随着核电荷数的增加,熔沸点依次升高,密度依次增大 |
| B.由于F、Cl、Br、I的非金属性依次减弱,可推出HF、HCl、HBr、HI的还原性及热稳定性依次减弱 |
| C.第85号元素砹At是核电荷数最大的卤素,其单质At2可能是一种有色固体,难溶于水易溶于有机溶剂 |
| D.在新制氯水中加入少量铁粉,发生2Fe+3Cl2=2FeCl3 |
您最近一年使用:0次
名校
8 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系,下图是元素周期表的一部分,回答下列问题:
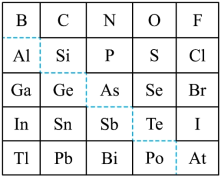
(1)元素Ga在元素周期表中的位置为:______ ;
(2)Sn的最高正价为______ ,C1的最高价氧化物对应水化物的化学式为______ ;
(3)根据元素周期律,推断
①表中元素形成的氢化物中热稳定性最高的是______ (写化学式),其电子式为______ 。
②H3AsO4、H2SeO4的酸性强弱为:H3AsO4______ H2SeO4(填“>”、<”、“=”或“无法比较”);
③氢化物的还原性:H2O______ H2S(填“>”、“<”、“=”或“无法比较”)。
④原子半径比较:N______ Si(填“>”、“<”、“=”或“无法比较”)。

(1)元素Ga在元素周期表中的位置为:
(2)Sn的最高正价为
(3)根据元素周期律,推断
①表中元素形成的氢化物中热稳定性最高的是
②H3AsO4、H2SeO4的酸性强弱为:H3AsO4
③氢化物的还原性:H2O
④原子半径比较:N
您最近一年使用:0次
2023高三·全国·专题练习
9 . 1869年,俄国化学家门捷列夫提出了元素周期律,并在此基础上发表了第一张元素周期表。为了纪念元素周期表诞生150年,联合国将2019年定为“国际化学元素周期表年”,并认为元素周期表是“科学共同的语言”。
(1)认识元素周期表的结构:
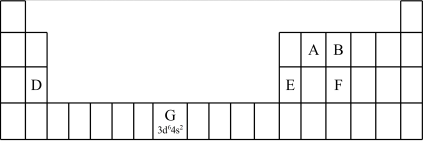
①在元素周期表中,第ⅠB、ⅡB元素属于___________ 区。
②2017年5月9日我国发布了113号Nh、115号Mc、117号Ts、118号Og四种元素,则下列说法正确的是___________ (填字母序号)。
a.113号元素在周期表中的位置是第七周期VB族
b.117号元素Ts位于金属与非金属分界线上,属于准金属,可能是半导体
c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:Nh>Mc
(2)认识原子结构与元素周期表的关系:见表中元素G的信息,其中“3d64s2”称为该元素原子的___________ ,该元素M能层上具有___________ 种不同运动状态的电子。
(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D___________ E(填“>”“<”或“=”)。
②气态氢化物的沸点:B___________ F(填“>”“<”或“=”),理由是___________ 。
(1)认识元素周期表的结构:

①在元素周期表中,第ⅠB、ⅡB元素属于
②2017年5月9日我国发布了113号Nh、115号Mc、117号Ts、118号Og四种元素,则下列说法正确的是
a.113号元素在周期表中的位置是第七周期VB族
b.117号元素Ts位于金属与非金属分界线上,属于准金属,可能是半导体
c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:Nh>Mc
(2)认识原子结构与元素周期表的关系:见表中元素G的信息,其中“3d64s2”称为该元素原子的
(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D
②气态氢化物的沸点:B
您最近一年使用:0次
名校
解题方法
10 . 155年前门捷列夫制得世界上第一张元素周期表,它反映了元素之间的内在联系,是对元素的一种很好的自然分类。如图为现代元素周期表的一部分,请回答下列问题:(以下问题均用相应的化学用语表达 )

(1)在这10种元素中,非金属性最强的元素在周期表中的位置是___________ 。
(2)由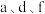 三种元素形成的化合物含有的化学键有
三种元素形成的化合物含有的化学键有___________ (填写化学键类型),属于___________ 化合物。
(3)元素b、c形成的简单气态氢化物中较稳定的是___________ (写具体的化学式,下同);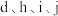 的简单离子半径由大到小的顺序排列为
的简单离子半径由大到小的顺序排列为___________ 。
(4)用电子式表示元素g与e的化合物形成的过程___________ 。
(5)在含有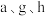 简单阳离子的
简单阳离子的 溶液中,逐滴滴加
溶液中,逐滴滴加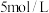 的
的 溶液到过量,生成沉淀的质量与加入的
溶液到过量,生成沉淀的质量与加入的 溶液的体积关系如图所示。由图中数据分析计算
溶液的体积关系如图所示。由图中数据分析计算
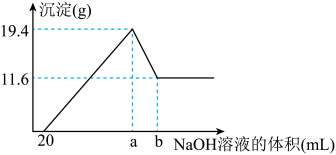
①沉淀减少时发生的离子方程式:___________ 。
②a点的数值为:___________ mL。

(1)在这10种元素中,非金属性最强的元素在周期表中的位置是
(2)由
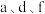 三种元素形成的化合物含有的化学键有
三种元素形成的化合物含有的化学键有(3)元素b、c形成的简单气态氢化物中较稳定的是
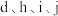 的简单离子半径由大到小的顺序排列为
的简单离子半径由大到小的顺序排列为(4)用电子式表示元素g与e的化合物形成的过程
(5)在含有
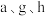 简单阳离子的
简单阳离子的 溶液中,逐滴滴加
溶液中,逐滴滴加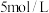 的
的 溶液到过量,生成沉淀的质量与加入的
溶液到过量,生成沉淀的质量与加入的 溶液的体积关系如图所示。由图中数据分析计算
溶液的体积关系如图所示。由图中数据分析计算
①沉淀减少时发生的离子方程式:
②a点的数值为:
您最近一年使用:0次



