1 . 一定条件下,含氮元素的物质可发生如图所示的循环转化。回答下列问题。
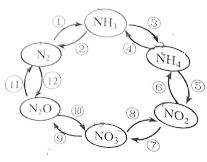
(1)氮元素在元素周期表中的位置___ 。
(2)图中属于“氮的固定”的是___ (填序号,下同);转化过程中发生非氧化还原反应的是___ 。
(3)若“反应⑦”是在NO2与H2O的作用下实现,则该反应中氧化剂与还原剂的物质的量之比为___ 。
(4)若“反应⑨”是在酸性条件下由NO 与Zn作用实现,则该反应的离子方程式为
与Zn作用实现,则该反应的离子方程式为___ 。

(1)氮元素在元素周期表中的位置
(2)图中属于“氮的固定”的是
(3)若“反应⑦”是在NO2与H2O的作用下实现,则该反应中氧化剂与还原剂的物质的量之比为
(4)若“反应⑨”是在酸性条件下由NO
 与Zn作用实现,则该反应的离子方程式为
与Zn作用实现,则该反应的离子方程式为
您最近一年使用:0次
名校
2 . 元素周期表体现了元素“位-构-性”的关系,下图是元素周期表的一部分,回答下列问题:
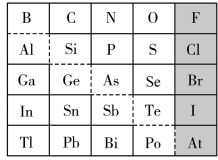
(1)Ga元素的原子结构示意图如图所示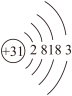 ,则其在元素周期表中的位置为
,则其在元素周期表中的位置为___________ 。
(2)Ge元素位于中金属元素和非金属元素的分界处,其最高正价为___________ ,可作___________ 材料使用;Bi元素的最高价氧化物为___________ (填化学式,下同);I元素的最高价氧化物对应的水化物为___________ 。
(3)以上元素中,失电子能力最强的元素是___________ ,非金属性最强的元素是___________ 。
(4)根据元素周期律等有关知识,推断:
①阴影部分元素对应的氢化物中最稳定的是___________ 。
② 、
、 、
、 、
、 ,四种离子半径由大到小的顺序:
,四种离子半径由大到小的顺序:___________ (用离子符号排序)。
③ 、
、 、
、 的酸性由强到弱的顺序:
的酸性由强到弱的顺序:___________ 。

(1)Ga元素的原子结构示意图如图所示
 ,则其在元素周期表中的位置为
,则其在元素周期表中的位置为(2)Ge元素位于中金属元素和非金属元素的分界处,其最高正价为
(3)以上元素中,失电子能力最强的元素是
(4)根据元素周期律等有关知识,推断:
①阴影部分元素对应的氢化物中最稳定的是
②
 、
、 、
、 、
、 ,四种离子半径由大到小的顺序:
,四种离子半径由大到小的顺序:③
 、
、 、
、 的酸性由强到弱的顺序:
的酸性由强到弱的顺序:
您最近一年使用:0次
解题方法
3 . 含氯物质在生产、生活中有重要作用。工业上常用次氯酸钠处理含有NO等氮氧化物的尾气,反应方程式如下:NaClO + NO + H2O —— NaCl + HNO3 (未配平)。完成下列填空。
(1)氯在元素周期表中的位置是______________________________ ,其所在主族的元素中,最高价氧化物对应的水化物酸性最强的是_______________ (填化学式)。
(2)配平上述反应方程式_______ 。
每有0.3mol电子发生转移,可消耗标准状况下NO气体的体积约为____________ L。
(3)NaClO溶液中存在如下关系:c(OH-)_____ c(HClO)(填“>”、“=”、或“<”)。
其他条件相同,随着NaClO溶液初始pH(用稀硫酸调节)的不同,NO转化率如图。
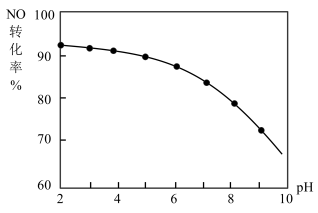
(4)NaClO溶液的初始pH越大,NO的转化率越________________ (填“高”或“低”),其原因是_____________________ 。取少量NaClO溶液和KClO3溶液,分别置于A试管和B试管,滴加试剂,观察现象,记录于下表。
(5)取少量NaClO溶液和KClO3溶液,分别置于A试管和B试管,滴加试剂,观察现象,记录于下表。
请将表格填写完整。
(1)氯在元素周期表中的位置是
(2)配平上述反应方程式
每有0.3mol电子发生转移,可消耗标准状况下NO气体的体积约为
(3)NaClO溶液中存在如下关系:c(OH-)
其他条件相同,随着NaClO溶液初始pH(用稀硫酸调节)的不同,NO转化率如图。

(4)NaClO溶液的初始pH越大,NO的转化率越
(5)取少量NaClO溶液和KClO3溶液,分别置于A试管和B试管,滴加试剂,观察现象,记录于下表。
请将表格填写完整。
滴加KI溶液 | 再滴加CCl4,振荡、静置 | 结论 | |
A试管 | 溶液变为棕黄色 | 溶液分层,下层显 | 氧化性强弱:(填“>”或“<”) KClO3 |
B试管 | 无现象 | 溶液分层,均无色 |
您最近一年使用:0次
名校
解题方法
4 . 请回答下列问题。
(1)在第三周期元素中,化学性质最不活泼的是_______ ,可用于制半导体材料的元素是_______ ,最高价氧化物的水化物碱性最强的是_______ ,酸性最强的是_______ ,具有两性的是_______ (以上均用化学式填空)。
(2)在C、N、O、F中,原子半径最大的是_______ 。
(3)第32号元素在元素周期表中的位置为_______ 。
(4)由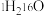 与
与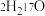 所代表的物质中,共有
所代表的物质中,共有_______ 种元素,_______ 种原子,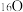 、
、 的关系是
的关系是_______ 。
(5)写出钠、铝最高价氧化物的水化物之间反应的化学方程式:_______ 。
(1)在第三周期元素中,化学性质最不活泼的是
(2)在C、N、O、F中,原子半径最大的是
(3)第32号元素在元素周期表中的位置为
(4)由
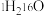 与
与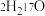 所代表的物质中,共有
所代表的物质中,共有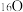 、
、 的关系是
的关系是(5)写出钠、铝最高价氧化物的水化物之间反应的化学方程式:
您最近一年使用:0次
解题方法
5 . 下表是元素周期表的一部分。
回答问题:
(1)门捷列夫科学地预言了“类铝”元素Ga, Ga在元素周期表中的位置是第_______ 周期、第_______ 族。
(2)第三周期主族元素中,金属性最强的元素原子结构示意图为_______ 。
(3)碳元素的一种放射性核素 C可用于文物年代的测定,
C可用于文物年代的测定, C 的原子核内中子数为
C 的原子核内中子数为_______ 。
(4)某研究小组探究氯与溴非金属性的强弱关系,过程如下:
[预测]非金属性: Cl>Br。
[设计与实验]如图所示,在点滴板的2个孔穴中分别滴入3滴新制氯水,然后向其中之一滴加3滴NaBr溶液。

[证据与分析]滴加NaBr溶液的孔穴中,溶液颜色变深,说明有Br2生成。
[结论]预测_______ (选项“正确”或“不正确”)。
[解释]从原子结构的角度解释为_______ 。
族 周期 | I A | IIA | IIIA | IVA | VA | VIA | VIIA |
| 2 | C | ||||||
| 3 | Na | Mg | Al | Si | P | S | Cl |
| 4 | Ga | Br |
回答问题:
(1)门捷列夫科学地预言了“类铝”元素Ga, Ga在元素周期表中的位置是第
(2)第三周期主族元素中,金属性最强的元素原子结构示意图为
(3)碳元素的一种放射性核素
 C可用于文物年代的测定,
C可用于文物年代的测定, C 的原子核内中子数为
C 的原子核内中子数为(4)某研究小组探究氯与溴非金属性的强弱关系,过程如下:
[预测]非金属性: Cl>Br。
[设计与实验]如图所示,在点滴板的2个孔穴中分别滴入3滴新制氯水,然后向其中之一滴加3滴NaBr溶液。

[证据与分析]滴加NaBr溶液的孔穴中,溶液颜色变深,说明有Br2生成。
[结论]预测
[解释]从原子结构的角度解释为
您最近一年使用:0次
21-22高一上·全国·课前预习
解题方法
6 . 门捷列夫在研究元素周期表时,科学地预言了11种尚未发现的元素,为它们在周期表中留下了空位。例如:他认为铝的下方有一个与铝类似的元素“类铝”,并预测了它的性质。1875年,法国化学家布瓦博德朗发现了这种元素,将它命名为“镓”,镓的性质与门捷列夫预测的一样。门捷列夫还预测在硅和锡之间存在一种元素“类硅”,15年后该元素被德国化学家文克勒发现,为了纪念他的祖国,将其命名为“锗”。
2016年国际纯粹与应用化学联合会(IUPAC)正式宣布,元素周期表中将加入4种新元素,原子序数分别为113、115、117和118.这可是件大事,因为这四种元素都是在实验室合成的,放射性强,还特别重。也因此而补齐了元素周期表的第七行。他们的发现也为科学家在未来合成更重要、更有实用价值的元素提供了可能。
问题:元素周期表给科学工作者发现元素提供了哪些依据_____ ?元素周期表中元素的位置和性质之间存在着怎样的内在联系_____ ?
2016年国际纯粹与应用化学联合会(IUPAC)正式宣布,元素周期表中将加入4种新元素,原子序数分别为113、115、117和118.这可是件大事,因为这四种元素都是在实验室合成的,放射性强,还特别重。也因此而补齐了元素周期表的第七行。他们的发现也为科学家在未来合成更重要、更有实用价值的元素提供了可能。
问题:元素周期表给科学工作者发现元素提供了哪些依据
您最近一年使用:0次
7 . 下表是元素周期表的一部分。表中所列字母分别代表一种元素。
回答下列问题:
(1)j在元素周期表中的位置是______ 。
(2)e、h、m形成的简单离子其半径由大到小的顺序为________ 。(填写离子符号)
(3)n与g形成的化合物为______ (填写化学式,下同),将该化合物进行焰色反应,火焰呈______ 色。
(4)k、1形成的最高价氧化物的水化物,酸性由强到弱的顺序为______ 。
(5)g的最高价氧化物对应的水化物与i的最高价氧化物对应的水化物反应的离子方程式为______ 。
(6)某同学欲探究元素性质递变规律与原子结构的关系,进行如下实验:
(实验操作)取已除去氧化膜且面积相等的镁条和铝条,分别投入2mL1mol/L盐酸中;
(实验现象)镁与酸反应比铝更剧烈;
(实验结论)①金属性:Mg_____ Al(选填“>”或“<”);
(查阅资料)原子半径(nm)Mg:0.160 Al:0.143;
(思考)②利用元素周期律对上述实验结论进行解释______ 。
| a | b | |||||||
| c | d | e | f | |||||
| g | h | i | j | k | l | m | ||
| n |
(1)j在元素周期表中的位置是
(2)e、h、m形成的简单离子其半径由大到小的顺序为
(3)n与g形成的化合物为
(4)k、1形成的最高价氧化物的水化物,酸性由强到弱的顺序为
(5)g的最高价氧化物对应的水化物与i的最高价氧化物对应的水化物反应的离子方程式为
(6)某同学欲探究元素性质递变规律与原子结构的关系,进行如下实验:
(实验操作)取已除去氧化膜且面积相等的镁条和铝条,分别投入2mL1mol/L盐酸中;
(实验现象)镁与酸反应比铝更剧烈;
(实验结论)①金属性:Mg
(查阅资料)原子半径(nm)Mg:0.160 Al:0.143;
(思考)②利用元素周期律对上述实验结论进行解释
您最近一年使用:0次
2022-01-14更新
|
785次组卷
|
4卷引用:湖南省怀化市2021-2022学年高一上学期期末考试化学试题
湖南省怀化市2021-2022学年高一上学期期末考试化学试题(已下线)第四章 物质结构 元素周期律(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)湖北省孝感市新高考联考协作体2022-2023学年高二上学期9月联考化学试题(已下线)【2023】【高一下】【其他】【杭高卷四-期中复习卷】【高中化学】【刘尼尼收集】
8 . 下表显示了元素周期表中短周期的一部分,D、E、G、Q、M、X代表6种短周期元素,请回答以下问题。
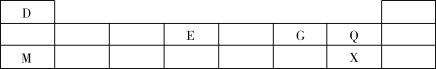
(1)E在元素周期表中的位置是第___________ 周期,第___________ 族,其原子结构示意图为___________ 。
(2)G的元素符号是___________ ,M的元素符号是___________ ,二者原子半径的关系是:G___________ M(填“>”“=”或“<”)。
(3)由M、X组成的化合物的电子式为___________ (用元素符号表示,下同),它属于___________ 化合物(填“离子”或“共价”)。
(4)用电子式表示DX的形成过程___________ ,DX中所含化学键的类型是___________ 。
(5)上述6种元素中,非金属性最强的是___________ 。

(1)E在元素周期表中的位置是第
(2)G的元素符号是
(3)由M、X组成的化合物的电子式为
(4)用电子式表示DX的形成过程
(5)上述6种元素中,非金属性最强的是
您最近一年使用:0次
解题方法
9 . 我国的食品添加剂有多种,如富硒(Se)酵母、二氧化硅、硫黄等,新品种食品添加剂的安全性需通过审查和测试,食品添加剂包括食品营养强化剂、风味改良剂、结构改善剂、防腐剂等,用于食品生产中能更好地满足吃货们的心愿,丰富舌尖上的营养和美味。请回答下列问题:
(1)二氧化硅是一种新型添加剂,用作抗结剂。硅元素在元素周期表中的位置为___________ ;普通玻璃的主要成分为二氧化硅,用氢氟酸蚀刻普通玻璃时,发生反应的化学方程式为___________ 。
(2)食品添加剂中可能存在的部分短周期元素的最高正化合价或最低负化合价与原子序数的关系如图所示(已知:a为非金属元素)。
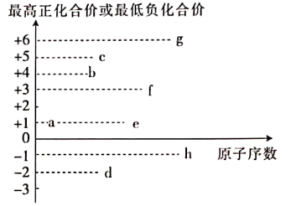
①由a、c、d三种元素形成的离子化合物的化学式为___________ 。
②图中所示元素中金属性最强的是___________ (填元素符号),工业上得到该元素的单质的原理为___________ (填化学方程式)。
③e、f、g元素的简单离子半径由大到小的顺序为___________ (用离子符号回答)。
④低温下,h的单质与化合物eda的稀溶液的反应中的氧化产物为___________ (填化学式)。
⑤a2d2可用于处理碱性工业废水中的bc-,发生氧化还原反应,产物为一种酸根离子和常见的碱性气体,发生反应的离子方程式为___________ 。
(1)二氧化硅是一种新型添加剂,用作抗结剂。硅元素在元素周期表中的位置为
(2)食品添加剂中可能存在的部分短周期元素的最高正化合价或最低负化合价与原子序数的关系如图所示(已知:a为非金属元素)。

①由a、c、d三种元素形成的离子化合物的化学式为
②图中所示元素中金属性最强的是
③e、f、g元素的简单离子半径由大到小的顺序为
④低温下,h的单质与化合物eda的稀溶液的反应中的氧化产物为
⑤a2d2可用于处理碱性工业废水中的bc-,发生氧化还原反应,产物为一种酸根离子和常见的碱性气体,发生反应的离子方程式为
您最近一年使用:0次
2021-11-05更新
|
418次组卷
|
3卷引用:安徽省部分学校2021-2022学年高三上学期10月联考化学试题
安徽省部分学校2021-2022学年高三上学期10月联考化学试题河北省石家庄市保定市2022届高三10月月考化学试题(已下线)解密05 物质结构 元素周期律(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)
10 . 元素周期表体现了元素的“位一构—性”的关系,揭示了元素间的内在联系。下表列出部分元素在周期表中的位置。请回答下列问题。
(1)元素①④⑨形成的化合物中含有的化学键有 ___________ 。
(2)元素②③最高价氧化物对应水化物的酸性较强的是___________ (填化学式, 下同)。
(3)元素⑤⑧氢化物的稳定性较大的是___________ 。
(4)元素⑥⑦最高价氧化物对应的水化物之间发生反应的离子方程式为___________ 。
(5)如果发现119号元素,它应该位于周期表的位置为___________ 。
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ |
(2)元素②③最高价氧化物对应水化物的酸性较强的是
(3)元素⑤⑧氢化物的稳定性较大的是
(4)元素⑥⑦最高价氧化物对应的水化物之间发生反应的离子方程式为
(5)如果发现119号元素,它应该位于周期表的位置为
您最近一年使用:0次



