1 . 核外电子排布与元素周期系的基本结构
①根据构造原理得出的核外电子排布可以解释元素周期系中每个周期的元素数。第一周期从1s1开始,以1s2结束,只有_______ 种元素。其余各周期总是从ns能级开始,以np结束,而从ns能级开始以np结束递增的核电荷数(或电子数)就_______ 每个周期里的元素数。
②周期、能级组、元素种类的对应关系
①根据构造原理得出的核外电子排布可以解释元素周期系中每个周期的元素数。第一周期从1s1开始,以1s2结束,只有
②周期、能级组、元素种类的对应关系
| 周期 | 对应能级组 | 对应能级组最多所能容纳的电子数 | 周期中所含元素种类 |
| 1 | 1s | 2 | 2 |
| 2 | 8 | ||
| 3 | 3s、3p | 8 | 8 |
| 4 | 18 | ||
| 5 | 5s、4d、5p | 18 | 18 |
| 6 | 32 | ||
| 7 | 7s、5f、6d、7p | 32 | 32 |
您最近一年使用:0次
2 . 如图是氨元素的几种价态与物质类别的对应关系:

回答下列问题:
(1)写出氮元素在元素周期表的位置_______ 。
(2)从氢元素化合价分析, 具有氧化性和还原性。写出
具有氧化性和还原性。写出 生成A的化学反应方程式:
生成A的化学反应方程式:_______ ,这个反应 体现了
体现了_______ 性。
(3) 与图中的物质C常用于检验
与图中的物质C常用于检验 的存在,则C的化学式为
的存在,则C的化学式为_______ 。写出用C检验 的存在的离子方程式
的存在的离子方程式_______ 。
(4)物质B为氮元素的气态氢化物,B的化学式为_______ ;实验室制取B的化学方程式为_______ 。
(5)浓硝酸与木炭在加热条件下反应的化学方程式为_______ 。

回答下列问题:
(1)写出氮元素在元素周期表的位置
(2)从氢元素化合价分析,
 具有氧化性和还原性。写出
具有氧化性和还原性。写出 生成A的化学反应方程式:
生成A的化学反应方程式: 体现了
体现了(3)
 与图中的物质C常用于检验
与图中的物质C常用于检验 的存在,则C的化学式为
的存在,则C的化学式为 的存在的离子方程式
的存在的离子方程式(4)物质B为氮元素的气态氢化物,B的化学式为
(5)浓硝酸与木炭在加热条件下反应的化学方程式为
您最近一年使用:0次
23-24高二下·全国·课后作业
3 . 1869年俄国科学家门捷列夫绘制出了第一张元素周期表,成为化学史上的里程碑之一,且大大地促进了化学学科的快速发展。下表是现代元素周期表的一部分,请据表回答下列问题:
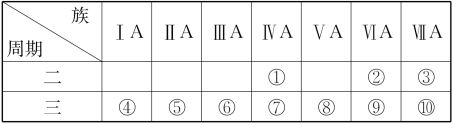
(1)元素③的名称是___________ ,金属性最强的元素是___________ (填元素符号)。
(2)①②⑤三种元素原子半径由大到小的顺序为___________ (填序号)。
(3)元素⑦的单质的一种用途是___________ (填写“制造玻璃”或“制造计算机芯片”)。
(4)元素⑧⑨⑩最高价氧化物的水化物中酸性最强的是___________ (填化学式)。

(1)元素③的名称是
(2)①②⑤三种元素原子半径由大到小的顺序为
(3)元素⑦的单质的一种用途是
(4)元素⑧⑨⑩最高价氧化物的水化物中酸性最强的是
您最近一年使用:0次
解题方法
4 . 水泥是人类最伟大的发明之一,主要成分为硅酸三钙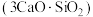 。将其与适量的水反应,形成相互交联的结构,发生的反应为
。将其与适量的水反应,形成相互交联的结构,发生的反应为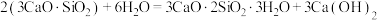 。回答下列问题:
。回答下列问题:
(1)为了加快硅酸三钙与水的反应速率,可采用的方式为_______ (填一种即可)。
(2)Si在元素周期表中的位置为_______ 。
(3) 的电子式为
的电子式为_______ , 的空间结构为
的空间结构为_______ 。
(4)元素C、O、Si、Ca的原子半径由大到小的顺序为_______ 。
(5)带有玻璃塞的磨口玻璃瓶不能用来盛装NaOH溶液的原因为_______ (用化学方程式表示)。
(6)写出 在农业上的一种用途:
在农业上的一种用途:_______ 。
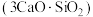 。将其与适量的水反应,形成相互交联的结构,发生的反应为
。将其与适量的水反应,形成相互交联的结构,发生的反应为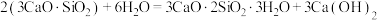 。回答下列问题:
。回答下列问题:(1)为了加快硅酸三钙与水的反应速率,可采用的方式为
(2)Si在元素周期表中的位置为
(3)
 的电子式为
的电子式为 的空间结构为
的空间结构为(4)元素C、O、Si、Ca的原子半径由大到小的顺序为
(5)带有玻璃塞的磨口玻璃瓶不能用来盛装NaOH溶液的原因为
(6)写出
 在农业上的一种用途:
在农业上的一种用途:
您最近一年使用:0次
名校
5 . A~R 9种元素在元素周期表中的位置如图。
回答下列问题:
(1)E的原子结构示意图为_______ 。
(2)常温下, 的状态为
的状态为_______ (填“液”、“固”或“气”)态。
(3)写出单质A与 在加热条件下发生反应的化学方程式:
在加热条件下发生反应的化学方程式:_______ 。
(4)化合物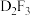 与NaOH溶液反应的离子方程式为
与NaOH溶液反应的离子方程式为_______ 。
(5)H元素形成的单质的用途有_______ (填一种即可)。
(6)最高价氧化物对应水化物的碱性:C_______ (填“>”、“<”或“=”)A,判断的理由为_______ 。
(7)化合物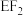 所含分子中的电子总数为
所含分子中的电子总数为_______ ,与其具有相同电子数的化合物分子为_______ (填标号)。
a. b.
b. c.
c. d.
d.
| 周期 | 族 | |||||||
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | A | E | F | |||||
| 3 | C | D | G | H | ||||
| 4 | B | R | ||||||
(1)E的原子结构示意图为
(2)常温下,
 的状态为
的状态为(3)写出单质A与
 在加热条件下发生反应的化学方程式:
在加热条件下发生反应的化学方程式:(4)化合物
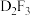 与NaOH溶液反应的离子方程式为
与NaOH溶液反应的离子方程式为(5)H元素形成的单质的用途有
(6)最高价氧化物对应水化物的碱性:C
(7)化合物
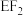 所含分子中的电子总数为
所含分子中的电子总数为a.
 b.
b. c.
c. d.
d.
您最近一年使用:0次
2023-02-08更新
|
145次组卷
|
3卷引用:河北省保定市定州市第二中学2022-2023学年高一下学期开学考试化学试题
6 . 下图是短周期元素①~⑤在元素周期表中的位置。

(1)②在周期表中的位置是第___________ 周期第___________ 族,其与 反应的化学方程式是
反应的化学方程式是___________ 。
(2)③的一种核素的中子数是10,表示该核素的符号是___________ 。
(3)非金属性:④___________ ⑤(填“>”或“<”),从原子结构角度解释其原因:___________ 。
(4)②、⑤两种元素形成的化合物有重要的用途,用电子式表示它的形成过程___________ 。
(5)下列关于①的说法正确的是___________ 。
a、原子结构示意图为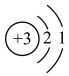
b、在同周期中,①最高价氧化物的水化物的碱性最强
c、在同主族的元素中,①的金属性最强

(1)②在周期表中的位置是第
 反应的化学方程式是
反应的化学方程式是(2)③的一种核素的中子数是10,表示该核素的符号是
(3)非金属性:④
(4)②、⑤两种元素形成的化合物有重要的用途,用电子式表示它的形成过程
(5)下列关于①的说法正确的是
a、原子结构示意图为

b、在同周期中,①最高价氧化物的水化物的碱性最强
c、在同主族的元素中,①的金属性最强
您最近一年使用:0次
7 . 根据以下9种元素在元素周期表中的位置,回答下列问题:
(1)①的原子轨道形状是_______ ;②③④的第一电离能由大到小的顺序是_______ (填编号)。
(2)下列可以判断⑤和⑥金属性强弱的是_______ (填序号)。
a.单质的熔点:⑤<⑥ b.化合价:⑤<⑥
c.单质与水反应的剧烈程度:⑤>⑥ d.最高价氧化物对应水化物的碱性:⑤>⑥
(3)③与⑦形成的化合物是一种性能优异的无机非金属材料,据元素周期律知识,写出其化学式_______ ,它的熔点高,硬度大,电绝缘性好,化学性质稳定。它的晶体类型是_______ ,试推测其可能有哪些用途_______ (填序号)。
a.制作坩埚 b.制作切削刀具 c.制作耐高温轴承
(4)⑧与⑨可形成原子个数比为1:1的共价化合物,分子中各原子最外层均达到8电子稳定结构,试写出其结构式_______ 。
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)下列可以判断⑤和⑥金属性强弱的是
a.单质的熔点:⑤<⑥ b.化合价:⑤<⑥
c.单质与水反应的剧烈程度:⑤>⑥ d.最高价氧化物对应水化物的碱性:⑤>⑥
(3)③与⑦形成的化合物是一种性能优异的无机非金属材料,据元素周期律知识,写出其化学式
a.制作坩埚 b.制作切削刀具 c.制作耐高温轴承
(4)⑧与⑨可形成原子个数比为1:1的共价化合物,分子中各原子最外层均达到8电子稳定结构,试写出其结构式
您最近一年使用:0次
8 . 氮及氮的化合物有着重要的用途。
(1)氮元素在周期表中的位置是_______ ;NH3的电子式是_______ 。
(2)将空气中游离态的氮转化为含氮化合物的过程叫氮的固定,请举例说明一种自然界中氮的固定的途径_______ (用化学方程式表示)。
(3)工业合成氨是人工固氮的重要方法。2007年化学家格哈德•埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下图:
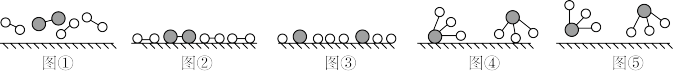
下列说法正确的是_______ (选填字母)。
a图①表示N2、H2分子中均是单键
b 图②→图③需要吸收能量
c 该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(4)水合肼(N2H4•H2O)为无色透明的油状发烟液体,是一种重要的精细化工原料,通常在催化剂存在下,用次氯酸钠与氨反应可制备,该反应的化学方程式是_______ 。
(1)氮元素在周期表中的位置是
(2)将空气中游离态的氮转化为含氮化合物的过程叫氮的固定,请举例说明一种自然界中氮的固定的途径
(3)工业合成氨是人工固氮的重要方法。2007年化学家格哈德•埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下图:

下列说法正确的是
a图①表示N2、H2分子中均是单键
b 图②→图③需要吸收能量
c 该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(4)水合肼(N2H4•H2O)为无色透明的油状发烟液体,是一种重要的精细化工原料,通常在催化剂存在下,用次氯酸钠与氨反应可制备,该反应的化学方程式是
您最近一年使用:0次
9 . C、N、O、F等元素的化合物在航天、美容、食品等多领域中有广泛的用途,请回答:
(1)OF2主要用于火箭工程液体助燃剂,该分子的空间结构为______ ;N、O、F的第一电离能由大到小的顺序为_____ (用元素符号表示)。
(2)XeF2是一种选择性很好的氟化试剂,但在室温下易升华,推测XeF2为______ 晶体(填晶体类型)。
(3)FeSO4是一种重要的食品和饲料添加剂:
①Fe在周期表中位于第______ 周期第______ 族。
②FeSO4·7H2O的结构示意图如图所示,H2O与Fe2+、SO 的作用类型分别是
的作用类型分别是______ 、______ 。
A.离子键 B.配位键 C.氢键 D.金属键 中键角的大小并解释原因:
中键角的大小并解释原因:______ 。
(1)OF2主要用于火箭工程液体助燃剂,该分子的空间结构为
(2)XeF2是一种选择性很好的氟化试剂,但在室温下易升华,推测XeF2为
(3)FeSO4是一种重要的食品和饲料添加剂:
①Fe在周期表中位于第
②FeSO4·7H2O的结构示意图如图所示,H2O与Fe2+、SO
 的作用类型分别是
的作用类型分别是A.离子键 B.配位键 C.氢键 D.金属键
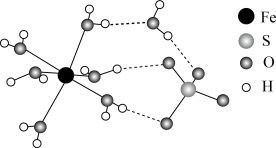
 中键角的大小并解释原因:
中键角的大小并解释原因:
您最近一年使用:0次
2023-04-20更新
|
187次组卷
|
2卷引用:山西省大同市2022-2023学年高二下学期期中考试化学试题
名校
10 . 1869年俄国科学家门捷列夫绘制出了第一张元素周期表,成为化学史上的里程碑之一,且大大地促进了化学学科的快速发展。下表是现代元素周期表的一部分,请据表回答下列问题:
(1)元素③的名称是___________ ,金属性最强的元素是___________ (填元素符号)。
(2)①②⑤三种元素原子半径由大到小的顺序为___________ (填序号)。
(3)元素⑦的单质的一种用途是___________ (填写“制造玻璃”或“制造计算机芯片”)。
(4)元素⑧⑨⑩最高价氧化物的水化物中酸性最强的是___________ (填化学式)。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
二 | ① | ② | ③ | ||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)元素③的名称是
(2)①②⑤三种元素原子半径由大到小的顺序为
(3)元素⑦的单质的一种用途是
(4)元素⑧⑨⑩最高价氧化物的水化物中酸性最强的是
您最近一年使用:0次
2022-03-16更新
|
637次组卷
|
3卷引用:湖南省长沙市长郡中学2020-2021学年高一下学期期中考试化学试题



