解题方法
1 . 质量数
将原子核内所有的质子和中子的________ 取________ 值,加起来所得的数值。
将原子核内所有的质子和中子的
您最近一年使用:0次
解题方法
2 . 元素周期表在科技生产中的应用
(1)在金属元素和非金属元素的交界处寻找_______ 材料(如硅、锗、硒等)。
(2)在过渡元素(副族和Ⅷ族)中寻找_______ ;在过渡元素中寻找_______ 、_______ 的合金材料。
(3)研究元素周期表_______ 的元素,合成新农药。
(4)位于第六周期ⅥB的钨是熔点最高的金属,位于第四周期ⅣB的钛,密度小、耐高温、耐腐蚀,适应于制造_______ 、_______ 等。
(1)在金属元素和非金属元素的交界处寻找
(2)在过渡元素(副族和Ⅷ族)中寻找
(3)研究元素周期表
(4)位于第六周期ⅥB的钨是熔点最高的金属,位于第四周期ⅣB的钛,密度小、耐高温、耐腐蚀,适应于制造
您最近一年使用:0次
3 . 元素周期表的金属区和非金属区
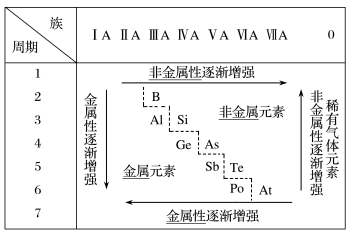
(1)金属性强的在周期表的_______ ,最强的是_______ (放射性元素除外),非金属性强的在周期表的_______ (稀有气体除外),最强的是_______ 。
(2)分界线附近的元素,既能表现出一定的_______ ,又能表现出一定的_______ ,故元素的金属性和非金属性之间没有严格的界线。

(1)金属性强的在周期表的
(2)分界线附近的元素,既能表现出一定的
您最近一年使用:0次
名校
解题方法
4 . 香花石是1958年中国地质学家发现的第一种世界新矿物,其主要成分的化学式为Ca3Li2(BeSiO4)3F2。回答下列问题:
(1)质子数与中子数相等的Ca原子的符号为________ 。
(2)Si在元素周期表的位置为________ 。
(3)香花石的主要成分的组成元素中,原子半径最小的是________ (填元素符号),原子半径最大的是________ (填元素符号)。
(1)质子数与中子数相等的Ca原子的符号为
(2)Si在元素周期表的位置为
(3)香花石的主要成分的组成元素中,原子半径最小的是
您最近一年使用:0次
5 . 如图是元素周期表的一部分。回答下列问题:
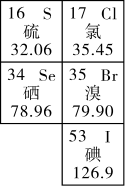
(1)溴被称为海洋元素。
①溴在元素周期表中位于第_______ 周期_______ 族。
②表中与溴同主族的元素中,最高价氧化物对应的水化物酸性最强的酸是_______ (填化学式)。
(2)硒是人体必需的微量元素。
①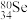 的中子数为
的中子数为_______ 。
②硒元素的气态氢化物的化学式为_______ 。
③ 溶于水生成
溶于水生成 ,向所得溶液中通入
,向所得溶液中通入 气体发生反应,生成硒单质和
气体发生反应,生成硒单质和 ,写出
,写出 与
与 反应的化学方程式:
反应的化学方程式:_______ 。
(3)溴化硒是一种重要的电子元件材料,其分子的球棍模型如图所示。下列说法正确的是_______ (填字母)。

a.溴化硒属于离子化合物
b.原子半径;
c. 元素的非金属性比
元素的非金属性比 的强
的强
d.溴化硒的相对分子质量约为318

(1)溴被称为海洋元素。
①溴在元素周期表中位于第
②表中与溴同主族的元素中,最高价氧化物对应的水化物酸性最强的酸是
(2)硒是人体必需的微量元素。
①
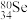 的中子数为
的中子数为②硒元素的气态氢化物的化学式为
③
 溶于水生成
溶于水生成 ,向所得溶液中通入
,向所得溶液中通入 气体发生反应,生成硒单质和
气体发生反应,生成硒单质和 ,写出
,写出 与
与 反应的化学方程式:
反应的化学方程式:(3)溴化硒是一种重要的电子元件材料,其分子的球棍模型如图所示。下列说法正确的是

a.溴化硒属于离子化合物
b.原子半径;

c.
 元素的非金属性比
元素的非金属性比 的强
的强d.溴化硒的相对分子质量约为318
您最近一年使用:0次
6 . 如图是氨元素的几种价态与物质类别的对应关系:

回答下列问题:
(1)写出氮元素在元素周期表的位置_______ 。
(2)从氢元素化合价分析, 具有氧化性和还原性。写出
具有氧化性和还原性。写出 生成A的化学反应方程式:
生成A的化学反应方程式:_______ ,这个反应 体现了
体现了_______ 性。
(3) 与图中的物质C常用于检验
与图中的物质C常用于检验 的存在,则C的化学式为
的存在,则C的化学式为_______ 。写出用C检验 的存在的离子方程式
的存在的离子方程式_______ 。
(4)物质B为氮元素的气态氢化物,B的化学式为_______ ;实验室制取B的化学方程式为_______ 。
(5)浓硝酸与木炭在加热条件下反应的化学方程式为_______ 。

回答下列问题:
(1)写出氮元素在元素周期表的位置
(2)从氢元素化合价分析,
 具有氧化性和还原性。写出
具有氧化性和还原性。写出 生成A的化学反应方程式:
生成A的化学反应方程式: 体现了
体现了(3)
 与图中的物质C常用于检验
与图中的物质C常用于检验 的存在,则C的化学式为
的存在,则C的化学式为 的存在的离子方程式
的存在的离子方程式(4)物质B为氮元素的气态氢化物,B的化学式为
(5)浓硝酸与木炭在加热条件下反应的化学方程式为
您最近一年使用:0次
7 . 下表是元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题。
(1)画出①和③两种元素的原子1:2组成的化合物的电子式_______ 。
(2)元素①-⑩中化学性质最不活泼的元素是_______ (填元素符号)。
(3)⑧的离子结构示意图为_______ 。
(4)用电子式表示③与⑤形成的原子个数比为1 ∶2的化合物的形成过程_______ 。
(5)由元素③、⑤、⑨形成的一种常见的杀菌消毒剂中存在的化学键有_______ 。
(6)硒(Se)被誉为“生命元素”,科学补硒可以减少疾病的发生。周期表中元素Se的位置在⑧的下方,下列推断正确的是_______(填字母序号)
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)元素①-⑩中化学性质最不活泼的元素是
(3)⑧的离子结构示意图为
(4)用电子式表示③与⑤形成的原子个数比为1 ∶2的化合物的形成过程
(5)由元素③、⑤、⑨形成的一种常见的杀菌消毒剂中存在的化学键有
(6)硒(Se)被誉为“生命元素”,科学补硒可以减少疾病的发生。周期表中元素Se的位置在⑧的下方,下列推断正确的是_______(填字母序号)
| A.SeO2具有还原性 | B.H2Se的稳定性比H2S强 |
| C.H2SeO4的酸性强于H2SO4 | D.SeO2在一定条件下可与NaOH溶液反应 |
您最近一年使用:0次
名校
8 . 如表是元素周期表的一部分,根据表中给出的10种元素(其中X、Y分别表示某种化学元素),按要求作答。
(1)X、Y两种元素符号分别是____ 和____ 。
(2)Mg的原子序数为____ 。
(3)氧元素位于第二周期第____ 。
(4)表中失电子能力最强的原子是____ 。
(5)表中某原子最外层电子数为4,其元素符号是____ 。
(6)F与N相比,原子半径较小的是____ 。
(7)O2与S单质相比,更难与H2化合的是____ 。
(8)NH3中N元素的化合价为____ ,其水溶液呈____ (填“酸性”或“碱性”)。
(9)Cl2与水反应的生成物中具有漂白作用的是____ (填“HCl”或“HClO”),写出该反应的化学方程式:____ 。
(10)下列各项比较,符合相关性质递变规律的是____ (填标号)。
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | N | O | F | X | ||||
| 3 | Na | Y | Al | Si | S | Cl |
(2)Mg的原子序数为
(3)氧元素位于第二周期第
(4)表中失电子能力最强的原子是
(5)表中某原子最外层电子数为4,其元素符号是
(6)F与N相比,原子半径较小的是
(7)O2与S单质相比,更难与H2化合的是
(8)NH3中N元素的化合价为
(9)Cl2与水反应的生成物中具有漂白作用的是
(10)下列各项比较,符合相关性质递变规律的是
| A.氧化性:O2>N2 | B.金属性:Na<Mg |
| C.酸性:H2SO4>HClO4 | D.碱性:NaOH<Mg(OH)2 |
您最近一年使用:0次
2022-07-11更新
|
448次组卷
|
2卷引用:2022年01月福建省普通高中高一学业水平合格性考试真题化学试题
名校
9 . 根据要求完成。
(1)基态氟原子氟原子有_______ 种不同能量的电子,价电子排布图为_______ 。
(2)已知锡位于第五周期,与C同主族,写出Sn2+的最外层电子排布式:_______ ; 中有
中有_______ 种运动状态不同的电子。
(3)基态硼原子的核外电子排布图为_______ 。
(4)基态K原子中,核外电子占据最高能层的符号是_______ ,占据该能层电子的电子云轮廓图形状为_______ 。
(5)锰元素在周期表中的位置为_______ ;属于_______ 区元素(填“s”“p”“d”“ds”或“f”)。铜、锌两种元素的第一电离能、第二电离能如表所示:
铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是_______ 。
(1)基态氟原子氟原子有
(2)已知锡位于第五周期,与C同主族,写出Sn2+的最外层电子排布式:
 中有
中有(3)基态硼原子的核外电子排布图为
(4)基态K原子中,核外电子占据最高能层的符号是
(5)锰元素在周期表中的位置为
电离能/ |  |  |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
您最近一年使用:0次
名校
10 . 许多金属及其化合物在生活、化工、医药、材料等各个领域有着广泛的应用。
(1)钛美誉为“未来钢铁”“战略金属”。基态钛原子中电子占据最高能级的符号为____ 。
(2)镓在周期表中的位置____ 。
(3)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因是____ 。
(4)下列Li原子电子排布图表示的状态中,能量最高的为____ (填字母)。
A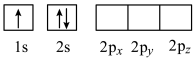 . B.
. B. 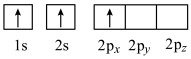 C.
C.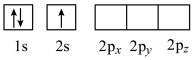
(5)Li+与H-具有相同的电子层结构,r(Li+)小于r(H-),原因是____ 。
(1)钛美誉为“未来钢铁”“战略金属”。基态钛原子中电子占据最高能级的符号为
(2)镓在周期表中的位置
(3)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因是
(4)下列Li原子电子排布图表示的状态中,能量最高的为
A
 . B.
. B.  C.
C.
(5)Li+与H-具有相同的电子层结构,r(Li+)小于r(H-),原因是
您最近一年使用:0次



