解题方法
1 . 周期表中VIA族元素及其化合物应用广泛。 、
、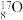 、
、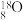 是氧元素的3种核素,可以形成多种重要的化合物。亚硫酰氯
是氧元素的3种核素,可以形成多种重要的化合物。亚硫酰氯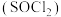 为黄色液体,其结构式为(
为黄色液体,其结构式为(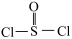 ),遇水发生水解。工业上可电解H2SO4与
),遇水发生水解。工业上可电解H2SO4与 混合溶液制备过二硫酸铵
混合溶液制备过二硫酸铵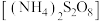 ,过二硫酸铵与双氧水中都含有过氧键(-O-O-)。硝化法制硫酸的主要反应为:
,过二硫酸铵与双氧水中都含有过氧键(-O-O-)。硝化法制硫酸的主要反应为:
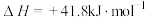 。SO2和SO3都是酸性氧化物,是制备硫酸的中间产物。下列物质结构与性质或物质性质与用途具有对应关系的是
。SO2和SO3都是酸性氧化物,是制备硫酸的中间产物。下列物质结构与性质或物质性质与用途具有对应关系的是
 、
、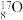 、
、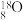 是氧元素的3种核素,可以形成多种重要的化合物。亚硫酰氯
是氧元素的3种核素,可以形成多种重要的化合物。亚硫酰氯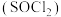 为黄色液体,其结构式为(
为黄色液体,其结构式为(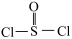 ),遇水发生水解。工业上可电解H2SO4与
),遇水发生水解。工业上可电解H2SO4与 混合溶液制备过二硫酸铵
混合溶液制备过二硫酸铵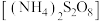 ,过二硫酸铵与双氧水中都含有过氧键(-O-O-)。硝化法制硫酸的主要反应为:
,过二硫酸铵与双氧水中都含有过氧键(-O-O-)。硝化法制硫酸的主要反应为:
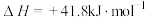 。SO2和SO3都是酸性氧化物,是制备硫酸的中间产物。下列物质结构与性质或物质性质与用途具有对应关系的是
。SO2和SO3都是酸性氧化物,是制备硫酸的中间产物。下列物质结构与性质或物质性质与用途具有对应关系的是| A.SO2具有还原性,可用于漂白纸浆 |
B. 中S为+6价, 中S为+6价, 具有较强的氧化性 具有较强的氧化性 |
| C.浓硫酸具有脱水性,可用于干燥氯气 |
D.H-O的键能强于H-S, 的热稳定性比的 的热稳定性比的 高 高 |
您最近一年使用:0次
19-20高三·全国·假期作业
名校
2 . 某同学做同主族元素性质相似性和递变性实验时,自己设计了一套实验方案,并记录了有关实验现象,见下表(表中的“实验方案”与“实验现象”前后不一定是对应关系)。
请你帮助该同学整理并完成实验报告。
(1)实验目的:__________________________ 。
(2)实验用品:
①试剂:金属钠、金属钾、新制氯水、溴水、0.1 mol·L-1 NaBr溶液、0.1 mol·L-1 NaI溶液、CCl4等。
②仪器:________ 、________ 、镊子、小刀、玻璃片等。
(3)实验内容(填写与实验方案对应的实验现象的字母和化学方程式):
(4)实验结论:_____________________________ 。
(5)①请用原子结构的知识简单解释上述实验结论:_______________________________________ 。
②由于F2过于活泼,很难设计一个简单的实验验证其氧化性的强弱。试列举两个事实说明氟的非金属性比氯强_____________________________________________________ 。
| 实验方案 | 实验现象 |
| ①将新制氯水滴加到溴化钠溶液中,振荡后,再加入适量CCl4,振荡,静置 | A.浮在水面上,熔成小球,快速移动,随之消失 |
| ②将一小块金属钠放入冷水中 | B.分层,上层无色,下层紫红色 |
| ③将溴水滴加到NaI溶液中,振荡后,再加入适量CCl4,振荡,静置 | C.浮在水面上,熔成小球,快速移动,并伴有轻微的爆炸声,很快消失 |
| ④将一小块金属钾放入冷水中 | D.分层,上层无色,下层橙红色 |
(1)实验目的:
(2)实验用品:
①试剂:金属钠、金属钾、新制氯水、溴水、0.1 mol·L-1 NaBr溶液、0.1 mol·L-1 NaI溶液、CCl4等。
②仪器:
(3)实验内容(填写与实验方案对应的实验现象的字母和化学方程式):
| 实验方案 | 实验现象 | 化学方程式 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
(5)①请用原子结构的知识简单解释上述实验结论:
②由于F2过于活泼,很难设计一个简单的实验验证其氧化性的强弱。试列举两个事实说明氟的非金属性比氯强
您最近一年使用:0次
解题方法
3 . 某同学探究同周期主族元素性质递变规律时,自己设计了一套实验方案,并记录了有关实验现象 见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系
见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系 。
。
请你帮助该同学整理并完成实验报告。
(1)实验目的:______ 。
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制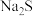 溶液等.仪器:①
溶液等.仪器:① ______ ,② ______ ,③ ______ ,试管夹,镊子,小刀,玻璃片,砂纸,酒精灯等。
(3)实验内容: 填写与实验步骤对应的实验现象的编号和离子方程式
填写与实验步骤对应的实验现象的编号和离子方程式
_______________________
(4)若用最高价氧化物的水化物的碱性相对强弱来验证Mg、Al失电子能力的相对强弱,请你设计实验 实验用品自选,不要求写化学方程式
实验用品自选,不要求写化学方程式 :
: ______ 。
(5)实验结论:______ 。
 见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系
见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系 。
。 | 实验步骤 | 实验现象 |
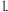 将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,做不定向运动,随之消失,溶液变成红色. |
 向新制得的 向新制得的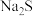 溶液中滴加少量新制的氯水 溶液中滴加少量新制的氯水 | B.有气体产生,溶液变成浅红色 |
 将一小块金属钠放入滴有酚酞溶液的冷水中 将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
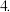 将镁条投入稀盐酸中 将镁条投入稀盐酸中 | D.反应不十分剧烈,产生无色气体 |
 将铝条投入稀盐酸中 将铝条投入稀盐酸中 | E.生成淡黄色沉淀 |
(1)实验目的:
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制
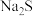 溶液等.仪器:①
溶液等.仪器:① (3)实验内容:
 填写与实验步骤对应的实验现象的编号和离子方程式
填写与实验步骤对应的实验现象的编号和离子方程式
| 实验内容 | 实验现象 | 离子方程式 |
| 1 | ||
| 2 | ||
| 3 | ||
| 4 | ||
| 5 |
 实验用品自选,不要求写化学方程式
实验用品自选,不要求写化学方程式 :
: (5)实验结论:
您最近一年使用:0次
解题方法
4 . 用如图所示装置进行下列实验,a、b和c中所装试剂如下表所示,其中实验现象与结论对应关系不正确的是一组是


| 选项 | a | b | c | 现象 | 结论 |
| A | 饱和食盐水 | 碳化钙 | 酸性 溶液 溶液 | c中溶液紫色褪去 | 乙炔具有还原性 |
| B | 浓盐酸 |  固体 固体 | NaBr溶液 | c中溶液由无色变橙色 |  的氧化性比 的氧化性比 强 强 |
| C | 稀盐酸 | 大理石 |  溶液 溶液 | c中有白色胶状沉淀生成 | 碳酸的酸性比硅酸强 |
| D | 硫酸 |  固体 固体 | 品红溶液 | c中溶液红色褪去 |  具有漂白性 具有漂白性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
5 . 在生产生活中,卤族元素(F、 、
、 、I)的单质及化合物用途广泛。
、I)的单质及化合物用途广泛。
已知:卤族元素的单质极易溶于 ,在水和
,在水和 或酒精中显示不同的颜色(如下表):
或酒精中显示不同的颜色(如下表):
(1)上述卤族元素在周期表中处于短周期的是_______ (填元素名称)。
(2)下列能说明氟的非金属性比碘强的是_______ (填序号)。
A.稳定性: B.熔点:
B.熔点: C.还原性:
C.还原性:
(3)已知:卤素互化物 是红棕色液体,易与
是红棕色液体,易与 溶液反应,
溶液反应, 与
与 溶液的反应不属于氧化还原反应,写出该反应的化学方程式:
溶液的反应不属于氧化还原反应,写出该反应的化学方程式:_______ 。
(4)氢溴酸在医药、染料、香料等工业有广泛用途。工业氢溴酸常显淡黄色,是因为含有 或
或 ,或二者都有,某学生通过以下实验进行验证:
,或二者都有,某学生通过以下实验进行验证:

试剂X是_______ (填“酒精”“ ”或“
”或“ 溶液”),该工业氢溴酸显淡黄色的原因是
溶液”),该工业氢溴酸显淡黄色的原因是_______ 。
 、
、 、I)的单质及化合物用途广泛。
、I)的单质及化合物用途广泛。已知:卤族元素的单质极易溶于
 ,在水和
,在水和 或酒精中显示不同的颜色(如下表):
或酒精中显示不同的颜色(如下表):| 单质 |  |  |  |  |
| 水中的颜色 | - | 浅黄绿色 | 橙黄色 | 淡黄色 |
 或酒精中的颜色 或酒精中的颜色 | - | 深黄色 | 红棕色 | 紫红色 |
(2)下列能说明氟的非金属性比碘强的是
A.稳定性:
 B.熔点:
B.熔点: C.还原性:
C.还原性:
(3)已知:卤素互化物
 是红棕色液体,易与
是红棕色液体,易与 溶液反应,
溶液反应, 与
与 溶液的反应不属于氧化还原反应,写出该反应的化学方程式:
溶液的反应不属于氧化还原反应,写出该反应的化学方程式:(4)氢溴酸在医药、染料、香料等工业有广泛用途。工业氢溴酸常显淡黄色,是因为含有
 或
或 ,或二者都有,某学生通过以下实验进行验证:
,或二者都有,某学生通过以下实验进行验证:
试剂X是
 ”或“
”或“ 溶液”),该工业氢溴酸显淡黄色的原因是
溶液”),该工业氢溴酸显淡黄色的原因是
您最近一年使用:0次
6 . 在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛。
(1)氯元素在周期表中的位置为_______ 。
(2)下列说法中正确的是_______
(3)已知:ICl(氯化碘)是红棕色液体,易水解。ICl 的水解反应方程式是_______ 。
(4)工业氢溴酸常带有淡淡的黄色,可能的原因是:①含 Fe3+,②含 Br2,③含 Fe3+和 Br2,只用下列一种试剂就能分析产生淡黄色的原因,该试剂是 _______(填写字母)。
(1)氯元素在周期表中的位置为
(2)下列说法中正确的是_______
| A.XeF2 分子中各原子最外层均满足 8e-结构 |
| B.食用碘盐中添加了 KIO3 |
| C.氟元素的非金属性强于氯元素,故氢氟酸的酸性强于盐酸 |
| D.还原性:Br->I- |
(4)工业氢溴酸常带有淡淡的黄色,可能的原因是:①含 Fe3+,②含 Br2,③含 Fe3+和 Br2,只用下列一种试剂就能分析产生淡黄色的原因,该试剂是 _______(填写字母)。
| A.KMnO4 溶液 | B.KSCN 溶液 | C.淀粉 KI 溶液 | D.CCl4 |
您最近一年使用:0次
解题方法
7 . 氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。我国科研工作者受此启迪,发现 (俗称砒霜)对白血病有明显的治疗作用。
(俗称砒霜)对白血病有明显的治疗作用。
(1)基态砷原子的价电子排布图为_______ 。
(2)砒霜有剧毒,可用石灰消毒生成 和少量
和少量 ,其中
,其中 中
中 的杂化方式为
的杂化方式为_______ , 的空间构型为
的空间构型为_______ , 中含有的化学键类型包括
中含有的化学键类型包括_______ 。
(3) 中
中 的键角比NH3中
的键角比NH3中 的键角大的原因是
的键角大的原因是_______ ;NH3和水分子与铜离子形成的化合物中阳离子呈轴向狭长的八面体结构(如下图),该化合物加热时首先失去水的原因是_______ (请从原子结构角度加以分析)。
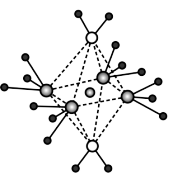
(4)氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质可能有_______ (填序号)。
①稳定性 ②R-H键之间的键角 ③分子间作用力 ④还原性
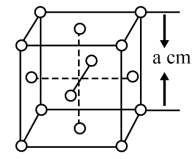
(5)白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加德罗常数为NA,则该晶体的密度为_______  (用含NA、a的式子表示)。
(用含NA、a的式子表示)。
 (俗称砒霜)对白血病有明显的治疗作用。
(俗称砒霜)对白血病有明显的治疗作用。(1)基态砷原子的价电子排布图为
(2)砒霜有剧毒,可用石灰消毒生成
 和少量
和少量 ,其中
,其中 中
中 的杂化方式为
的杂化方式为 的空间构型为
的空间构型为 中含有的化学键类型包括
中含有的化学键类型包括(3)
 中
中 的键角比NH3中
的键角比NH3中 的键角大的原因是
的键角大的原因是
(4)氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质可能有

①稳定性 ②R-H键之间的键角 ③分子间作用力 ④还原性
(5)白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加德罗常数为NA,则该晶体的密度为
 (用含NA、a的式子表示)。
(用含NA、a的式子表示)。
您最近一年使用:0次
名校
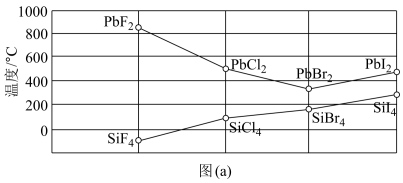
8 . IVA族元素包括C、Si、Ge、Sn、Pb五种元素,IVA族元素的化合物在化工原料、材料等方面有重要用途。四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图(a),Na2CO3和NaHCO3的溶解度如表(b)。有关物质性质的叙述或解释正确的是
表(b)20℃物质的溶解度

| 化学式 | Na2CO3 | NaHCO3 |
| 溶解度/g | 20 | 9.7 |
| A.气态氢化物的沸点从高到低的顺序是:CH4>SnH4>GeH4>SiH4 |
B.表(b)中20℃时,NaHCO3溶解度小于Na2CO3可能的原因是:NaHCO3中的HCO 中的-OH可以与另一HCO 中的-OH可以与另一HCO 中的氧原子形成氢键 中的氧原子形成氢键 |
| C.四卤化硅SiX4的沸点依F、Cl、Br、I次序升高的原因是Si-X键的极性逐渐减弱 |
| D.二卤化铅PbX2中PbF2的熔点反常高的原因是PbF2分子间存在着氢键 |
您最近一年使用:0次
名校
解题方法
9 . 卤族元素的单质及化合物性质丰富,在科研和生产中有许多重要用途。请回答:
(1)卤族元素位于元素周期表的___________ 区,其中电负性最大的是___________ (填元素符号),溴原子的M能层电子排布式为___________ 。
(2)基态氯原子核外有___________ 种运动状态不同的电子,其中单电子占据的轨道形状为___________ 。
(3)下列物质性质递变规律正确的是___________。
(4)碘在水中的溶解度小,在碘化钾溶液中溶解度却明显增大,这是由于发生I-+I2
 。
。 离子的空间构型为
离子的空间构型为___________ 。
(5)SiCl4发生水解的机理如图:
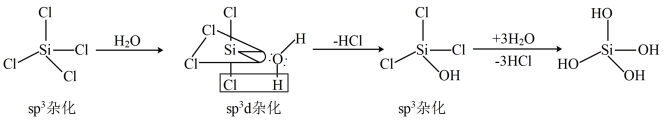
CCl4不能按照上述机理发生水解反应,原因是___________ 。
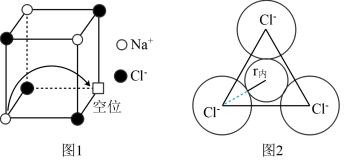
(6)有“点缺陷”的NaCl 晶体可导电,其结构如图1所示。有人认为:高温下有“点缺陷”的NaCl晶体能导电,是因为Na+经过一个由3个Cl-组成的最小三角形窗孔(如图2所示),迁移到另一空位而造成的。已知晶胞参数a=564pm,粒子半径r(Na+ )=115pm,r(Cl-)=l67pm,计算内切圆半径r内的值并判断该观点是否正确____________ 。(已知: ≈1.414,
≈1.414, ≈1.732)
≈1.732)
(1)卤族元素位于元素周期表的
(2)基态氯原子核外有
(3)下列物质性质递变规律正确的是___________。
| A.原子半径: F<C1<Br<I |
| B.第一电离能: F<Cl<Br<I |
| C.沸点:HCl<HBr<HI<HF |
| D.熔点: CaF2<CaCl2<CaBr2<CaI2 |

 。
。 离子的空间构型为
离子的空间构型为(5)SiCl4发生水解的机理如图:

CCl4不能按照上述机理发生水解反应,原因是
(6)有“点缺陷”的NaCl 晶体可导电,其结构如图1所示。有人认为:高温下有“点缺陷”的NaCl晶体能导电,是因为Na+经过一个由3个Cl-组成的最小三角形窗孔(如图2所示),迁移到另一空位而造成的。已知晶胞参数a=564pm,粒子半径r(Na+ )=115pm,r(Cl-)=l67pm,计算内切圆半径r内的值并判断该观点是否正确
 ≈1.414,
≈1.414, ≈1.732)
≈1.732)
您最近一年使用:0次
名校
10 . 元素周期表中VIIA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子,其核外能量最高的电子所处的电子亚层是___________ ;碘元素在元素周期表中的位置是___________ 。少量液溴的保存通常采取的方法是___________ 。
(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是___________(填序号)。
(3)CuCl(s)与 O2反应生成CuCl2(s)和一种黑色固体。在25°C、101kPa 下,已知该反应消耗1 mol CuCl(s),放热44.4kJ,该反应的热化学方程式是___________ 。
(4)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜。请完成并配平上述反应:___________
KI+___________CuSO4→___________+___________Cu2I2↓+___________
该反应中氧化剂与还原剂的物质的量之比为___________
(5)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去。写出KI、Cu2I2、 H2SO3的还原性由强到弱的顺序是___________ 。
(1)与氯元素同族的短周期元素的原子,其核外能量最高的电子所处的电子亚层是
(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是___________(填序号)。
| A.Cl2、Br2、 I2的熔点 |
| B.HCl、 HBr、HI的沸点 |
| C.HCl、HBr、HI的热稳定性 |
| D.HClO4、 HBrO4、 HIO4 的酸性 |
(4)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜。请完成并配平上述反应:
KI+___________CuSO4→___________+___________Cu2I2↓+___________
该反应中氧化剂与还原剂的物质的量之比为
(5)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去。写出KI、Cu2I2、 H2SO3的还原性由强到弱的顺序是
您最近一年使用:0次
2021-12-12更新
|
165次组卷
|
2卷引用:上海市控江中学2021-2022学年高三上学期12月月考化学试题



