名校
解题方法
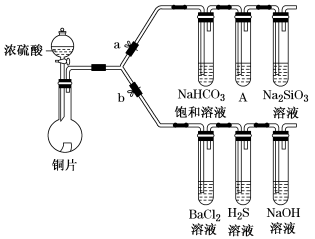
1 . 根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)
① 连接仪器、________ 、加药品后,打开a关闭b,然后滴入浓硫酸,加热。
② 铜与浓硫酸反应的化学方程式是_______ 。装置A中试剂是_______ 。
③ 能说明碳的非金属性比硅强的实验现象是_________ 。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
① 在(1)①操作后打开b,关闭a。
② H2S溶液中有浅黄色浑浊出现,化学方程式是____ 。
③ BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
写出其中SO2显示还原性生成沉淀的离子方程式_________ 。
① 连接仪器、
② 铜与浓硫酸反应的化学方程式是
③ 能说明碳的非金属性比硅强的实验现象是
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
① 在(1)①操作后打开b,关闭a。
② H2S溶液中有浅黄色浑浊出现,化学方程式是
③ BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
您最近一年使用:0次
2020-03-06更新
|
148次组卷
|
6卷引用:山西省实验中学2020届高三化学复习针对性试题集(六)
14-15高三上·浙江杭州·阶段练习
解题方法
2 . 根据要求完成下列各小题实验目的。(a、b 为弹簧夹,加热及固定装置已略去)
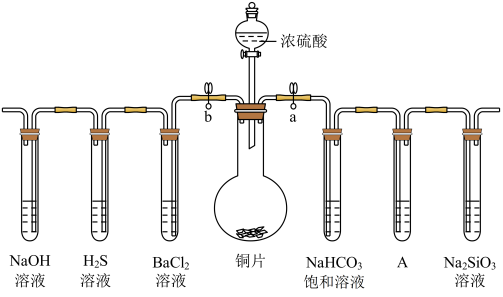
(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸 >碳酸)
①连接仪器、___________ 、加药品后,打开a关闭 b,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是__________________ ,装置A中的试剂是___________ 。
③能说明碳的非金属性比硅强的实验现象是:_______________________ 。
(2)验证 SO2的氧化性、还原性和酸性氧化物的通性。
①打开b,关闭a。能验证SO2具有氧化性的化学方程式是:___________ 。
②若大量的SO2通入NaOH溶液中,其化学方程式是:__________________ 。
③BaCl2溶液中无沉淀现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
写出其中SO2显示还原性并生成沉淀的离子方程式___________________ 。

(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸 >碳酸)
①连接仪器、
②铜与浓硫酸反应的化学方程式是
③能说明碳的非金属性比硅强的实验现象是:
(2)验证 SO2的氧化性、还原性和酸性氧化物的通性。
①打开b,关闭a。能验证SO2具有氧化性的化学方程式是:
②若大量的SO2通入NaOH溶液中,其化学方程式是:
③BaCl2溶液中无沉淀现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
| 滴加的溶液 | 氯 水 | 氨 水 |
| 沉淀的化学式 |
您最近一年使用:0次
解题方法
3 . 用下列装置进行实验,能达到实验目的的是
| 选项 | A | B | C | D |
| 实验装置 | 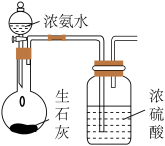 | 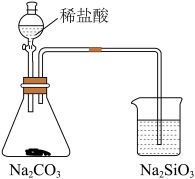 | 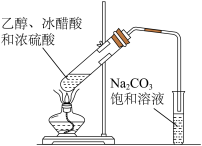 | 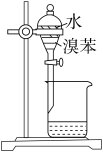 |
| 目的 | 制备干燥的氨气 | 证明非金属性 Cl>C>Si | 制备乙酸乙酯 | 分离出溴苯 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)装置A是氯气的发生装置,请写出相应反应的化学方程式:_____ ;
(2)装置B中饱和食盐水的作用是_____ ;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:______ ;
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入物质的组合应是______ (填字母编号)
(4)设计装置D,E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是____ ,该现象_____ (填“能”或“不能”)说明溴单质的氧化性强于碘,原因是_____ ;
(5)装置F的作用是______ ,其烧杯中的溶液不能选用下列中的(填字母编号)_____ 。
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液

(1)装置A是氯气的发生装置,请写出相应反应的化学方程式:
(2)装置B中饱和食盐水的作用是
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入物质的组合应是
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(5)装置F的作用是
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液
您最近一年使用:0次
解题方法
5 . 元素X、Y、Z、T、R的原子序数依次增大且小于20,其最外层电子数与原子半径间大大小关系如图所示。
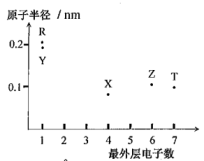
请按要求回答下列问题:
(1)写出基态R原子的价层电子排布式:_______ 。
(2)上述五种元素中,电负性最大的是(写元素符号,下同)_______ ,第一电离能最小的是_______ 。
(3)Z所在主族元素的氢化物中,其中稳定性最强是(用化学式表示)_______ 。
(4)向Y的最高价氧化物的水溶液中充入少量Z的氢化物,写出反应的离子方程式为_______ 。
(5)某化学兴趣小组为探究涉及上述元素性质的变化规律,设计了以下系列实验。
①甲同学欲探究同主族部分元素性质的递变规律,以元素Y、R为例,请完成其实验步骤:_______ 。通过观察现象得出的结论:相同条件下,同主族元素R的金属性比Y的强。
②乙同学欲探究第三周期部分元素性质的递变规律,以元素Z、T为例,自拟通过一步反应实现实验目的,其原理的化学方程式为:_______ 。欲观察到现象为:_______ ;结论:_______ 。

请按要求回答下列问题:
(1)写出基态R原子的价层电子排布式:
(2)上述五种元素中,电负性最大的是(写元素符号,下同)
(3)Z所在主族元素的氢化物中,其中稳定性最强是(用化学式表示)
(4)向Y的最高价氧化物的水溶液中充入少量Z的氢化物,写出反应的离子方程式为
(5)某化学兴趣小组为探究涉及上述元素性质的变化规律,设计了以下系列实验。
①甲同学欲探究同主族部分元素性质的递变规律,以元素Y、R为例,请完成其实验步骤:
②乙同学欲探究第三周期部分元素性质的递变规律,以元素Z、T为例,自拟通过一步反应实现实验目的,其原理的化学方程式为:
您最近一年使用:0次
6 . 表中列出了第三周期几种元素的部分性质:
请按要求回答下列问题:
(1)表中元素原子半径最大的是(写元素符号)___________ 。
(2)a、b、c三种元素形成的氢化物中,其稳定性由强到弱的顺序是(用化学式表示)___________ 。
(3)d、e最高价氧化物对应水化物相互反应的离子方程式为___________ 。
(4)某化学兴趣小组为探究元素性质的递变规律,设计了以下系列实验。
①甲同学为探究同主族元素金属性的递变规律,取绿豆粒大小的钠、钾分别放入到盛有水的烧杯(滴有几滴酚酞溶液)中,通过观察现象得出的结论是___________ 。
②乙同学利用现有药品: 溶液、
溶液、 固体、浓盐酸、
固体、浓盐酸、 ,设计如图装置探究第三周期部分元素非金属性的递变规律。M中所装药品为
,设计如图装置探究第三周期部分元素非金属性的递变规律。M中所装药品为___________ ,装置N中的实验现象为有淡黄色沉淀生成,离子方程式为___________ ,所得结论为___________ 。

| 元素编号 | a | b | c | d | e |
| 电负性 | 3.0 | 2.5 | 2.1 | 1.5 | 0.9 |
| 主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
(1)表中元素原子半径最大的是(写元素符号)
(2)a、b、c三种元素形成的氢化物中,其稳定性由强到弱的顺序是(用化学式表示)
(3)d、e最高价氧化物对应水化物相互反应的离子方程式为
(4)某化学兴趣小组为探究元素性质的递变规律,设计了以下系列实验。
①甲同学为探究同主族元素金属性的递变规律,取绿豆粒大小的钠、钾分别放入到盛有水的烧杯(滴有几滴酚酞溶液)中,通过观察现象得出的结论是
②乙同学利用现有药品:
 溶液、
溶液、 固体、浓盐酸、
固体、浓盐酸、 ,设计如图装置探究第三周期部分元素非金属性的递变规律。M中所装药品为
,设计如图装置探究第三周期部分元素非金属性的递变规律。M中所装药品为
您最近一年使用:0次
7 . 为纪念元素周期表诞生 150 周年,IUPAC 等从世界范围征集优秀青年化学家为化学元素代言,我国有8 位化学家成为硫(S)等元素的代言人。回答下列问题:
(1)S 在周期表中的位置是___________
(2)下列有关性质的比较,能用元素周期律解释的是___________ (填字母序号)
a.非金属性:O>S b.离子半径:S2->Cl- c.酸性:H2SO4>H2SO3 d.酸性:H2SO4>H3PO4
(3)Se 与 S 位于同一主族,二者氢化物稳定性较强的是:___________ (用化学式表示),用原子结构解释原因___________
(4)某同学用如下装置探究不同价态硫元素之间的转化。培养皿中 A、B、C 三个塑料瓶盖内盛有不同物质。向 Na2SO3 固体上滴加 70%硫酸,迅速用玻璃片将培养皿盖严,实验记录如下。
能够说明硫元素由+4 价转化为+6 价的证据是___________
(1)S 在周期表中的位置是
(2)下列有关性质的比较,能用元素周期律解释的是
a.非金属性:O>S b.离子半径:S2->Cl- c.酸性:H2SO4>H2SO3 d.酸性:H2SO4>H3PO4
(3)Se 与 S 位于同一主族,二者氢化物稳定性较强的是:
(4)某同学用如下装置探究不同价态硫元素之间的转化。培养皿中 A、B、C 三个塑料瓶盖内盛有不同物质。向 Na2SO3 固体上滴加 70%硫酸,迅速用玻璃片将培养皿盖严,实验记录如下。
| 实验装置 | 瓶盖 | 物质 | 实验现象 |
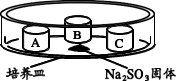 | A | 蘸有品红溶液的棉花 | 品红溶液褪色 |
| B | HCl、BaCl2 的混合溶液 | 无明显变化 | |
| C | HCl、BaCl2、FeCl3 的混合溶液 | 产生白色沉淀 |
能够说明硫元素由+4 价转化为+6 价的证据是
您最近一年使用:0次
2021-02-21更新
|
287次组卷
|
2卷引用:北京市房山区2021届高三上学期期末考试化学试题
8 . 下列有关实验现象和解释或结论都正确的选项是。
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 工业上用 与焦炭在高温条件制备粗硅 与焦炭在高温条件制备粗硅 | 生成可燃性气体,得到黑色固体粗硅 | 非金属性: |
| B | 将 溶液滴到 溶液滴到 试纸上 试纸上 | 测得 |  溶液水解显碱性 溶液水解显碱性 |
| C | 向 溶液中加入过量 溶液中加入过量 溶液充分反应后,再滴加 溶液充分反应后,再滴加 溶液 溶液 | 溶液未变红 | 氧化性: |
| D | 把 通入紫色石蕊试液中 通入紫色石蕊试液中 | 紫色溶液变红 |  的水溶液呈酸性 的水溶液呈酸性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
9 . 过氧化钠是一种重要的强氧化剂,也能作为封闭生态系统的CO2吸收剂和生氧剂,其反应原理为:2Na2O2+2CO2=2NaCO3+O2。答下列问题:
(1)上述反应中两种同周期原子的半径大小为______ (填写元素符号)。反应中破坏的化学键类型有______ 。
(2)S和O位于元素周期表同一主族,非金属性:S______ O(填“<”、“>”或“=”),用一个化学方程式说明判断的理由:______ 。
(3)过氧化钠在日常保存时常因发生反应: ,而发生变质。
,而发生变质。
①该反应的平衡常数表达式为______ 。
②向保存在恒温密闭容器中过氧化钠中通入少量O2,固体质量将______ (“增大”、“减小”或“不变”,下同),达到新平衡时容器内气体的压强将______ 。
(4)利用如图装置探究Na2O2与SO2反应的产物。实验中当通入二氧化硫气体,将带有火星的木条插入试管C中,木条复燃。有同学猜测,B中反应后的固体产物可能是亚硫酸钠和硫酸钠的混合物。
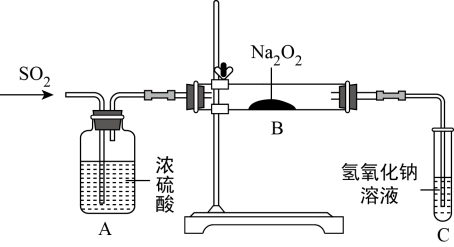
①该同学认为存在硫酸钠的原因是______ (用化学方程式解释)。
②设计一个简单的实验证明是否存在硫酸钠。简要地写出实验的步骤、现象和结论______ 。
(1)上述反应中两种同周期原子的半径大小为
(2)S和O位于元素周期表同一主族,非金属性:S
(3)过氧化钠在日常保存时常因发生反应:
 ,而发生变质。
,而发生变质。①该反应的平衡常数表达式为
②向保存在恒温密闭容器中过氧化钠中通入少量O2,固体质量将
(4)利用如图装置探究Na2O2与SO2反应的产物。实验中当通入二氧化硫气体,将带有火星的木条插入试管C中,木条复燃。有同学猜测,B中反应后的固体产物可能是亚硫酸钠和硫酸钠的混合物。

①该同学认为存在硫酸钠的原因是
②设计一个简单的实验证明是否存在硫酸钠。简要地写出实验的步骤、现象和结论
您最近一年使用:0次
2021-01-07更新
|
187次组卷
|
2卷引用:上海市格致中学2021届高三上学期期中考试化学试题
名校
解题方法
10 . 某化学兴趣小组为探究元素性质的递变规律,设计以下实验。
Ⅰ.(1)将钠、钾、镁、铝各1 分别投入足量的0.1
分别投入足量的0.1 的盐酸中,试预测实验结果:
的盐酸中,试预测实验结果:______ 与盐酸反应最剧烈,______ 与盐酸反应最慢。
(2)将 溶液与
溶液与 溶液混合生成
溶液混合生成 ,从而验证
,从而验证 的碱性强于
的碱性强于 ,继而可以验证
,继而可以验证 的金属性强于
的金属性强于 。此设计
。此设计______ (填“合理”或“不合理”),理由是________________________ 。
Ⅱ.利用如图所示装置可以验证非金属性的变化规律。

(3)仪器 的名称为
的名称为____________ ,干燥管 的作用是
的作用是__________________ 。
(4)实验室中现有药品: 溶液、
溶液、 浓盐酸、
浓盐酸、 ,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置
,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置 、
、 、
、 中所装药品分别为
中所装药品分别为____________ 、____________ 、____________ ,装置 中的实验现象为有黄色沉淀生成,相关反应的离子方程式为
中的实验现象为有黄色沉淀生成,相关反应的离子方程式为______________________________________ 。
(5)若要证明非金属性: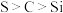 ,则
,则 中加
中加__________ , 中加
中加 ,
, 中加
中加__________ ,观察到 中的现象为
中的现象为______________________________ 。
Ⅰ.(1)将钠、钾、镁、铝各1
 分别投入足量的0.1
分别投入足量的0.1 的盐酸中,试预测实验结果:
的盐酸中,试预测实验结果:(2)将
 溶液与
溶液与 溶液混合生成
溶液混合生成 ,从而验证
,从而验证 的碱性强于
的碱性强于 ,继而可以验证
,继而可以验证 的金属性强于
的金属性强于 。此设计
。此设计Ⅱ.利用如图所示装置可以验证非金属性的变化规律。

(3)仪器
 的名称为
的名称为 的作用是
的作用是(4)实验室中现有药品:
 溶液、
溶液、 浓盐酸、
浓盐酸、 ,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置
,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置 、
、 、
、 中所装药品分别为
中所装药品分别为 中的实验现象为有黄色沉淀生成,相关反应的离子方程式为
中的实验现象为有黄色沉淀生成,相关反应的离子方程式为(5)若要证明非金属性:
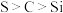 ,则
,则 中加
中加 中加
中加 ,
, 中加
中加 中的现象为
中的现象为
您最近一年使用:0次
2020-03-02更新
|
164次组卷
|
14卷引用:安徽省庐巢七校联盟2020届高三第五次联考化学试题
安徽省庐巢七校联盟2020届高三第五次联考化学试题2019-2020学年人教版高中化学高考基础复习专题5《物质结构 元素周期律》测试卷2020届人教版高中化学高三专题基础复习专题5《物质结构 元素周期律》测试卷福建省仙游县郊尾中学2020届高三上学期期中考试化学试题2014-2015浙江省余姚中学高一4月月考化学试卷2014-2015浙江省严州中学高一4月阶段性测试化学试卷2015-2016学年安徽省合肥中科大附中高一下期中化学试卷山西省应县第一中学校2018-2019学年高一下学期期中考试化学试题云南省弥勒市第二中学2019-2020学年高二上学期开学考试化学试题山西省朔州市怀仁县第一中学2018-2019学年高一下学期第三次月考化学试题第1章原子结构与元素周期律第3节课时2 预测同主族元素的性质山西省晋中市和诚中学2019-2020学年高一4月月考化学试题(已下线)4.2.1 元素性质的周期性变化规律(精练)-2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)四川省成都市蒲江县蒲江中学2019-2020学年高一4月月考化学试题



