1 . 下列装置(部分夹持装置略去)中仪器使用规范且能达到实验目的的是
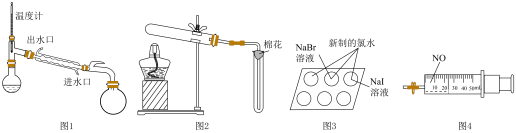
| A.图1:采用蒸馏法分离正己烷(沸点69℃)和正庚烷(沸点98℃) |
B.图2:用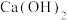 和 和 制备并收集 制备并收集 |
| C.图3:通过观察实验现象,验证氯、溴和碘元素性质的递变规律 |
D.图4:利用该装置实现NO、 和 和 充分反应转化为 充分反应转化为 |
您最近一年使用:0次
2024-05-14更新
|
89次组卷
|
2卷引用:2024届河南省平许济洛四市高三下学期第四次质量检测理科综合试题-高中化学
2023高三·全国·专题练习
解题方法
2 . 下列装置能达到相应实验目的的是


| A.装置Ⅰ可用于除去苯中的溴 | B.装置Ⅱ可用于配制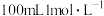 的稀硫酸 的稀硫酸 |
| C.装置Ⅲ可用于实验室制备少量氧气 | D.装置Ⅳ可用于滴定盐酸 |
您最近一年使用:0次
名校
解题方法
3 . 根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)
① 连接仪器、________ 、加药品后,打开a关闭b,然后滴入浓硫酸,加热。
② 铜与浓硫酸反应的化学方程式是_______ 。装置A中试剂是_______ 。
③ 能说明碳的非金属性比硅强的实验现象是_________ 。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
① 在(1)①操作后打开b,关闭a。
② H2S溶液中有浅黄色浑浊出现,化学方程式是____ 。
③ BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
写出其中SO2显示还原性生成沉淀的离子方程式_________ 。
① 连接仪器、
② 铜与浓硫酸反应的化学方程式是
③ 能说明碳的非金属性比硅强的实验现象是
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
① 在(1)①操作后打开b,关闭a。
② H2S溶液中有浅黄色浑浊出现,化学方程式是
③ BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
您最近一年使用:0次
2020-03-06更新
|
148次组卷
|
6卷引用:山西省实验中学2020届高三化学复习针对性试题集(六)
解题方法
4 . 某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
(1)ⅰ中反应的离子方程式是__________________________________________ 。
(2)实验Ⅰ中ⅰ和ⅱ可以得出的结论是__________________________________ 。
(3)①甲同学认为:实验Ⅱ观察到__________________ 现象,得出氧化性Br2>I2。
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ。
补做实验Ⅲ的目的是___________________________________________________ 。
(4)综合实验Ⅰ和Ⅲ,得出Cl2、Br2、I2氧化性由强到弱的顺序为_____________ 。
(5)实验室的氯水都是实验前新制备,其制备的方法是将氯气通往蒸馏水中使其充分溶解而得到。实验室可用如图装置来制备氯水,下列对于该实验说法正确的是___________ 。

A.甲装置中所用药品为浓盐酸和二氧化锰
B.若在装置乙、丙之间增加一个如图(a)所示装置,制备的氯水更纯净
C.为提高氯水的制备效率,可在丙装置中的长玻璃管下端接一个如图(b)所示的多孔球
D.为了充分吸收尾气并防止倒吸,丁装置可选用如图(c)所示装置
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
| 实验Ⅰ |  |
| 实验Ⅱ | 取ⅰ中的黄色溶液少许,加入KI溶液,再加入淀粉溶液。 |
(1)ⅰ中反应的离子方程式是
(2)实验Ⅰ中ⅰ和ⅱ可以得出的结论是
(3)①甲同学认为:实验Ⅱ观察到
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ。
| 实验Ⅲ | 另取ⅰ中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液。 |
补做实验Ⅲ的目的是
(4)综合实验Ⅰ和Ⅲ,得出Cl2、Br2、I2氧化性由强到弱的顺序为
(5)实验室的氯水都是实验前新制备,其制备的方法是将氯气通往蒸馏水中使其充分溶解而得到。实验室可用如图装置来制备氯水,下列对于该实验说法正确的是

A.甲装置中所用药品为浓盐酸和二氧化锰
B.若在装置乙、丙之间增加一个如图(a)所示装置,制备的氯水更纯净
C.为提高氯水的制备效率,可在丙装置中的长玻璃管下端接一个如图(b)所示的多孔球
D.为了充分吸收尾气并防止倒吸,丁装置可选用如图(c)所示装置
您最近一年使用:0次
解题方法
5 . 已知O、S、Se、Te、Po、Lv是同主族元素,其原子序数依次增大。回答下列问题:
(1)Lv在周期表中的位置是_________ 。
(2)下列有关性质的比较,能用元素周期律解释的是_________ 。
a.离子半径:Te2->Se2- b.热稳定性:H2O>H2S
c.熔、沸点:H2O>H2S d.酸性:H2SO4>H2SeO4
(3)从原子结构角度解释Se与S的最高价氧化物对应的水化物酸性不同的原因_________ 。
(4)实验室用如下方法制备H2S并进行性质验证。

①设计B装置的目的是证明_________ ,B中实验现象为_______________ 。
②实验中经检测发现C中溶液pH降低且出现黑色沉淀。C中反应的离子方程式是_______________ 。
③有同学根据“强酸制弱酸”原理认为装置A、C中两个反应相矛盾,认为C中不可能出现上述现象。该观点不正确的理由是_______________ 。
(1)Lv在周期表中的位置是
(2)下列有关性质的比较,能用元素周期律解释的是
a.离子半径:Te2->Se2- b.热稳定性:H2O>H2S
c.熔、沸点:H2O>H2S d.酸性:H2SO4>H2SeO4
(3)从原子结构角度解释Se与S的最高价氧化物对应的水化物酸性不同的原因
(4)实验室用如下方法制备H2S并进行性质验证。

①设计B装置的目的是证明
②实验中经检测发现C中溶液pH降低且出现黑色沉淀。C中反应的离子方程式是
③有同学根据“强酸制弱酸”原理认为装置A、C中两个反应相矛盾,认为C中不可能出现上述现象。该观点不正确的理由是
您最近一年使用:0次
19-20高三·全国·假期作业
名校
6 . 某同学做同主族元素性质相似性和递变性实验时,自己设计了一套实验方案,并记录了有关实验现象,见下表(表中的“实验方案”与“实验现象”前后不一定是对应关系)。
请你帮助该同学整理并完成实验报告。
(1)实验目的:__________________________ 。
(2)实验用品:
①试剂:金属钠、金属钾、新制氯水、溴水、0.1 mol·L-1 NaBr溶液、0.1 mol·L-1 NaI溶液、CCl4等。
②仪器:________ 、________ 、镊子、小刀、玻璃片等。
(3)实验内容(填写与实验方案对应的实验现象的字母和化学方程式):
(4)实验结论:_____________________________ 。
(5)①请用原子结构的知识简单解释上述实验结论:_______________________________________ 。
②由于F2过于活泼,很难设计一个简单的实验验证其氧化性的强弱。试列举两个事实说明氟的非金属性比氯强_____________________________________________________ 。
| 实验方案 | 实验现象 |
| ①将新制氯水滴加到溴化钠溶液中,振荡后,再加入适量CCl4,振荡,静置 | A.浮在水面上,熔成小球,快速移动,随之消失 |
| ②将一小块金属钠放入冷水中 | B.分层,上层无色,下层紫红色 |
| ③将溴水滴加到NaI溶液中,振荡后,再加入适量CCl4,振荡,静置 | C.浮在水面上,熔成小球,快速移动,并伴有轻微的爆炸声,很快消失 |
| ④将一小块金属钾放入冷水中 | D.分层,上层无色,下层橙红色 |
(1)实验目的:
(2)实验用品:
①试剂:金属钠、金属钾、新制氯水、溴水、0.1 mol·L-1 NaBr溶液、0.1 mol·L-1 NaI溶液、CCl4等。
②仪器:
(3)实验内容(填写与实验方案对应的实验现象的字母和化学方程式):
| 实验方案 | 实验现象 | 化学方程式 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
(5)①请用原子结构的知识简单解释上述实验结论:
②由于F2过于活泼,很难设计一个简单的实验验证其氧化性的强弱。试列举两个事实说明氟的非金属性比氯强
您最近一年使用:0次
名校
解题方法
7 . 某化学兴趣小组为探究元素性质的递变规律,设计以下实验。
Ⅰ.(1)将钠、钾、镁、铝各1 分别投入足量的0.1
分别投入足量的0.1 的盐酸中,试预测实验结果:
的盐酸中,试预测实验结果:______ 与盐酸反应最剧烈,______ 与盐酸反应最慢。
(2)将 溶液与
溶液与 溶液混合生成
溶液混合生成 ,从而验证
,从而验证 的碱性强于
的碱性强于 ,继而可以验证
,继而可以验证 的金属性强于
的金属性强于 。此设计
。此设计______ (填“合理”或“不合理”),理由是________________________ 。
Ⅱ.利用如图所示装置可以验证非金属性的变化规律。

(3)仪器 的名称为
的名称为____________ ,干燥管 的作用是
的作用是__________________ 。
(4)实验室中现有药品: 溶液、
溶液、 浓盐酸、
浓盐酸、 ,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置
,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置 、
、 、
、 中所装药品分别为
中所装药品分别为____________ 、____________ 、____________ ,装置 中的实验现象为有黄色沉淀生成,相关反应的离子方程式为
中的实验现象为有黄色沉淀生成,相关反应的离子方程式为______________________________________ 。
(5)若要证明非金属性: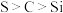 ,则
,则 中加
中加__________ , 中加
中加 ,
, 中加
中加__________ ,观察到 中的现象为
中的现象为______________________________ 。
Ⅰ.(1)将钠、钾、镁、铝各1
 分别投入足量的0.1
分别投入足量的0.1 的盐酸中,试预测实验结果:
的盐酸中,试预测实验结果:(2)将
 溶液与
溶液与 溶液混合生成
溶液混合生成 ,从而验证
,从而验证 的碱性强于
的碱性强于 ,继而可以验证
,继而可以验证 的金属性强于
的金属性强于 。此设计
。此设计Ⅱ.利用如图所示装置可以验证非金属性的变化规律。

(3)仪器
 的名称为
的名称为 的作用是
的作用是(4)实验室中现有药品:
 溶液、
溶液、 浓盐酸、
浓盐酸、 ,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置
,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置 、
、 、
、 中所装药品分别为
中所装药品分别为 中的实验现象为有黄色沉淀生成,相关反应的离子方程式为
中的实验现象为有黄色沉淀生成,相关反应的离子方程式为(5)若要证明非金属性:
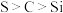 ,则
,则 中加
中加 中加
中加 ,
, 中加
中加 中的现象为
中的现象为
您最近一年使用:0次
2020-03-02更新
|
164次组卷
|
14卷引用:安徽省庐巢七校联盟2020届高三第五次联考化学试题
安徽省庐巢七校联盟2020届高三第五次联考化学试题2019-2020学年人教版高中化学高考基础复习专题5《物质结构 元素周期律》测试卷2020届人教版高中化学高三专题基础复习专题5《物质结构 元素周期律》测试卷福建省仙游县郊尾中学2020届高三上学期期中考试化学试题2014-2015浙江省余姚中学高一4月月考化学试卷2014-2015浙江省严州中学高一4月阶段性测试化学试卷2015-2016学年安徽省合肥中科大附中高一下期中化学试卷山西省应县第一中学校2018-2019学年高一下学期期中考试化学试题云南省弥勒市第二中学2019-2020学年高二上学期开学考试化学试题山西省朔州市怀仁县第一中学2018-2019学年高一下学期第三次月考化学试题第1章原子结构与元素周期律第3节课时2 预测同主族元素的性质山西省晋中市和诚中学2019-2020学年高一4月月考化学试题(已下线)4.2.1 元素性质的周期性变化规律(精练)-2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)四川省成都市蒲江县蒲江中学2019-2020学年高一4月月考化学试题
8 . 黄色超氧化钾(KO2)可作为宇宙飞船舱的氧源。某学习小组设计以下实验探究KO2的性质,请回答相关问题:
Ⅰ. 探究KO2与水的反应:取少量KO2固体于试管中,滴加少量水快速产生气泡,将带火星的木条靠近试管口木条复燃;滴加酚酞试液,溶液先变红后褪色。向褪色后溶液中滴加FeCl3溶液,产生的现象为____________________________________ 。
(1)正确的操作依次是_________________________ 。(操作可重复选择)
①打开K1通入N2,并维持一段时间后关闭
②实验完成,拆卸装置
③检查装置气密性,然后装入药品
④打开分液漏斗活塞K2
(2)A装置发生反应的化学方程式为________________________ 。
(3)用上述装置验证“KO2与SO2反应生成O2”还存在不足,你的改进措施是________ 。
(4)改进后再实验,待KO2完全反应后,将装置C中固体加水溶解,配成50.00mL溶液,等分为M、N两份。
①向M溶液中加入足量的盐酸酸化的BaCl2溶液,充分反应后,得沉淀4.66g。
②将N溶液移入锥形瓶中,用0.20mol L-1酸性KMnO4溶液滴定,当出现
L-1酸性KMnO4溶液滴定,当出现___________ 现象时,达到滴定终点,此时消耗酸性KMnO4溶液20.00mL。
③依据上述现象和数据,请写出装置C中总反应的化学方程式___________ 。
Ⅰ. 探究KO2与水的反应:取少量KO2固体于试管中,滴加少量水快速产生气泡,将带火星的木条靠近试管口木条复燃;滴加酚酞试液,溶液先变红后褪色。向褪色后溶液中滴加FeCl3溶液,产生的现象为
Ⅱ. 探究KO2与SO2的反应:

(1)正确的操作依次是
①打开K1通入N2,并维持一段时间后关闭
②实验完成,拆卸装置
③检查装置气密性,然后装入药品
④打开分液漏斗活塞K2
(2)A装置发生反应的化学方程式为
(3)用上述装置验证“KO2与SO2反应生成O2”还存在不足,你的改进措施是
(4)改进后再实验,待KO2完全反应后,将装置C中固体加水溶解,配成50.00mL溶液,等分为M、N两份。
①向M溶液中加入足量的盐酸酸化的BaCl2溶液,充分反应后,得沉淀4.66g。
②将N溶液移入锥形瓶中,用0.20mol
 L-1酸性KMnO4溶液滴定,当出现
L-1酸性KMnO4溶液滴定,当出现③依据上述现象和数据,请写出装置C中总反应的化学方程式
您最近一年使用:0次
9 . 四氯化锡是重要的化工中间体和催化剂。常温下。四氯化锡为无色液体,易溶于四氯化碳、苯等有机溶剂,极易与水反应生成锡酸(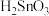 ,难溶于水、具有两性),某研究小组利用氯气与硫渣(主要成分
,难溶于水、具有两性),某研究小组利用氯气与硫渣(主要成分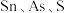 等)制备少量四氯化锡,装置如图所示。
等)制备少量四氯化锡,装置如图所示。
实验步骤:
①连接装置并检险装置气密性。
②连接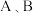 装置并加入相应试剂后,通入氮气。
装置并加入相应试剂后,通入氮气。
③控制仪器a的活塞缓慢加入浓盐酸并加热。将产生的气体缓慢通入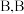 中温度维持在
中温度维持在 ,当观察到出现较多液态物质时,适当加快通入氯气并不断搅拌;当观察到B中黄绿色加深时,关闭仪器a的活塞。
,当观察到出现较多液态物质时,适当加快通入氯气并不断搅拌;当观察到B中黄绿色加深时,关闭仪器a的活塞。
回答下列问题:
(1)仪器a的名称为_____ 。仪器b中的试剂为_____ 。
(2)步骤②通入氮气的作用是_____ 。
(3)步骤③开始缓慢通入氯气,当出现较多液态物质时,可适当加快通入氯气的原因是_____ 。装置B中的温度需特维持在 ,若温度高于
,若温度高于 ,可能造成的后果是
,可能造成的后果是_____ ,应采取的措施是_____ 。
(4)四氯化锡与足量氢氧化钠溶液剧烈反应,所发生反应的化学方程式为_____ 。
(5)上述制得的四氯化锡液体中可能存在的液态杂质为_____ 。该杂质能使酸性高锰酸钾溶液褪色,生成一种对应的最高价含氧酸,该反应的离子方程式为_____
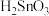 ,难溶于水、具有两性),某研究小组利用氯气与硫渣(主要成分
,难溶于水、具有两性),某研究小组利用氯气与硫渣(主要成分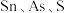 等)制备少量四氯化锡,装置如图所示。
等)制备少量四氯化锡,装置如图所示。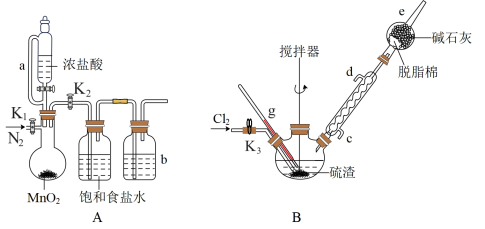
| 物质 |  | 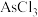 | S |
熔点 |  |  | 112 |
沸点 | 114 | 130 | 444 |
①连接装置并检险装置气密性。
②连接
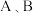 装置并加入相应试剂后,通入氮气。
装置并加入相应试剂后,通入氮气。③控制仪器a的活塞缓慢加入浓盐酸并加热。将产生的气体缓慢通入
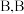 中温度维持在
中温度维持在 ,当观察到出现较多液态物质时,适当加快通入氯气并不断搅拌;当观察到B中黄绿色加深时,关闭仪器a的活塞。
,当观察到出现较多液态物质时,适当加快通入氯气并不断搅拌;当观察到B中黄绿色加深时,关闭仪器a的活塞。回答下列问题:
(1)仪器a的名称为
(2)步骤②通入氮气的作用是
(3)步骤③开始缓慢通入氯气,当出现较多液态物质时,可适当加快通入氯气的原因是
 ,若温度高于
,若温度高于 ,可能造成的后果是
,可能造成的后果是(4)四氯化锡与足量氢氧化钠溶液剧烈反应,所发生反应的化学方程式为
(5)上述制得的四氯化锡液体中可能存在的液态杂质为
您最近一年使用:0次
名校
解题方法
10 . 某小组同学用图装置 略去加热仪器等
略去加热仪器等 制备
制备 。
。
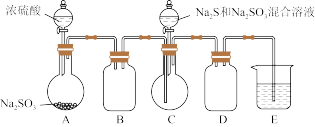
已知烧瓶 中发生反应如下:
中发生反应如下:
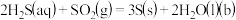

下列说法正确的是
 略去加热仪器等
略去加热仪器等 制备
制备 。
。
已知烧瓶
 中发生反应如下:
中发生反应如下:
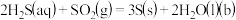

下列说法正确的是
A. 的稳定性比 的稳定性比 强 强 | B. 为 为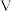 形分子 形分子 |
C. 与 与 的反应体现 的反应体现 的还原性 的还原性 | D. 、 、 的中心原子的轨道杂化类型为 的中心原子的轨道杂化类型为 |
您最近一年使用:0次
2022-09-10更新
|
169次组卷
|
3卷引用:江苏省南通市八校2022-2023学年高三上学期期初联考化学试题



