1 . 短周期主族元素 的原子序数依次增大,
的原子序数依次增大, 原子序数是6,Q元素基态原子核外有三个未成对电子,
原子序数是6,Q元素基态原子核外有三个未成对电子, 与
与 同主族,
同主族, 的原子序数是
的原子序数是 的2倍,元素
的2倍,元素 在同周期中原子半径最大。回答下列问题:
在同周期中原子半径最大。回答下列问题:
(1)可以正确描述W原子结构的是___________(填字母)。
(2)Z元素基态原子的电子排布式为___________ ,基态Z原子的价电子中,两种自旋状态的电子数之比为___________ 。
(3)基态X原子的未成对电子数为___________ ,其价电子轨道表示式为___________ 。
(4)图a、b、c分别表示W、Q,X和F的逐级电离能(Ⅰ)变化趋势(纵坐标的标度不同)。第一电离能的变化图是___________ (填标号)。

(5)W、Q、X、Y四种元素的电负性由大到小的顺序为___________ (用元素符号表示);最高价氧化物对应水化物的酸性:W___________ (填“>”或“<”)Q。
 的原子序数依次增大,
的原子序数依次增大, 原子序数是6,Q元素基态原子核外有三个未成对电子,
原子序数是6,Q元素基态原子核外有三个未成对电子, 与
与 同主族,
同主族, 的原子序数是
的原子序数是 的2倍,元素
的2倍,元素 在同周期中原子半径最大。回答下列问题:
在同周期中原子半径最大。回答下列问题:(1)可以正确描述W原子结构的是___________(填字母)。
A.原子结构示意图: | B.原子核外能量最高的电子云图像: |
C.碳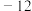 原子: 原子: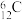 | D.原子的轨道表示式: |
(2)Z元素基态原子的电子排布式为
(3)基态X原子的未成对电子数为
(4)图a、b、c分别表示W、Q,X和F的逐级电离能(Ⅰ)变化趋势(纵坐标的标度不同)。第一电离能的变化图是

(5)W、Q、X、Y四种元素的电负性由大到小的顺序为
您最近一年使用:0次
2023-12-31更新
|
302次组卷
|
2卷引用:河北省沧州市2023-2024学年高二上学期12月月考化学试题
2 . 几种主族元素在周期表中的位置如下
(1)写出⑤元素原子形成的最高价氧化物的电子式___________ ;写出⑥元素原子形成的常见气态单质的结构式___________ 。
(2)⑥元素存在多种氧化物,其中某种氧化物为红棕色气体,写出该氧化物溶于水的化学方程式___________ ;⑥元素最高价氧化物的水化物的浓溶液不稳定,见光易分解,写出该反应的方程式___________ 。
(3)①③⑦三种元素所形成的简单离子的半径由大到小的顺序是___________ (用元素的离子符号表示)。
(4)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素在周期表中的位置是___________ 。
(5)①②③三种元素最高价氧化物对应水化物碱性最强的是___________ (填化学式)。
(6)⑦的非金属性强于⑧,下列表述中能证明这一事实的是___________ (填字母)。
a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物对应的水化物的酸性强于⑧最高价氧化物对应的水化物的酸性
c.⑦的单质能将⑧的单质从其钠盐溶液中置换出来

(1)写出⑤元素原子形成的最高价氧化物的电子式
(2)⑥元素存在多种氧化物,其中某种氧化物为红棕色气体,写出该氧化物溶于水的化学方程式
(3)①③⑦三种元素所形成的简单离子的半径由大到小的顺序是
(4)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素在周期表中的位置是
(5)①②③三种元素最高价氧化物对应水化物碱性最强的是
(6)⑦的非金属性强于⑧,下列表述中能证明这一事实的是
a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物对应的水化物的酸性强于⑧最高价氧化物对应的水化物的酸性
c.⑦的单质能将⑧的单质从其钠盐溶液中置换出来
您最近一年使用:0次
2024-03-04更新
|
290次组卷
|
2卷引用:浙江省杭州市源清中学2023-2024学年高一上学期期末考试化学试题
名校
3 . W、X、Y、Z、M五种主族元素,它们在周期表中位置如图所示,
(1)Z在元素周期表中的位置:___________ 。
(2)以上元素中金属性最强的为___________ (用元素符号表示);最高价氧化物对应水化物酸性最强的为___________ (用化学式表示)。
(3)X、W形成的化合物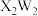 中存在的化学键类型有:
中存在的化学键类型有:___________
(4)比较X、Y的简单离子的半径大小:___________ (用离子符号表示)。
| W | |||||||
| X | Y | Z | M |
(2)以上元素中金属性最强的为
(3)X、W形成的化合物
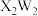 中存在的化学键类型有:
中存在的化学键类型有:(4)比较X、Y的简单离子的半径大小:
您最近一年使用:0次
2022-01-19更新
|
379次组卷
|
2卷引用:浙江省杭州市七县市2021-2022学年高一上学期期末学业水平测试化学试题
名校
4 . 元素周期表与元素周期律在学习、研究中有很重要的作用。下表所示为某5种元素的相关信息,已知W、X都位于第三周期。回答下列问题:
(1)W在元素周期表中的位置为______ ,X的最高价氧化物对应的水化物的电子式为_______ 。
(2)金属性:Y_____ X(填“>”或“<”)
(3)下列对于Z及其化合物的推断中正确的是___________(填标号)。
(4)将X元素的单质在Q元素的单质中点燃生成M,预测将M投入FeSO4溶液中,主要的反应现象是______ 。
| 元素 | 信息 |
| Q | 地壳中含量最高的元素 |
| W | 最高化合价为+7 |
| X | 最高价氧化物对应的水化物在本周期中碱性最强 |
| Y | 焰色试验(透过蓝色钴玻璃)的火焰呈紫色 |
| Z | 原子结构示意图为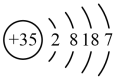 |
(2)金属性:Y
(3)下列对于Z及其化合物的推断中正确的是___________(填标号)。
| A.Z元素的化合价只有-1和+7 |
| B.Z的最高价氧化物对应水化物的酸性弱于W的最高价氧化物对应水化物的酸性 |
| C.Z的气态氢化物比W的气态氢化物稳定 |
| D.Z单质的熔沸点比W单质的熔沸点高 |
您最近一年使用:0次
5 . Ⅰ.A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)B为_______ ,D的最高价氧化物对应的水化物是______ ,简单离子半径大小B_______ (填“>”“<”或“=”)C。
(2)写出A、B的化合物与E反应的化学方程式:_______ 。
(3)A、B两元素形成的化合物属于______ (填“离子”或“共价”)化合物。
Ⅱ.随原子序数的递增,八种短周期元素原子半径的相对大小、最高正价或最低负价的变化如图所示。

回答下列问题:
(1)A、B均为以上某两种元素组成的分子,A中有四个原子核和10个电子,B中有6个原子核和18个电子,则A的分子式为________ ,B的分子式为_________ 。
(2)比较e、f两种元素对应离子的半径大小______ (用元素离子符号表示);非金属性g_____ (填“强于”或“弱于”)h,用一个化学方程式证明你的判断________ 。
(1)B为
(2)写出A、B的化合物与E反应的化学方程式:
(3)A、B两元素形成的化合物属于
Ⅱ.随原子序数的递增,八种短周期元素原子半径的相对大小、最高正价或最低负价的变化如图所示。

回答下列问题:
(1)A、B均为以上某两种元素组成的分子,A中有四个原子核和10个电子,B中有6个原子核和18个电子,则A的分子式为
(2)比较e、f两种元素对应离子的半径大小
您最近一年使用:0次
名校
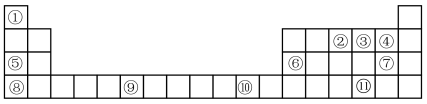
6 . 表格为门捷列夫元素周期表的一部分,其中的编号代表对应的元素。用元素符号回答下列问题:
(1)基态F原子有___________ 种运动状态的电子。
(2)元素③⑪电负性较大的是___________ ;Se的原子结构示意图为___________ 。
(3)元素铬的基态原子的价电子排布图为:___________ 。
(4)Cu基态原子中,能量最高的电子占据的原子轨道的形状为___________ 。
(5)该表格中电负性最大的元素与第一电离能最小的元素形成的化合物的电子式为________ 。
(6)②③的简单气态氢化物中较稳定的是___________ (填化学式),元素⑥⑦的最高价氧化物的水化物相互反应的离子方程式为___________ 。
(1)基态F原子有
(2)元素③⑪电负性较大的是
(3)元素铬的基态原子的价电子排布图为:
(4)Cu基态原子中,能量最高的电子占据的原子轨道的形状为
(5)该表格中电负性最大的元素与第一电离能最小的元素形成的化合物的电子式为
(6)②③的简单气态氢化物中较稳定的是
您最近一年使用:0次
2023-09-16更新
|
255次组卷
|
2卷引用:福建省龙岩市连城县第一中学2022-2023学年高二下学期3月月考化学试题
7 . 联合国大会将2019年定为“化学元素周期表国际年”,高度体现了元素周期表的重要性。下列列出了部分元素在周期表中的位置:
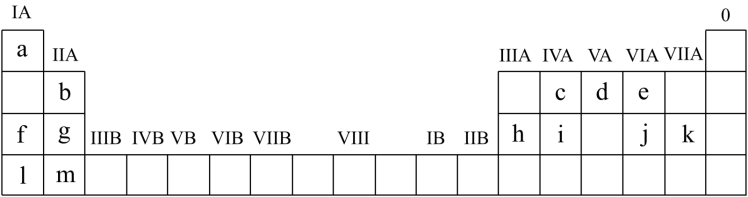
(1)元素a~m中金属性最强的是___ (填元素符号),原子最外层电子数与所处周期相同的元素有___ 种。
(2)g、h、m三种元素最高价氧化物对应的水化物的碱性由强到弱依次为___ (填化学式)。
(3)《天工开物》记载,“凡火药,以硝石、硫磺为主,草木灰为辅”,由d、e、l三种元素组成的化合物是硝石的主要成分,化学式为___ ,爆炸时可将___ 能转化为热能。
(4)由元素e与元素f组成的一种化合物可用于潜艇供养,该化合物中所含化学键类型有___ 键和___ 键。
(5)元素h的纳米级单质均匀分散在冰中形成的混合物,是一种固体火箭推进剂。该推进剂高温时产生固体氧化物和元素a的单质,反应的化学反应方程式为___ 。

(1)元素a~m中金属性最强的是
(2)g、h、m三种元素最高价氧化物对应的水化物的碱性由强到弱依次为
(3)《天工开物》记载,“凡火药,以硝石、硫磺为主,草木灰为辅”,由d、e、l三种元素组成的化合物是硝石的主要成分,化学式为
(4)由元素e与元素f组成的一种化合物可用于潜艇供养,该化合物中所含化学键类型有
(5)元素h的纳米级单质均匀分散在冰中形成的混合物,是一种固体火箭推进剂。该推进剂高温时产生固体氧化物和元素a的单质,反应的化学反应方程式为
您最近一年使用:0次
2021-05-23更新
|
677次组卷
|
3卷引用:2021年1月广东省普通高中学业水平合格性考试化学试题
名校
解题方法
8 . 短周期主族元素 、
、 、
、 、
、 、
、 原子序数依次增大,
原子序数依次增大, 的最高价含氧酸与其气态氢化物能发生化合反应生成
的最高价含氧酸与其气态氢化物能发生化合反应生成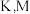 的原子半径是同周期中最小的,
的原子半径是同周期中最小的, 的焰色反应火焰呈黄色,
的焰色反应火焰呈黄色, 的最外层电子数和电子层数相等,
的最外层电子数和电子层数相等, 和
和 为同一族。
为同一族。
(1) 元素在周期表中的位置为
元素在周期表中的位置为___________ 。
(2) 的化学式为
的化学式为___________ 。
(3) 元素最高正价与最低负价代数和为
元素最高正价与最低负价代数和为___________ 。
(4) 、
、 、
、 元素原子半径由大到小的顺序为
元素原子半径由大到小的顺序为___________  用元素符号回答
用元素符号回答 。
。
(5) 、
、 两种元素的最高价氧化物对应的水化物中,碱性最弱的是
两种元素的最高价氧化物对应的水化物中,碱性最弱的是___________  填化学式
填化学式 。
。
(6)下列可作为比较 和
和 的非金属性强弱的依据是___________
的非金属性强弱的依据是___________ 填序号
填序号 。
。
(7) 元素和
元素和 元素形成的化合物
元素形成的化合物 是一种新型无机材料,它可与过量烧碱溶液反应产生使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式为
是一种新型无机材料,它可与过量烧碱溶液反应产生使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式为___________ 。
 、
、 、
、 、
、 、
、 原子序数依次增大,
原子序数依次增大, 的最高价含氧酸与其气态氢化物能发生化合反应生成
的最高价含氧酸与其气态氢化物能发生化合反应生成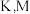 的原子半径是同周期中最小的,
的原子半径是同周期中最小的, 的焰色反应火焰呈黄色,
的焰色反应火焰呈黄色, 的最外层电子数和电子层数相等,
的最外层电子数和电子层数相等, 和
和 为同一族。
为同一族。(1)
 元素在周期表中的位置为
元素在周期表中的位置为(2)
 的化学式为
的化学式为(3)
 元素最高正价与最低负价代数和为
元素最高正价与最低负价代数和为(4)
 、
、 、
、 元素原子半径由大到小的顺序为
元素原子半径由大到小的顺序为 用元素符号回答
用元素符号回答 。
。(5)
 、
、 两种元素的最高价氧化物对应的水化物中,碱性最弱的是
两种元素的最高价氧化物对应的水化物中,碱性最弱的是 填化学式
填化学式 。
。(6)下列可作为比较
 和
和 的非金属性强弱的依据是___________
的非金属性强弱的依据是___________ 填序号
填序号 。
。| A.氢化物的稳定性 |
B.单质与 反应的难易程度 反应的难易程度 |
| C.最高价氧化物的水化物酸性强弱 |
D.将 的单质通入 的单质通入 的钠盐溶液观察是否有 的钠盐溶液观察是否有 逸出 逸出 |
 元素和
元素和 元素形成的化合物
元素形成的化合物 是一种新型无机材料,它可与过量烧碱溶液反应产生使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式为
是一种新型无机材料,它可与过量烧碱溶液反应产生使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式为
您最近一年使用:0次
2024-02-12更新
|
235次组卷
|
3卷引用:上海市松江二中2023-2024学年高二上学期12月月考化学试题
名校
9 . 下图所示的两种化合物可应用于阻燃材料和生物材料的合成。其中W、X、Y、Z为原子序数依次增大的短周期元素,X和Z同主族,Y原子序数为W原子价电子数的3倍。请回答下列问题:
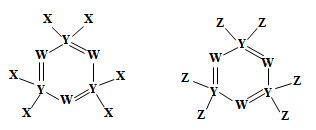
(1)元素Y在周期表中的位置为___________ ,元素Z的最高价氧化物的水化物的化学式为_____ 。
(2)元素W、X、Y、Z的简单阴离子半径由大到小的顺序为_____ 。
(3)Z、W和氢三种元素形成的同时含有离子键和共价键化合物的电子式为_____ 。
(4)研究Y、Z非金属性强弱的方案中不可行的是___________(填序号)。
(5)许多含元素Z的化合物均可作为杀菌消毒剂,将ZO2通入到NaOH和H2O2混合溶液中,可制备NaZO2。
查阅资料:NaZO2晶体易溶于水,难溶于乙醇。NaZO2饱和溶液在温度低于38 ℃时析出NaZO2·3H2O晶体,高于38 ℃时析出NaZO2晶体,高于60 ℃时NaZO2分解成NaZO3和NaZ。
①写出由ZO2制备NaZO2的离子方程式_____ 。
②从上述NaZO2溶液获得干燥的NaZO2晶体的操作步骤为:将溶液在减压和55 ℃条件下蒸发至大量晶体析出后,___________ ,___________ ,低于60℃干燥,得到NaZO2晶体 (补全实验步骤)。

(1)元素Y在周期表中的位置为
(2)元素W、X、Y、Z的简单阴离子半径由大到小的顺序为
(3)Z、W和氢三种元素形成的同时含有离子键和共价键化合物的电子式为
(4)研究Y、Z非金属性强弱的方案中不可行的是___________(填序号)。
| A.比较其简单氢化物的沸点 | B.比较其单质与氢气反应的难易程度 |
| C.比较其简单阴离子的还原性 | D.比较其氧化物的水化物的酸性 |
查阅资料:NaZO2晶体易溶于水,难溶于乙醇。NaZO2饱和溶液在温度低于38 ℃时析出NaZO2·3H2O晶体,高于38 ℃时析出NaZO2晶体,高于60 ℃时NaZO2分解成NaZO3和NaZ。
①写出由ZO2制备NaZO2的离子方程式
②从上述NaZO2溶液获得干燥的NaZO2晶体的操作步骤为:将溶液在减压和55 ℃条件下蒸发至大量晶体析出后,
您最近一年使用:0次
名校
解题方法
10 . (I)俄美科学家联合小组宣布合成出114号元素(Fl)的一种同位素,该原子的质量数是289,试回答下列问题:
(1)该元素在周期表中的位置为:_______ ,属于_______ 元素(填“金属”或“非金属”)。
(II)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:
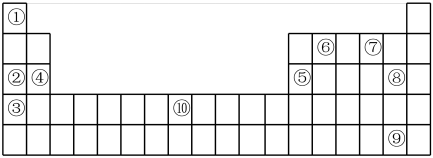
(2)②③④三种元素最高价氧化物的水化物碱性由强到弱的顺序是_______ (填化学式)。
(3)元素⑦的简单氢化物与③的单质反应的离子方程式为_______ ;
(4)元素②和⑤的最高价氧化物的水化物反应的离子方程式为_______ ;
(5)元素⑩的名称为_______ ,其单质与⑧的单质反应的化学方程式为_______ ;
(6)部分短周期元素的原子半径及主要化合价如下表,判断以下叙述不正确的是_______
A.L2+、R2-的核外电子数相等
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物具有两性
D.简单氢化物的沸点为HnT>HnR
E.T与R可形成的化合物TR2、TR3
F.Q与M的单质均能与盐酸、NaOH溶液反应放出氢气
(1)该元素在周期表中的位置为:
(II)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:

(2)②③④三种元素最高价氧化物的水化物碱性由强到弱的顺序是
(3)元素⑦的简单氢化物与③的单质反应的离子方程式为
(4)元素②和⑤的最高价氧化物的水化物反应的离子方程式为
(5)元素⑩的名称为
(6)部分短周期元素的原子半径及主要化合价如下表,判断以下叙述不正确的是
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物具有两性
D.简单氢化物的沸点为HnT>HnR
E.T与R可形成的化合物TR2、TR3
F.Q与M的单质均能与盐酸、NaOH溶液反应放出氢气
您最近一年使用:0次



