1 . 针对表中10种元素及由这些元素形成的单质和化合物,用元素符号或者化学式填写以下空格。
(1)最活泼的金属元素是___________ ,最活泼的非金属元素是___________ ,最不活泼的元素是___________ 。
(2)碱性最强的最高价氧化物对应水化物是___________ ,酸性最强的最高价氧化物对应水化物是___________ ,最稳定的气态氢化物是___________ 。
(3)在④与⑤中,还原性较强的是___________ ,在⑧与⑨的单质中,氧化性较强的是___________ 。
(4)④的最高价氧化物对应的水化物和⑥的最高价氧化物对应的水化物相互反应的化学方程式为:___________ ;用电子式表示④和⑧形成的化合物的形成过程___________ 。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 4 | ⑩ |
(2)碱性最强的最高价氧化物对应水化物是
(3)在④与⑤中,还原性较强的是
(4)④的最高价氧化物对应的水化物和⑥的最高价氧化物对应的水化物相互反应的化学方程式为:
您最近一年使用:0次
名校
解题方法
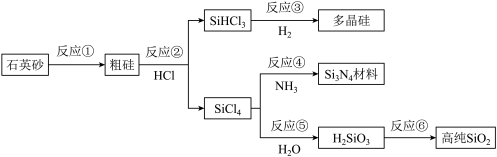
2 . 如图,通过工业联产可有效解决多晶硅(Si)生产中副产物SiCl4._______ 。
(2)反应①工业生产采用焦炭高温还原法制备,其化学方程式为_______ 。
(3)流程中涉及的化学反应属于氧化还原反应的有_______ (填反应序号)。
(4)高温下,反应④的化学方程式为_______ 。
(5)在多晶硅、Si3N4材料和高纯SiO2中,可用于制造光导纤维的是_______ 。
(6)实验室不能使用玻璃塞的细口瓶装氢氧化钠,原因是_______ (用化学方程式表示)。
(7)Si和Ge属于同主族元素,下列预测合理的是_______ (填选项序号)。
a.Ge与H2化合难于Si
b.GeO2既有氧化性又有还原性
c.酸性H2GeO3>H2SiO3
d.Si和Ge都可做半导体材料
(2)反应①工业生产采用焦炭高温还原法制备,其化学方程式为
(3)流程中涉及的化学反应属于氧化还原反应的有
(4)高温下,反应④的化学方程式为
(5)在多晶硅、Si3N4材料和高纯SiO2中,可用于制造光导纤维的是
(6)实验室不能使用玻璃塞的细口瓶装氢氧化钠,原因是
(7)Si和Ge属于同主族元素,下列预测合理的是
a.Ge与H2化合难于Si
b.GeO2既有氧化性又有还原性
c.酸性H2GeO3>H2SiO3
d.Si和Ge都可做半导体材料
您最近一年使用:0次
3 . 下列性质的比较,不能用元素周期律解释的是
A.热稳定性: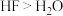 | B.氧化性: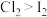 |
C.碱性: | D.酸性: |
您最近一年使用:0次
2024-01-28更新
|
161次组卷
|
2卷引用:河北省保定市2023-2024学年高一上学期1月期末化学试题
名校
4 . 硒( )是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取而得。
)是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取而得。
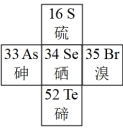
(1)硒在元素周期表中的位置如图所示:
① 在元素周期表中位置表示为
在元素周期表中位置表示为_______ ;
②用电子式表示 的形成过程:
的形成过程:_______ 。
(2)阳极泥中的硒主要以 和
和 的形式存在,工业上提取硒的流程如下:
的形式存在,工业上提取硒的流程如下:
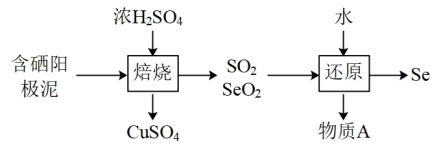
①请写出 与浓
与浓 反应的化学方程式:
反应的化学方程式:_______ 。
②写出“还原”步骤对应的化学方程式,并用单线桥标出电子转移情况:_______ 。
(3)下列说法正确的是_______。
 )是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取而得。
)是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取而得。
(1)硒在元素周期表中的位置如图所示:
①
 在元素周期表中位置表示为
在元素周期表中位置表示为②用电子式表示
 的形成过程:
的形成过程:(2)阳极泥中的硒主要以
 和
和 的形式存在,工业上提取硒的流程如下:
的形式存在,工业上提取硒的流程如下:
①请写出
 与浓
与浓 反应的化学方程式:
反应的化学方程式:②写出“还原”步骤对应的化学方程式,并用单线桥标出电子转移情况:
(3)下列说法正确的是_______。
A. 既有氧化性又有还原性 既有氧化性又有还原性 | B.原子半径由大到小顺序: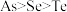 |
C.热稳定性: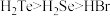 | D.酸性: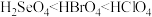 |
您最近一年使用:0次
2022-03-30更新
|
429次组卷
|
3卷引用:专题09 原子结构 元素周期律和周期表-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)
(已下线)专题09 原子结构 元素周期律和周期表-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)江苏省泰州中学2021-2022学年高一上学期期末考试化学试题四川省泸县第四中学2022-2023学年高一上学期第三次月考化学试题
解题方法
5 . 有以下6种元素,其中R、W、X、Y、M是原子序数依次增大的五种短周期元素,R最常见同位素的原子核中不含中子。W与X可形成两种稳定的化合物:WX和WX2.工业革命以来,人类使用的化石燃料在燃烧过程中将大量WX2排入大气,在一定程度导致地球表面平均温度升高。Y与X是同一主族的元素,且在元素周期表中与X相邻。Q是第4周期第Ⅷ族元素,它的一种复杂的化合物是具有磁性的黑色晶体。
(1)若R的一种原子中质子数和中子数相等,则R的原子组成符号为___________ ;R2Y、R2X都属于___________ (填“离子”或“共价”)化合物。W在元素周期表中的位置___________ 。
(2)M是生活中常见的一种元素,它能与很多元素形成化合物。
①用电子式表示RM的形成过程___________ 。
②如图所示,将M单质水溶液滴入试管中。试管中的实验现象为___________ 。___________ 。
③MX2是一种高效消毒剂,工业上用其处理中性废水中的锰,使 转化为MnO2沉淀除去,M被还原至最低价,该反应的离子方程式为
转化为MnO2沉淀除去,M被还原至最低价,该反应的离子方程式为___________ 。
(3)元素硒(Se)的原子结构示意图为
根据元素周期律,下列推断正确的是___________ (填字母序号)
a.Se位于第4周期、与Y同主族 b.Se的最低负化合价为-2价
c.SeO2具有还原性 d.H2Se的还原性比H2Y强
e.H2SeO3的酸性强于H2SO4 f.SeO2在一定条件下可与NaOH溶液反应
(4)下列事实能判断元素金属性强弱的是___________ (填字母)。
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
(1)若R的一种原子中质子数和中子数相等,则R的原子组成符号为
(2)M是生活中常见的一种元素,它能与很多元素形成化合物。
①用电子式表示RM的形成过程
②如图所示,将M单质水溶液滴入试管中。试管中的实验现象为

③MX2是一种高效消毒剂,工业上用其处理中性废水中的锰,使
 转化为MnO2沉淀除去,M被还原至最低价,该反应的离子方程式为
转化为MnO2沉淀除去,M被还原至最低价,该反应的离子方程式为(3)元素硒(Se)的原子结构示意图为

根据元素周期律,下列推断正确的是
a.Se位于第4周期、与Y同主族 b.Se的最低负化合价为-2价
c.SeO2具有还原性 d.H2Se的还原性比H2Y强
e.H2SeO3的酸性强于H2SO4 f.SeO2在一定条件下可与NaOH溶液反应
(4)下列事实能判断元素金属性强弱的是
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
您最近一年使用:0次
解题方法
6 . 下表是元素周期表的一部分,针对编号①~⑫元素,回答下列有关问题:
(1)在这些元素中,非金属性最强的元素是_______ (填元素符号,下同),最不活泼的元素是_______ 。
(2)写出元素①对应气态氢化物的化学式和电子式:_______ 、_______ 。
(3)在元素③和④中,单质与水反应较剧烈的是_______ (填元素符号),它与水反应的化学方程式是_______ 。
(4)在元素③、④与⑤的最高价氧化物对应的水化物中,碱性最弱是_______ (填化学式)。
(5)能证明⑧和⑫单质氧化性强弱的实验事实 用离子方程式表示)是
用离子方程式表示)是_______ 。
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |  |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 四 | ⑩ | ⑪ | ⑫ |
(2)写出元素①对应气态氢化物的化学式和电子式:
(3)在元素③和④中,单质与水反应较剧烈的是
(4)在元素③、④与⑤的最高价氧化物对应的水化物中,碱性最弱是
(5)能证明⑧和⑫单质氧化性强弱的实验事实
 用离子方程式表示)是
用离子方程式表示)是
您最近一年使用:0次
名校
解题方法
7 . 下列性质的比较,强弱关系正确且能用元素周期律解释的是
A.酸性: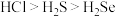 | B.碱性: |
C.还原性: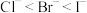 | D.沸点: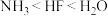 |
您最近一年使用:0次
2022-11-17更新
|
258次组卷
|
3卷引用:宁夏吴忠市吴忠中学2023-2024学年高二下学期第一次月考化学试卷
宁夏吴忠市吴忠中学2023-2024学年高二下学期第一次月考化学试卷山东省泰安市2022-2023学年高三上学期11月期中化学试题(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
解题方法
8 . 短周期元素G、M、W、X、Y、Z的原子半径及其最高正化合价随原子序数递增的变化如图所示:

| A.碱性:GOH>XOH | B.还原性: HW> HZ>H2Y |
| C.酸性:HZO4<H2YO4 | D.离子半径:M3->W->X+ |
您最近一年使用:0次
2020-11-09更新
|
650次组卷
|
6卷引用:天津市第四十七中学2023-2024学年高一下学期5月期中考试化学试题
解题方法
9 . 如图所示为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素原子的核电荷数为X元素的2倍。下列说法正确的是
| X | ||
| Y | Z | W |
| T |
| A.X、W、Z元素的原子半径依次增大,它们的气态氢化物的热稳定性依次增强 |
| B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物对应水化物的酸性依次增强 |
| C.Z、W的简单离子半径依次增大 |
D.根据元素周期律,可以推测T元素的单质具有半导体特性, 具有氧化性和还原性 具有氧化性和还原性 |
您最近一年使用:0次
2020-09-24更新
|
226次组卷
|
2卷引用:山东省菏泽市单县二中2023-2024学年高一下学期段考化学试题
名校
解题方法
10 . 元素周期表与元素周期律在学习、研究和生产时间中有很重要的作用。现有5种短周期主族元素。X的一种核素在考古时常用来测定文物的年代;Y的最外层电子数是次外层电子数的3倍;Z在短周期主族元素中原子半径最大;W的单质,常温下是一种黄绿色的气体;Q的最高化合价与最低化合价的代数和为4。回答下列问题:
(1)X在元素周期表中的位置:________ 。
(2)由Y与Z组成的一种化合物可作供氧剂,该化合物中所含化学键的类型为______ 。
(3)Y、Z、Q按简单离子半径由大到小的顺序排列为________ (用离子符号表示)。
(4)写出W的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物反应的离子方程式为:___________ 。
(5)研究W、Q非金属性强弱的方案中不可行的是________ (填字母)。
a.比较W、Q简单氢化物沸点的高低 b.比较W、Q单质与氢气反应的难易程度
c.比较W、Q简单阴离子的还原性强弱 d.比较W、Q氧化物对应的水化物的酸性
(1)X在元素周期表中的位置:
(2)由Y与Z组成的一种化合物可作供氧剂,该化合物中所含化学键的类型为
(3)Y、Z、Q按简单离子半径由大到小的顺序排列为
(4)写出W的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物反应的离子方程式为:
(5)研究W、Q非金属性强弱的方案中不可行的是
a.比较W、Q简单氢化物沸点的高低 b.比较W、Q单质与氢气反应的难易程度
c.比较W、Q简单阴离子的还原性强弱 d.比较W、Q氧化物对应的水化物的酸性
您最近一年使用:0次



