名校
解题方法
1 . 如表为元素周期表的一部分,请参照元素在表中①-⑩的位置,用相应的化学用语回答下列问题:
(1)形成化合物种类最多的元素在周期表中的位置是_______ 。
(2)元素⑦的简单离子结构示意图为______ 。
(3)元素④、⑤、⑨形成的简单氢化物稳定性由弱到强的顺序为______ (用化学式作答,下同)。元素③、⑧、⑩形成的最高价氧化物对应的水化物的酸性由强到弱的顺序为______ 。
(4)10种元素中,金属性最强的是______ (填序号),该元素与④形成的含有非极性共价键的化合物的电子式为______ 。
(5)元素②的单质和元素⑨的最高价氧化物对应的水化物反应的化学方程式为______ 。某同学为检验气体产物设计了如图的实验装置,据此回答问题:
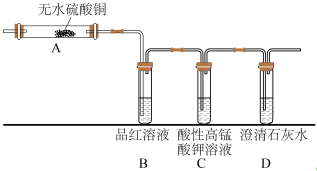
①B中的实验现象是______ ,证明产物中有______ 。
②装置C的作用是______ ,发生的化学反应方程式为______ 。
(6)下列事实能说明⑩元素原子得电子能力比⑨元素原子强的是______ (填序号)。
①氢化物的溶解度:⑩>⑨
②氢化物的酸性:⑩>⑨
③氢化物的稳定性:⑩>⑨
④氢化物的还原性:⑩<⑨
⑤最高价氧化物对应的水化物的酸性:⑩>⑨
⑥单质的氧化性:⑩>⑨
⑦对应阴离子的还原性:⑩<⑨
⑧单质⑩通入⑨的氢化物水溶液中可生成单质⑨
⑨在周期表中⑩处于⑨同周期的右侧
| 族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(2)元素⑦的简单离子结构示意图为
(3)元素④、⑤、⑨形成的简单氢化物稳定性由弱到强的顺序为
(4)10种元素中,金属性最强的是
(5)元素②的单质和元素⑨的最高价氧化物对应的水化物反应的化学方程式为

①B中的实验现象是
②装置C的作用是
(6)下列事实能说明⑩元素原子得电子能力比⑨元素原子强的是
①氢化物的溶解度:⑩>⑨
②氢化物的酸性:⑩>⑨
③氢化物的稳定性:⑩>⑨
④氢化物的还原性:⑩<⑨
⑤最高价氧化物对应的水化物的酸性:⑩>⑨
⑥单质的氧化性:⑩>⑨
⑦对应阴离子的还原性:⑩<⑨
⑧单质⑩通入⑨的氢化物水溶液中可生成单质⑨
⑨在周期表中⑩处于⑨同周期的右侧
您最近一年使用:0次
名校
2 . 下图为元素周期表的一部分,请参照① ⑨在表中的位置,回答下列问题:
⑨在表中的位置,回答下列问题:
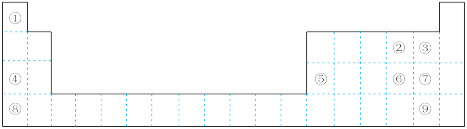
(1)最高价氧化物对应水化物碱性最强的是_______ (填化学式),氢化物热稳定性最强的是_______ (填电子式)。
(2)②③④的原子半径从大到小的顺序是_______ (填元素符号)。④⑤⑧的阳离子中氧化性最强的是_______ (填离子符号)。
(3)元素⑥的非金属性比⑦_______ (填“强”或“弱”),请从原子结构的角度解释:_______ 。
(4)现在含有元素硒( )的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多
)的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多 个电子层,硒在周期表中的位置为
个电子层,硒在周期表中的位置为_______ ,则下列叙述中正确的是_______ 。
A.原子序数为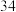
B.气态氢化物的稳定性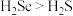
C. 不能与氢氧化钠反应
不能与氢氧化钠反应
D. 既有氧化性又有还原性
既有氧化性又有还原性
(5)①和④可形成 型离子化合物,该离子化合物的电子式为
型离子化合物,该离子化合物的电子式为_______ ,其与水反应放出气体的化学方程式为_______ 。
 ⑨在表中的位置,回答下列问题:
⑨在表中的位置,回答下列问题:
(1)最高价氧化物对应水化物碱性最强的是
(2)②③④的原子半径从大到小的顺序是
(3)元素⑥的非金属性比⑦
(4)现在含有元素硒(
 )的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多
)的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多 个电子层,硒在周期表中的位置为
个电子层,硒在周期表中的位置为A.原子序数为
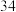
B.气态氢化物的稳定性
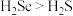
C.
 不能与氢氧化钠反应
不能与氢氧化钠反应D.
 既有氧化性又有还原性
既有氧化性又有还原性(5)①和④可形成
 型离子化合物,该离子化合物的电子式为
型离子化合物,该离子化合物的电子式为
您最近一年使用:0次
2023-02-05更新
|
278次组卷
|
2卷引用:湖南省郴州市苏仙区多校2022-2023学年高一上学期期末线上联考化学试题
3 . 国家卫生健康委员会发布公告称,富硒酵母、二氧化硅、硫黄等6种食品添加剂新品种安全性已通过审查,这些食品添加剂包括食品营养强化剂、风味改良剂、结构改善剂、防腐剂,用于食品生产中,丰富舌尖上的营养和美味。氧、硫、硒为同一主族元素,请回答下列问题:
(1)硒(Se)是一种生命元素,有抗癌、抗衰老等重要功能。富硒酵母是一种新型添加剂,其中硒元素在周期表中的位置为___________ 。工业上用浓H2SO4焙烧CuSe的方法提取硒(其中Cu转化为CuSO4),且有SO2、H2O和SeO2(固体)生成,写出发生反应的化学方程式:___________ 。理论上该反应每转移1mol电子,得到的SeO2的质量为___________ 。
(2)下列说法正确的是___________。
(3)短周期元素d.e、f、g、h、x都可能存在于某些食品添加剂中,其最高正化合价或最低负化合价与原子序数的关系如图所示:
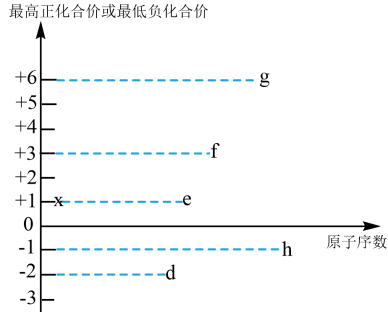
①由x、h、d三种元素组成的化合物的电子式为___________ 。
②D.e、f、g、h元素形成的简单离子中,半径最大的离子结构示意图为___________ 。
③x和d组成的化合物中,既含有极性共价键又含有非极性共价键,此化合物可将碱性工业废水中的 氧化,生成碳酸盐和氨气,相应的离子方程式为
氧化,生成碳酸盐和氨气,相应的离子方程式为___________ 。
④e和d组成的某化合物,可做呼吸面具的供氧剂,用电子式表示其形成过程___________ 。
(4)向一定量的Fe和Fe2O3的混合物中加入480mL0.250mol•L-1稀盐酸后恰好完全溶解,放出标准状况下的气体672mL,在溶液中加入KSCN溶液无血红色出现。回答下列问题:产生的气体的物质的量为___________ mol。若忽略反应前后溶液体积变化,则最终所得溶液中溶质的物质的量浓度为___________ mol•L-1.若要将溶液中的铁元素全部转化为Fe3+,至少需要标准状况下Cl2的体积为___________ L。
(1)硒(Se)是一种生命元素,有抗癌、抗衰老等重要功能。富硒酵母是一种新型添加剂,其中硒元素在周期表中的位置为
(2)下列说法正确的是___________。
A.热稳定性: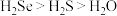 | B.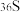 与 与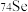 的中子数之和为60 的中子数之和为60 |
C.酸性: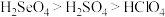 | D.还原性:Se2- < S2- |

①由x、h、d三种元素组成的化合物的电子式为
②D.e、f、g、h元素形成的简单离子中,半径最大的离子结构示意图为
③x和d组成的化合物中,既含有极性共价键又含有非极性共价键,此化合物可将碱性工业废水中的
 氧化,生成碳酸盐和氨气,相应的离子方程式为
氧化,生成碳酸盐和氨气,相应的离子方程式为④e和d组成的某化合物,可做呼吸面具的供氧剂,用电子式表示其形成过程
(4)向一定量的Fe和Fe2O3的混合物中加入480mL0.250mol•L-1稀盐酸后恰好完全溶解,放出标准状况下的气体672mL,在溶液中加入KSCN溶液无血红色出现。回答下列问题:产生的气体的物质的量为
您最近一年使用:0次
2024-01-05更新
|
536次组卷
|
2卷引用:山西运城盐湖五中2023-2024学年高一上学期化学期末练兵卷(三)
名校
4 . 下列有关性质的比较,不能用元素周期律解释的是
| A.酸性:H2SO4>H3PO4 | B.非金属性:N>P |
| C.氧化性:O2>S | D.高温时的还原性:C>Si |
您最近一年使用:0次
5 . 硒是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取硒。
(1)粗铜精炼时,通常用精铜作____ 极(填“阴”或“阳”)。
(2)硒在元素周期表中的位置如图所示:

Se原子结构示意图可表示为________ 。
②从原子结构角度解释硫与硒元素性质相似与不同的原因:同一主族________ 。
(3)阳极泥中的硒主要以Se和CuSe的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
i.将含硒阳极泥与浓硫酸混合焙烧,产生SO2、SeO2的混合气体
ii.用水吸收i中混合气体,可得Se固体
① 请写出CuSe与浓H2SO4反应的化学方程式________ 。
② 焙烧过程产生的烟气中含有少量SeO2,可用NaOH溶液吸收,二者反应生成一种盐,该盐的化学式为_______ 。
③ 写出步骤ⅱ中的化学方程式_______ 。
(4)下列说法合理的是________ 。
a. SeO2既有氧化性又有还原性,其还原性比SO2强
b. 浓硒酸可能具有强氧化性、脱水性
c. 热稳定性:H2Se < HCl < H2S
d. 酸性:H2SeO4 < HBrO4 < HClO4
(1)粗铜精炼时,通常用精铜作
(2)硒在元素周期表中的位置如图所示:

Se原子结构示意图可表示为
②从原子结构角度解释硫与硒元素性质相似与不同的原因:同一主族
(3)阳极泥中的硒主要以Se和CuSe的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
i.将含硒阳极泥与浓硫酸混合焙烧,产生SO2、SeO2的混合气体
ii.用水吸收i中混合气体,可得Se固体
① 请写出CuSe与浓H2SO4反应的化学方程式
② 焙烧过程产生的烟气中含有少量SeO2,可用NaOH溶液吸收,二者反应生成一种盐,该盐的化学式为
③ 写出步骤ⅱ中的化学方程式
(4)下列说法合理的是
a. SeO2既有氧化性又有还原性,其还原性比SO2强
b. 浓硒酸可能具有强氧化性、脱水性
c. 热稳定性:H2Se < HCl < H2S
d. 酸性:H2SeO4 < HBrO4 < HClO4
您最近一年使用:0次
名校
6 . 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其次外层电子数的3倍,Z可与X形成淡黄色化合物 ,Y、W的最外层电子数相同。下列说法错误的是
,Y、W的最外层电子数相同。下列说法错误的是
 ,Y、W的最外层电子数相同。下列说法错误的是
,Y、W的最外层电子数相同。下列说法错误的是| A.非金属性:X>Y |
| B.Y的单质和W的单质均可与水反应 |
| C.简单离子半径:Y>Z |
D. 既有氧化性,又有还原性 既有氧化性,又有还原性 |
您最近一年使用:0次
名校
7 . 元素周期表的表达形式有多种,但都能表示出元素的周期性变化规律,请回答下列问题:
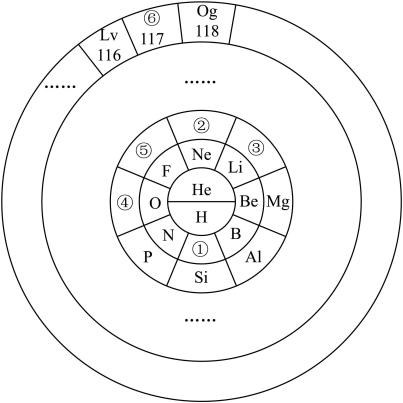
(1)①与④元素形成的化合物属于___________ 晶体。
(2)写出③的最高价氧化物对应水化物和Al的最高价氧化物的水化物相互反应的离子方程式:__________ 。
(3)②号元素为___________ (填元素符号)。请写出1个与②核外电子数相同的简单离子组成的化合物的化学式:___________ 。其中存在的化学键属于___________ 键,该物质在熔融状态下___________ 导电(填“能”或“不能”)。
(4)⑤的单质具有较强的氧化性,能与大多数金属发生反应,请写出⑤的单质与过量的铁粉反应的化学方程式:___________ ,将反应所得混合物溶于水,得到浅绿色的溶液,请写出相关的离子方程式:___________ 。
(5)其中非金属性④___________ ⑤(填“>”或“<”),请用一个化学方程式证明___________ 。
(6)⑥(原子序数117)的单质是一种具有放射性的卤族元素,它在元素周期表中的位置为___________ ,根据元素的周期性规律,以下推测正确的是________
A.单质在常温下为气体 B.气态氢化物的稳定性较好
C.离子具有强还原性 D.半径大于⑤

(1)①与④元素形成的化合物属于
(2)写出③的最高价氧化物对应水化物和Al的最高价氧化物的水化物相互反应的离子方程式:
(3)②号元素为
(4)⑤的单质具有较强的氧化性,能与大多数金属发生反应,请写出⑤的单质与过量的铁粉反应的化学方程式:
(5)其中非金属性④
(6)⑥(原子序数117)的单质是一种具有放射性的卤族元素,它在元素周期表中的位置为
A.单质在常温下为气体 B.气态氢化物的稳定性较好
C.离子具有强还原性 D.半径大于⑤
您最近一年使用:0次
名校
8 . 下表是元素周期表的一部分,请按要求回答下列问题:
(1)元素①形成的温室气体(氧化物)的结构式为___________ 。
(2)元素④⑤⑥的简单离子半径由大到小的顺序是___________ (用离子符号表示)。
(3)用电子式表示元素③和元素⑥组成的化合物的形成过程___________ 。
(4)用离子方程式表示元素④的最高价氧化物与元素②的最高价氧化物的水化物的反应___________ 。
(5)下列对元素⑦的说法正确的是___________ (填序号)
a.原子的核电荷数为34
b.气态氢化物的稳定性⑤>⑦
c.能形成 价的氧化物,该氧化物既有氧化性又有还原性
价的氧化物,该氧化物既有氧化性又有还原性
(6)从原子结构角度解释元素⑥的非金属性强于元素⑧的原因___________ 。元素⑥和⑧化合形成的 属于卤素互化物,性质与
属于卤素互化物,性质与 相似。写出
相似。写出 与氢氧化钠溶液反应的化学方程式
与氢氧化钠溶液反应的化学方程式___________ 。
族 族 | IA | 0 | ||||||
1 | IIA | IIIA | IVA | VA | VIA | VIIA | ||
2 | ① | |||||||
3 | ② | ④ | ⑤ | ⑥ | ||||
4 | ③ | ⑦ | ⑧ | |||||
(1)元素①形成的温室气体(氧化物)的结构式为
(2)元素④⑤⑥的简单离子半径由大到小的顺序是
(3)用电子式表示元素③和元素⑥组成的化合物的形成过程
(4)用离子方程式表示元素④的最高价氧化物与元素②的最高价氧化物的水化物的反应
(5)下列对元素⑦的说法正确的是
a.原子的核电荷数为34
b.气态氢化物的稳定性⑤>⑦
c.能形成
 价的氧化物,该氧化物既有氧化性又有还原性
价的氧化物,该氧化物既有氧化性又有还原性(6)从原子结构角度解释元素⑥的非金属性强于元素⑧的原因
 属于卤素互化物,性质与
属于卤素互化物,性质与 相似。写出
相似。写出 与氢氧化钠溶液反应的化学方程式
与氢氧化钠溶液反应的化学方程式
您最近一年使用:0次
名校
9 . 食品添加剂可以改善食品的色香、味等品质,能更好地满足吃货们的心愿,丰富舌尖上的营养和美味。请回答下列问题:
I.磷酸氢钙CaHPO4是一种常用的营养强化剂和膨松剂,可以用于糕点、代乳品、婴幼儿配方食品等。
(1)Ca的结构示意图为_______ 。中子数为23的P,其核素符号为_______ 。
(2)下列说法中不正确的是_______。
II.短周期主族元素A、B、C、D、E、F都可能存在于某些食品添加剂中,且它们的原子序数依次增大,A的一种核素原子核内没有中子,B是地壳中含量最多的元素,C元素的原子在同周期主族元素中原子半径最大,D元素原子的最外层电子数与电子层数相等,B、E元素的原子最外层电子数相同。请回答下列问题:
(3)E元素在元素周期表中的位置为_______ 。
(4)由A、B、F三种元素组成的简单化合物的电子式为_______ 。
(5)B单质与C单质在加热条件下反应,所得产物中存在的化学键类型为_______ 。
(6)B、C、D对应简单离子的半径由小到大的顺序为_______ (用具体微粒符号表示)。
(7)D元素最高价氧化物与C元素最高价氧化物对应水化物的溶液反应的离子方程式为_______ 。
I.磷酸氢钙CaHPO4是一种常用的营养强化剂和膨松剂,可以用于糕点、代乳品、婴幼儿配方食品等。
(1)Ca的结构示意图为
(2)下列说法中不正确的是_______。
| A.热稳定性; H2O> NH3> PH3 | B.碱性: KOH >Ca(OH)2>Al(OH)3 |
| C.酸性: H3PO4>H2SiO3> H2CO3 | D.还原性: O2-<S2-<P3- |
II.短周期主族元素A、B、C、D、E、F都可能存在于某些食品添加剂中,且它们的原子序数依次增大,A的一种核素原子核内没有中子,B是地壳中含量最多的元素,C元素的原子在同周期主族元素中原子半径最大,D元素原子的最外层电子数与电子层数相等,B、E元素的原子最外层电子数相同。请回答下列问题:
(3)E元素在元素周期表中的位置为
(4)由A、B、F三种元素组成的简单化合物的电子式为
(5)B单质与C单质在加热条件下反应,所得产物中存在的化学键类型为
(6)B、C、D对应简单离子的半径由小到大的顺序为
(7)D元素最高价氧化物与C元素最高价氧化物对应水化物的溶液反应的离子方程式为
您最近一年使用:0次
名校
解题方法
10 . 下列性质的比较,强弱关系正确且能用元素周期律解释的是
A.酸性: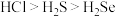 | B.碱性: |
C.还原性: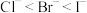 | D.沸点: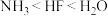 |
您最近一年使用:0次
2022-11-17更新
|
258次组卷
|
3卷引用:考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山东省泰安市2022-2023学年高三上学期11月期中化学试题宁夏吴忠市吴忠中学2023-2024学年高二下学期第一次月考化学试卷



