1 . 短周期元素A、B、C、D、E在元素周期表中的相对位置如表所示,其中E的单质在标况下是一种气体,下列说法中正确的是( )
| A | C | ||
| B | D | E |
| A.原子半径大小:C>A |
| B.E单质具有较强氧化性,参加反应时,只作氧化剂 |
| C. B与C形成的化合物是常见的半导体材料 |
| D.C与D可以形成两种常见的化合物 |
您最近一年使用:0次
名校
2 . X、Y、Z、W、R属于短周期主族元素。X的最高价氧化物的水化物的碱性是短周期主族元素中最强的,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1。下列叙述错误的是( )
| A.X与Y形成的两种化合物中阴、阳离子的个数比均为1:2 |
| B.Z、W、R最高价氧化物对应水化物的酸性强弱:R>W>Z |
| C.Y简单的氢化物比R简单的氢化物稳定,熔沸点高 |
| D.RY2、WY2通入Ba(NO3)2溶液中均无白色沉淀生成 |
您最近一年使用:0次
3 . A、B、C、D、E、F是短周期主族元素,且原子序数依次增大。在短周期中A元素原子半径最小,D元素原子半径最大,B的简单氢化物的水溶液呈碱性,C、E同主族,形成的化合物为 、
、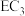 。回答下列问题:
。回答下列问题:
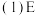 在元素周期表中的位置为
在元素周期表中的位置为_______ 。
 比较B与C简单氢化物的热稳定性:
比较B与C简单氢化物的热稳定性:_____ >____ 。 填化学式
填化学式
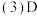 ,C两元素组成的化合物
,C两元素组成的化合物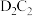 与水反应的化学方程式为
与水反应的化学方程式为__________
 写出实验室制取BA3的化学方程式
写出实验室制取BA3的化学方程式__________
(5)实验室检验BA3的方法_________
(6)D、F的最高价氧化物的水化物酸性较强的是_________ (用化学式表示)
(7)用电子式表示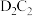
_________ 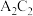
_____________
(8)下列说法正确的是__________
A.元素F形成的单质比元素E形成的单质的熔点低
B.F和E两元素的简单氢化物受热分解,前者的分解温度高
C. 通入到
通入到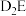 的溶液中出现浑浊
的溶液中出现浑浊
D.F氢化物的酸性比E氢化物的酸性强
 、
、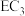 。回答下列问题:
。回答下列问题: 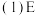 在元素周期表中的位置为
在元素周期表中的位置为 比较B与C简单氢化物的热稳定性:
比较B与C简单氢化物的热稳定性: 填化学式
填化学式
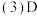 ,C两元素组成的化合物
,C两元素组成的化合物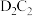 与水反应的化学方程式为
与水反应的化学方程式为 写出实验室制取BA3的化学方程式
写出实验室制取BA3的化学方程式(5)实验室检验BA3的方法
(6)D、F的最高价氧化物的水化物酸性较强的是
(7)用电子式表示
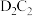
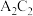
(8)下列说法正确的是
A.元素F形成的单质比元素E形成的单质的熔点低
B.F和E两元素的简单氢化物受热分解,前者的分解温度高
C.
 通入到
通入到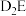 的溶液中出现浑浊
的溶液中出现浑浊D.F氢化物的酸性比E氢化物的酸性强
您最近一年使用:0次
4 . 表为元素周期表的一部分,表中a~f代表六种短周期主族元素。完成下列填空:
(1)六种元素中,原子半径最大的是_________ (填元素编号) 。d、e、f三种元素的原子结构上的相同点是________________________________ 。
(2)若a的气态氢化物的水溶液呈碱性,则a的气态氢化物的电子式是___________ ;六种元素中,最高价氧化物对应水化物的酸性最强的是_________ (填元素符号)。
(3)若f元素的原子L层电子数比M层电子数多1个,则e元素的非金属性比f元素的非金属性_________ (选填“强”、“弱’’),能说明这一事实的化学方程式是____________________ (任写一个)。
(4)若b为非金属元素,则以下推断正确的是_________ (选填编号)。
①a一定是金属元素 ②d一定是金属元素 ③f一定是非金属元素
| a | b | c |
| d | e | f |
(1)六种元素中,原子半径最大的是
(2)若a的气态氢化物的水溶液呈碱性,则a的气态氢化物的电子式是
(3)若f元素的原子L层电子数比M层电子数多1个,则e元素的非金属性比f元素的非金属性
(4)若b为非金属元素,则以下推断正确的是
①a一定是金属元素 ②d一定是金属元素 ③f一定是非金属元素
您最近一年使用:0次
名校
5 . 已知a、b、d、e、 f、g、 h为原子序数依次增大的六种短周期主族元素, 非金属元素a最外层电子数与其周期数相同,b原子的最外层电子数是其所在周期数的2倍。d的一种单质可杀菌消毒,g的最高正价与最低负价代数和为4, f的最高价氧化物可分别与e和h的最高价氧化物的水化物反应,a单质在h单质中燃烧,产物溶于水得到一种强酸甲。请用化学用语回答下列问题:
(1)f在元素周期表中的位置___ 画出与h同族的第四周期元素的原子结构示意图____________ 。
(2)d、e、f、h的简单离子的半径由大到小的顺序_________ 。
(3)下列说法正确的是 。
(4)设计一个简单的实验证明d和g的非金属性强弱: _________ (用化学方程式表示)。
(5)为降低水源中NO 对人体的危害,可在强碱性条件下用f的单质将溶液中的NO
对人体的危害,可在强碱性条件下用f的单质将溶液中的NO 还原为N2,该反应的离子方程式为
还原为N2,该反应的离子方程式为______________ 。
(6)将e和f单质各1mol投入足量水中,充分反应后,所得溶液体积为500mL,则该过程可得标况下气体体积_______ L。最终获得溶液的物质的量浓度为_____ mol∙L−1。
(1)f在元素周期表中的位置
(2)d、e、f、h的简单离子的半径由大到小的顺序
(3)下列说法正确的是 。
| A.氢化物的稳定性d>b |
| B.含氧酸的酸性h>g>b>f |
| C.bg2中b为+4价;g为−2价可说明g的非金属性强于b |
| D.g阴离子能与Fe3+反应而h的阴离子不能,可说明g的非金属性弱于h |
(5)为降低水源中NO
 对人体的危害,可在强碱性条件下用f的单质将溶液中的NO
对人体的危害,可在强碱性条件下用f的单质将溶液中的NO 还原为N2,该反应的离子方程式为
还原为N2,该反应的离子方程式为(6)将e和f单质各1mol投入足量水中,充分反应后,所得溶液体积为500mL,则该过程可得标况下气体体积
您最近一年使用:0次
18-19高二上·上海·期末
名校
6 . 下表为元素周期表的局部X、Y、Z、W均为短周期元素,其原子序数之和为47:
(1)X、Y、Z、W的元素符号依次为_______ 、________ 、_______ 、__________ (以下所有问题均用元素符号回答);
(2)X和Y的化合物中的两种微粒均达到了8电子稳定结构,该化合物的电子式为_____ ;将该化合物的固体溶于足量W的气态氢化物水溶液中,生成两种盐该反应的离子方程式为______________ ,生成的两种盐的电子式为__________ 、_____________ ;
(3)Z的氧化物为_________ (填酸性、碱性、两性、不成盐)氧化物,Y、Z、W的最高价氧化物对应的水化物两两之间反应的化学方程式为:
__________________________________ ;
___________________________ ;
________________________ .
| X | |||||
| Y | Z | W |
(2)X和Y的化合物中的两种微粒均达到了8电子稳定结构,该化合物的电子式为
(3)Z的氧化物为



您最近一年使用:0次
名校
解题方法
7 . A、B、C、D、E、F是短周期主族元素,且原子序数依次增大。在短周期中A元素原子半径最小,D元素原子半径最大,B的简单氢化物的水溶液呈碱性,C、E同主族,形成的化合物为EC2、EC3。回答下列问题:
(1)E在元素周期表中的位置为_____________________________ 。
(2)比较B与C简单氢化物的热稳定性:_____ > 。(填化学式)
(3)D,C两元素组成的化合物D2C2的电子式为_____________________ ,D2C2与水反应的化学方程式为 ______________________________________________ 。
(4)下列事实能说明元素F的非金属性比元素E的非金属性强的是______ 。
A.元素F形成的单质比元素E形成的单质的熔点低
B.F和E两元素的简单氢化物受热分解,前者的分解温度高
C.F2通入到D2E的溶液中出现浑浊
D.F氢化物的酸性比E氢化物的酸性强
(1)E在元素周期表中的位置为
(2)比较B与C简单氢化物的热稳定性:
(3)D,C两元素组成的化合物D2C2的电子式为
(4)下列事实能说明元素F的非金属性比元素E的非金属性强的是
A.元素F形成的单质比元素E形成的单质的熔点低
B.F和E两元素的简单氢化物受热分解,前者的分解温度高
C.F2通入到D2E的溶液中出现浑浊
D.F氢化物的酸性比E氢化物的酸性强
您最近一年使用:0次
2018-10-29更新
|
367次组卷
|
3卷引用:江西省南昌市八一中学2019-2020学年高一下学期期末考试化学试题
解题方法
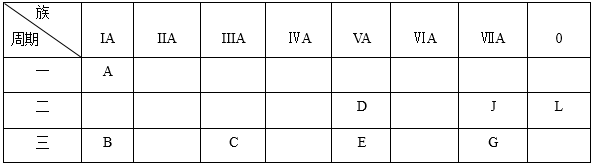
8 . 下列是元素周期表的一部分:
根据以上元素在周期表中的位置,用化学式 填写空白。
(1)非金属性最强的元素是_________ ;化学性质最不活泼的是_________ ;除L外,原子半径最大的是_________ ;A与D形成的10电子离子是_________ 。
(2)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、D、E四种元素的最高价氧化物对应水化物的化学式 排列成序是__________________ ;
(3)B元素可以形成两种氧化物,分别写出两种氧化物的电子式_________ ,_________ 。
(4)B、C、G、J四种元素的简单离子的半径由大到小的顺序为_________ 。

根据以上元素在周期表中的位置,用
(1)非金属性最强的元素是
(2)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、D、E四种元素的最高价氧化物对应水化物的
(3)B元素可以形成两种氧化物,分别写出两种氧化物的电子式
(4)B、C、G、J四种元素的简单离子的半径由大到小的顺序为
您最近一年使用:0次
9-10高一下·广东深圳·期末
9 . a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:

其中b的离子半径大于e的离子半径;d是由极性键构成的四原子分子;试写出:
(1)写出下列粒子的电子式:
①c__________ ;②d__________ ;③e__________ ;④a__________ 。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:__________ >__________ (用化学式表示)。
(3)用电子式表示b元素与氧形成的化合物b2O的形成过程:________________ 。

其中b的离子半径大于e的离子半径;d是由极性键构成的四原子分子;试写出:
(1)写出下列粒子的电子式:
①c
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:
(3)用电子式表示b元素与氧形成的化合物b2O的形成过程:
您最近一年使用:0次
解题方法
10 . X、Y、Z 为不同短周期非金属元素的气态单质。在一定条件下能发生如下反应:
Y+X → 甲(g),Y+Z → 乙(g)。甲、乙可化合生成离子化合物,甲的相对分子质量小于乙。
(1)X 的电子式是__________ 。
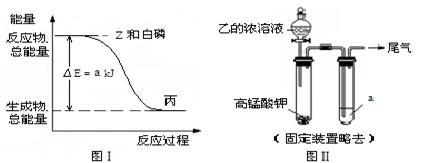
(2)白磷(P4)在 Z 气体中燃烧可生成液态丙分子,也可生成固态丁分子。已知丙分子中各原子最外层均是 8 电子结构,丙的结构式是__________ 。 白磷固体和 Z 气体反应,生成 1 mol 液态丙时,能量变化如图Ⅰ所示,写出该反应的热化学方程式: _____________________________ 。已知 1 mol 白磷固体和 Z 气体反应,生成固态丁时,放热 b kJ,则 1 mol 固态丁转化为液态丙时的反应热△H =____________________ 。
(3)某同学拟用图Ⅱ所示装置证明氧化性Z>I2,已知高锰酸钾与乙的浓溶液反应生成Z,则 a____ 的水溶液。若仅将 a 换为甲的浓溶液,实验时会产生大量白烟并有气体单质生成,该反应的化学方程式是____________________ 。
(4)向一定浓度的 BaCl2溶液中通入 SO2气体,未见沉淀生成,若在通入 SO2气体的同时加入由 X、 Y、Z 中的一种或几种元素组成的某纯净物,即可生成白色沉淀,该纯净物可能是__________ 。
Y+X → 甲(g),Y+Z → 乙(g)。甲、乙可化合生成离子化合物,甲的相对分子质量小于乙。

(1)X 的电子式是
(2)白磷(P4)在 Z 气体中燃烧可生成液态丙分子,也可生成固态丁分子。已知丙分子中各原子最外层均是 8 电子结构,丙的结构式是
(3)某同学拟用图Ⅱ所示装置证明氧化性Z>I2,已知高锰酸钾与乙的浓溶液反应生成Z,则 a
(4)向一定浓度的 BaCl2溶液中通入 SO2气体,未见沉淀生成,若在通入 SO2气体的同时加入由 X、 Y、Z 中的一种或几种元素组成的某纯净物,即可生成白色沉淀,该纯净物可能是
您最近一年使用:0次



