名校
解题方法
1 . 某反应体系中反应物与生成物有:K2SO4、CaSO4、MnSO4、CaC2O4、KMnO4、H2SO4、H2O和一种未知气体X。根据上述信息回答下列问题:
(1)S原子核外电子共占据_______ 个能级,能量最高电子排布式为_______ 。
(2)下列说法正确的是_______。
(3)充填气象观测气球时,可用CaH2与H2O反应制H2,反应的化学方程式为_______ 。CaH2、BaH2属于_______ 晶体,熔点CaH2_______ BaH2(填>、<、=),从物质结构角度解释原因_______ 。
(4)下列事实能说明C、S两元素非金属性强弱的是_______。
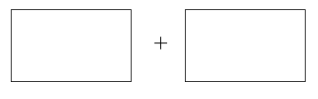
(5)已知CaC2O4在反应中失去电子,则该反应的氧化剂是_______ ,在标准状况下生成11.2L X时,有0.5mol电子转移,共消耗0.25mol CaC2O4,X的化学式为_______ 。将氧化剂和还原剂的化学式及配平后的系数填入下列方框中,并标出电子转移的方向和数目:_______ 。
(1)S原子核外电子共占据
(2)下列说法正确的是_______。
| A.CaH2和CaO2中,阴阳离子个数比相同 |
| B.O原子与S原子核外电子的伸展方向都是4种 |
| C.H2SO4在该反应中的作用和实验室与亚硫酸钠反应制SO2时相同 |
| D.原子核外电子的能级数由少到多的顺序为:H<C<O<S |
(4)下列事实能说明C、S两元素非金属性强弱的是_______。
| A.同浓度Na2CO3和Na2SO4的pH | B.浓硫酸和碳酸的氧化性 |
| C.CH4和H2S的稳定性 | D.CS2中共用电子对的偏移 |

您最近半年使用:0次
名校
解题方法
2 . 无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在科技发展中发挥着重要的作用。完成下列填空:
I.新型材料α-Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等。
(1)自然界一共存在四种稳定的铁原子,计算铁元素的近似相对原子质量的计算式为:54×a1%+56×a2%+57×a3%+58×a4%,其中a1%是指_______ ,58是指_______ 。
(2)已知铁位于周期表第四周期,与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为_______ 。
II.硅元素是无机非金属材料的主角。
(3)硅在周期表中的位置是_______ ,SiH4的空间构型为_______ 。
III.Nierite是一种高熔点高硬度的陶瓷材料,摩尔质量为140 g/mol,硅元素的质量分数为60%。已知1 mol NH3与足量的化合物T充分反应后可得到35 g Nierite与3 mol HCl气体。
(4)Nierite的化学式为_______ ,T的电子式为_______ 。
(5)碳化硅(SiC)单晶是目前技术最成熟的第三代半导体材料, 下列能说明碳的非金属性强于硅的反应(或反应组)是_______ (选填编号)
a.SiO + 2CO2 + 2H2O = H2SiO3 + 2HCO
+ 2CO2 + 2H2O = H2SiO3 + 2HCO
b.
c.SiH4 Si+2H2↑;CH4
Si+2H2↑;CH4 C+2H2↑
C+2H2↑
d.Si+O2 SiO2;C+O2
SiO2;C+O2 CO2
CO2
I.新型材料α-Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等。
(1)自然界一共存在四种稳定的铁原子,计算铁元素的近似相对原子质量的计算式为:54×a1%+56×a2%+57×a3%+58×a4%,其中a1%是指
(2)已知铁位于周期表第四周期,与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为
II.硅元素是无机非金属材料的主角。
(3)硅在周期表中的位置是
III.Nierite是一种高熔点高硬度的陶瓷材料,摩尔质量为140 g/mol,硅元素的质量分数为60%。已知1 mol NH3与足量的化合物T充分反应后可得到35 g Nierite与3 mol HCl气体。
(4)Nierite的化学式为
(5)碳化硅(SiC)单晶是目前技术最成熟的第三代半导体材料, 下列能说明碳的非金属性强于硅的反应(或反应组)是
a.SiO
 + 2CO2 + 2H2O = H2SiO3 + 2HCO
+ 2CO2 + 2H2O = H2SiO3 + 2HCO
b.

c.SiH4
 Si+2H2↑;CH4
Si+2H2↑;CH4 C+2H2↑
C+2H2↑d.Si+O2
 SiO2;C+O2
SiO2;C+O2 CO2
CO2
您最近半年使用:0次
填空题
|
适中(0.65)
|
3 . 现有A、B、C、D、E、F、G七种短周期主族元素,其原子序数依次增大。已知A、D位于同一主族,D是短周期中原子半径最大的。B、E最外层电子数是最内层电子数的2倍。C、F的最外层电子数相等,且C、F的原子序数之和为A、D原子序数之和的两倍。
(1)A、C、D、F形成的简单离子半径由大到小的顺序是___________ (用元素符号填写)。
(2)B、E、F、G最高价氧化物对应的水化物酸性最强的是___________ (用化学式填写)。
(3)下列事实能说明G元素的非金属性比F元素的非金属性强的是(填序号)______
A.G单质与Na2S溶液反应溶液变浑浊
B.F的氢化物的酸性比G的氢化物酸性弱
C.G和F两元素的简单氢化物受热分解,前者的分解温度高
(4)A、C、D、F四种元素形成的化合物M和N在溶液中相互反应的离子方程式是___________ 。
(1)A、C、D、F形成的简单离子半径由大到小的顺序是
(2)B、E、F、G最高价氧化物对应的水化物酸性最强的是
(3)下列事实能说明G元素的非金属性比F元素的非金属性强的是(填序号)
A.G单质与Na2S溶液反应溶液变浑浊
B.F的氢化物的酸性比G的氢化物酸性弱
C.G和F两元素的简单氢化物受热分解,前者的分解温度高
(4)A、C、D、F四种元素形成的化合物M和N在溶液中相互反应的离子方程式是
您最近半年使用:0次
名校
4 . 下列为元素周期表中的一部分,用化学式或元素符号回答下列问题。
(1)11种元素中,化学性质最不活泼的是___________ ,原子半径最小的是___________ 。
(2)①②⑤中最高价氧化物的水化物,碱性最强的是___________ 。
(3)②③④中形成的简单离子半径由大到小的顺序是___________ 。
(4)元素⑦的氢化物电子式为___________ ,该氢化物常温下和元素②的单质反应的离子方程式是___________ 。
(5)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为___________ 。
(6)⑧⑨⑪三种元素形成的气态氢化物最稳定的是___________ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)①②⑤中最高价氧化物的水化物,碱性最强的是
(3)②③④中形成的简单离子半径由大到小的顺序是
(4)元素⑦的氢化物电子式为
(5)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为
(6)⑧⑨⑪三种元素形成的气态氢化物最稳定的是
您最近半年使用:0次
2021-06-16更新
|
214次组卷
|
3卷引用:江西省石城中学2020-2021学年高一下学期第二次月考化学试题
20-21高一·浙江·阶段练习
解题方法
5 . 氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。已知甲乙均是由短周期主族元素构成的离子化合物。将4.80g甲加热至完全分解,只得到一种常见金属单质和2.24L的H2(已折算成标准状况)。化合物乙在加热条件下分解除得到H2外还生成另一种气体丙,丙在标准状况下的密度为0.76g·L-1。化合物甲、乙与水反应均能放出H2,同时生成的溶液均能使紫色石蕊变蓝。请回答下列问题:
(1)化合物甲的化学式_______ ;化合物乙的电子式_______
(2)化合物甲中金属元素在周期表中的位置_______ ;简述检验该金属离子的实验步骤_______ ;化合物乙中存在的化学键为_______
(3)写出下列化学方程式:
①化合物甲与水反应_______ ;
②化合物乙溶解在盐酸中_______ 。
(1)化合物甲的化学式
(2)化合物甲中金属元素在周期表中的位置
(3)写出下列化学方程式:
①化合物甲与水反应
②化合物乙溶解在盐酸中
您最近半年使用:0次
20-21高二·全国·课时练习
6 . A、B、C都是短周期元素。B、C的离子核外电子排布相同,组成B2C型离子化合物。A、B元素的化合价相同,A、C元素组成的化合物中,A占11.1%,在标准状况下,0.04 mol B元素的单质与水完全反应放出448 mL H2。
(1)写出各元素的符号:A是______ ,B是______ ,C是______ 。
(2)写出A元素组成的单质的电子式:______ ,分子中的化学键有______ 。
(3)写出A和C组成的化合物的电子式:______ 。
(4)A、C还可以形成另一种化合物,该化合物是一种氧化剂,其溶液有弱酸性,试写出其电子式:______ 。分子中的化学键有______ 共价键和______ 共价键。
(1)写出各元素的符号:A是
(2)写出A元素组成的单质的电子式:
(3)写出A和C组成的化合物的电子式:
(4)A、C还可以形成另一种化合物,该化合物是一种氧化剂,其溶液有弱酸性,试写出其电子式:
您最近半年使用:0次
7 . 短周期元素在周期表中的位置如表所示。请按要求回答下列问题:
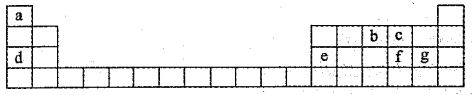
(1)元素f在周期表中的位置是___ 。
(2)上表中七种元素分别形成的单核离子中离子半径最大的是___ (填离子符号)。
(3)由a、b、g形成的常见化合物的电子式为___ ,该化合物属于___ 化合物(填“离”或“共价”)。
(4)写出e、g形成的化合物与过量d元素形成的最高价氧化物对应的水化物相互反应的离子方程式:___ 。
(5)下列事实能说明g元素的非金属性比f元素的非金属性强的是___ 。
A.将g的单质与f的气态氢化物的水溶液反应,生成淡黄色沉淀‘
B.g元素形成的简单氢化物的酸性比f元素形成的简单氢化物的酸性强
C.f与Fe化合时产物中Fe为+2价,g与Fe化合时产物中Fe为+3价
D.g与氢气化合比f与氢气化合更容易
(6)a分别与b、c形成的二元化合物中,所含电子数为18的两种分子之间可发生氧化还原反应生成b元素的单质,其反应的化学方程式为___ 。

(1)元素f在周期表中的位置是
(2)上表中七种元素分别形成的单核离子中离子半径最大的是
(3)由a、b、g形成的常见化合物的电子式为
(4)写出e、g形成的化合物与过量d元素形成的最高价氧化物对应的水化物相互反应的离子方程式:
(5)下列事实能说明g元素的非金属性比f元素的非金属性强的是
A.将g的单质与f的气态氢化物的水溶液反应,生成淡黄色沉淀‘
B.g元素形成的简单氢化物的酸性比f元素形成的简单氢化物的酸性强
C.f与Fe化合时产物中Fe为+2价,g与Fe化合时产物中Fe为+3价
D.g与氢气化合比f与氢气化合更容易
(6)a分别与b、c形成的二元化合物中,所含电子数为18的两种分子之间可发生氧化还原反应生成b元素的单质,其反应的化学方程式为
您最近半年使用:0次
8 . 有A、B、C、D、E五种元素,其中A、B、C位于同周期,A原子最外层p轨道电子数等于次外层的电子总数,B元素可分别与A、C、D、E生成 型化合物,已知在
型化合物,已知在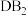 和
和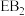 中,D与B的质量比为7:8,E与B的质量比为1:1。根据以上条件,回答下列问题:
中,D与B的质量比为7:8,E与B的质量比为1:1。根据以上条件,回答下列问题:
(1)画出C的原子结构示意图:______ 。
(2)写出D原子的价电子排布式:______ 。
(3)写出A元素的单质在B中完全燃烧的化学方程式:____________ 。
(4)指出E元素在周期表中的位置:______ 。
(5)A、B、C三种元素的第一电离能由大到小的顺序为______ (用元素符号表示)。
(6)比较元素D和E电负性的大小:______ (用元素符号表示)。
 型化合物,已知在
型化合物,已知在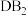 和
和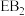 中,D与B的质量比为7:8,E与B的质量比为1:1。根据以上条件,回答下列问题:
中,D与B的质量比为7:8,E与B的质量比为1:1。根据以上条件,回答下列问题:(1)画出C的原子结构示意图:
(2)写出D原子的价电子排布式:
(3)写出A元素的单质在B中完全燃烧的化学方程式:
(4)指出E元素在周期表中的位置:
(5)A、B、C三种元素的第一电离能由大到小的顺序为
(6)比较元素D和E电负性的大小:
您最近半年使用:0次
解题方法
9 . 表中列出了部分短周期元素在元素周期表中的位置。
请按要求回答下列问题:
(1)X、E中的非金属性较强的是_______ (填元素符号)。
(2)上述元素中,金属性最强的元素是_______ (填元素符号);最高价氧化物对应水化物的酸性最强的是_______ (填化学式)。
(3)M、J的最高价氧化物对应的水化物之间反应的离子方程式为_______ 。
(4)H、J、M元素的离子半径由大到小的顺序是_______ (用离子符号表示)。
族  周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | X | E | H | |||||
| 3 | J | M | Z |
请按要求回答下列问题:
(1)X、E中的非金属性较强的是
(2)上述元素中,金属性最强的元素是
(3)M、J的最高价氧化物对应的水化物之间反应的离子方程式为
(4)H、J、M元素的离子半径由大到小的顺序是
您最近半年使用:0次
名校
10 . 下表是元素周期表的一部分,表中所列的数字分别代表某一种元素。
请完成下列空白。
(1)属于卤族元素的有_______ (填元素符号)。
(2)②在⑥的单质中燃烧产物的电子式为_______ ,其中所含化学键类型为_______ 。
(3)能证明元素⑧比⑨的非金属性强的实验事实有(用离子方程式表示):_______ 。
(4)元素⑥的一种中子数为10的核素的符号为_______
(5)元素⑤的单质与NaOH溶液反应的化学方程式为_______
| ⅠA | 0 | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ⑥ | |||||||
| 3 | ② | ④ | ⑤ | ⑦ | ⑧ | |||
| 4 | ③ | ⑨ | ||||||
请完成下列空白。
(1)属于卤族元素的有
(2)②在⑥的单质中燃烧产物的电子式为
(3)能证明元素⑧比⑨的非金属性强的实验事实有(用离子方程式表示):
(4)元素⑥的一种中子数为10的核素的符号为
(5)元素⑤的单质与NaOH溶液反应的化学方程式为
您最近半年使用:0次



