解题方法
1 . 分子TCCA(结构式如图)是一种高效消毒漂白剂。W、X、Y、Z处于两个不同短周期且原子序数依次递增的主族元素,Y的最外层电子数是电子层数的3倍。下列叙述正确的是
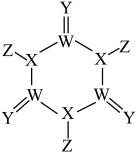

| A.元素Y与W形成的化合物一定含有离子键 |
| B.元素Z与X之间形成了非极性键 |
| C.该分子中所有原子最外层均满足8电子结构,且无孤电子对存在 |
D.该分子可发生水解反应生成物质 ,该水解液具有漂白功能 ,该水解液具有漂白功能 |
您最近半年使用:0次
2 . 两个或多个配体与同一金属离子通过螯合配位成环而形成的配合物为螯合物,一种 与EDTA形成的螯合物的结构如图所示。下列说法错误的是
与EDTA形成的螯合物的结构如图所示。下列说法错误的是

 与EDTA形成的螯合物的结构如图所示。下列说法错误的是
与EDTA形成的螯合物的结构如图所示。下列说法错误的是 
| A.1个该配合物中通过螯合作用形成的配位键有6个 |
| B.该物质中提供孤电子对的原子为N、O |
| C.该物质中所有的非金属元素都分布在元素周期表的p区 |
D.基态 中最高能级的单电子数为2 中最高能级的单电子数为2 |
您最近半年使用:0次
解题方法
3 . 有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大。
①A元素最外层电子数是次外层电子数的2倍。
②B的阴离子和C的阳离子与氖原子的电子层结构相同。
③在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移。
④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体。
⑤D的气态氢化物有臭鸡蛋气味。请写出:
(1)A元素的最高价氧化物的结构式_______
(2)C元素在周期表中的位置_______
(3)B单质与C单质在点燃时反应的生成物中所含化学键类型有_______
(4)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为_______
(5)元素D与元素E相比,非金属性较弱的是_______ (用元素符号表示),下列表述中能证明这一事实的是_______ (填选项序号)。
a.常温下D的单质和E的单质状态不同
b.E的氢化物水溶液酸性比D的氢化物水溶液酸性强
c.一定条件下D和E的单质都能与钠反应
d.D的最高价含氧酸酸性弱于E的最高价含氧酸
e.D的单质能与E的氢化物反应生成E单质。
(6)C分别与B、E形成的简单化合物中,熔沸点较高的是_______
①A元素最外层电子数是次外层电子数的2倍。
②B的阴离子和C的阳离子与氖原子的电子层结构相同。
③在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移。
④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体。
⑤D的气态氢化物有臭鸡蛋气味。请写出:
(1)A元素的最高价氧化物的结构式
(2)C元素在周期表中的位置
(3)B单质与C单质在点燃时反应的生成物中所含化学键类型有
(4)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为
(5)元素D与元素E相比,非金属性较弱的是
a.常温下D的单质和E的单质状态不同
b.E的氢化物水溶液酸性比D的氢化物水溶液酸性强
c.一定条件下D和E的单质都能与钠反应
d.D的最高价含氧酸酸性弱于E的最高价含氧酸
e.D的单质能与E的氢化物反应生成E单质。
(6)C分别与B、E形成的简单化合物中,熔沸点较高的是
您最近半年使用:0次
名校
解题方法
4 . 某反应体系中反应物与生成物有:K2SO4、CaSO4、MnSO4、CaC2O4、KMnO4、H2SO4、H2O和一种未知气体X。根据上述信息回答下列问题:
(1)S原子核外电子共占据_______ 个能级,能量最高电子排布式为_______ 。
(2)下列说法正确的是_______。
(3)充填气象观测气球时,可用CaH2与H2O反应制H2,反应的化学方程式为_______ 。CaH2、BaH2属于_______ 晶体,熔点CaH2_______ BaH2(填>、<、=),从物质结构角度解释原因_______ 。
(4)下列事实能说明C、S两元素非金属性强弱的是_______。
(5)已知CaC2O4在反应中失去电子,则该反应的氧化剂是_______ ,在标准状况下生成11.2L X时,有0.5mol电子转移,共消耗0.25mol CaC2O4,X的化学式为_______ 。将氧化剂和还原剂的化学式及配平后的系数填入下列方框中,并标出电子转移的方向和数目:_______ 。
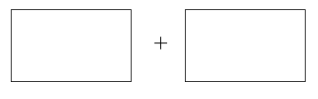
(1)S原子核外电子共占据
(2)下列说法正确的是_______。
| A.CaH2和CaO2中,阴阳离子个数比相同 |
| B.O原子与S原子核外电子的伸展方向都是4种 |
| C.H2SO4在该反应中的作用和实验室与亚硫酸钠反应制SO2时相同 |
| D.原子核外电子的能级数由少到多的顺序为:H<C<O<S |
(4)下列事实能说明C、S两元素非金属性强弱的是_______。
| A.同浓度Na2CO3和Na2SO4的pH | B.浓硫酸和碳酸的氧化性 |
| C.CH4和H2S的稳定性 | D.CS2中共用电子对的偏移 |

您最近半年使用:0次
名校
解题方法
5 . A,B,C,D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型:C,D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是_______ (填元素符号)
(2)单质A有两种同素异形体,其中沸点高的是_______ (填分子式),原因是_______ ;
(3)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为_______ ,中心原子的杂化轨道类型为_______ 。
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_______ ;晶胞中A原子的配位数为_______ ;列式计算晶体F的密度(g·cm-3)_______ 。

(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为

您最近半年使用:0次
名校
解题方法
6 . 无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在科技发展中发挥着重要的作用。完成下列填空:
I.新型材料α-Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等。
(1)自然界一共存在四种稳定的铁原子,计算铁元素的近似相对原子质量的计算式为:54×a1%+56×a2%+57×a3%+58×a4%,其中a1%是指_______ ,58是指_______ 。
(2)已知铁位于周期表第四周期,与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为_______ 。
II.硅元素是无机非金属材料的主角。
(3)硅在周期表中的位置是_______ ,SiH4的空间构型为_______ 。
III.Nierite是一种高熔点高硬度的陶瓷材料,摩尔质量为140 g/mol,硅元素的质量分数为60%。已知1 mol NH3与足量的化合物T充分反应后可得到35 g Nierite与3 mol HCl气体。
(4)Nierite的化学式为_______ ,T的电子式为_______ 。
(5)碳化硅(SiC)单晶是目前技术最成熟的第三代半导体材料, 下列能说明碳的非金属性强于硅的反应(或反应组)是_______ (选填编号)
a.SiO + 2CO2 + 2H2O = H2SiO3 + 2HCO
+ 2CO2 + 2H2O = H2SiO3 + 2HCO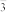
b.
c.SiH4 Si+2H2↑;CH4
Si+2H2↑;CH4 C+2H2↑
C+2H2↑
d.Si+O2 SiO2;C+O2
SiO2;C+O2 CO2
CO2
I.新型材料α-Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等。
(1)自然界一共存在四种稳定的铁原子,计算铁元素的近似相对原子质量的计算式为:54×a1%+56×a2%+57×a3%+58×a4%,其中a1%是指
(2)已知铁位于周期表第四周期,与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为
II.硅元素是无机非金属材料的主角。
(3)硅在周期表中的位置是
III.Nierite是一种高熔点高硬度的陶瓷材料,摩尔质量为140 g/mol,硅元素的质量分数为60%。已知1 mol NH3与足量的化合物T充分反应后可得到35 g Nierite与3 mol HCl气体。
(4)Nierite的化学式为
(5)碳化硅(SiC)单晶是目前技术最成熟的第三代半导体材料, 下列能说明碳的非金属性强于硅的反应(或反应组)是
a.SiO
 + 2CO2 + 2H2O = H2SiO3 + 2HCO
+ 2CO2 + 2H2O = H2SiO3 + 2HCO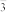
b.

c.SiH4
 Si+2H2↑;CH4
Si+2H2↑;CH4 C+2H2↑
C+2H2↑d.Si+O2
 SiO2;C+O2
SiO2;C+O2 CO2
CO2
您最近半年使用:0次
名校
解题方法
7 . 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是
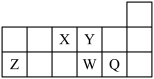

| A.离子Y2-和Z3+的核外电子数和电子层数都不相同 |
| B.元素X与元素Z的最高正化合价之和的数值等于8 |
| C.元素W的最高价氧化物对应的水化物酸性比Q的强X |
D.W元素基态原子最外层电子的电子排布图为 |
您最近半年使用:0次
2022-10-27更新
|
652次组卷
|
4卷引用:河北省石家庄市正中实验中学东校区2022-2023学年高二上学期10月月考化学试题
河北省石家庄市正中实验中学东校区2022-2023学年高二上学期10月月考化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第1章02基础练安徽省合肥市第七中学2022-2023学年高二下学期期中检测化学试题(已下线)第一章 原子结构与性质(A卷)
解题方法
8 . 短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素。下列说法正确的是
A.第一电离能: |
B.简单离子半径: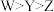 |
C.Z与W形成的化合物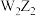 和 和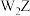 中,阳离子与阴离子个数之比均为2∶1 中,阳离子与阴离子个数之比均为2∶1 |
| D.X、Y、Z形成的化合物中不可能含离子键 |
您最近半年使用:0次
名校
9 . 短周期元素W、X、Y、Z的原子序数依次增加。甲、乙、丙是由这些元素组成的二元化合物,0.1mol/L丙溶液的H+物质的量浓度为0.1mol/L,丁是元素Z的单质,为黄绿色气体,戊是难溶于水的混合物,己的水溶液具有漂白性。上述物质的转化关系如图所示。下列说法正确的是
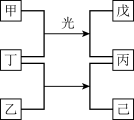

| A.甲可能是丁烷,常温常压下呈气态 | B.原子半径的大小:W<X<Y<Z |
| C.氧化物对应水化物的酸性:Z>X | D.己的结构式:W-Z-Y |
您最近半年使用:0次
名校
10 . 一种用于合成治疗免疫疾病药的物质,其结构如图所示,其中X、Y、Z、O、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述错误的是


| A.Y的氢化物的熔点一定低于Z的氢化物的熔点 |
| B.该物质中Y、Z、Q均满足8电子构型 |
| C.原子半径:W>Q>Y>Z>X |
| D.WX与Q的最高价氧化物对应水化物的稀溶液反应有无色无味气体产生 |
您最近半年使用:0次



