1 . 完成下列问题
(1)氨气极易溶于水,原因是___________
(2) 的VSEPR理想模型名称为
的VSEPR理想模型名称为___________ ,离子空间结构名称为___________ ,中心原子有___________ 个杂化轨道;
(3) 中存在的化学键类型有
中存在的化学键类型有___________
①离子键 ②极性共价键 ③非极性共价键 ④氢键
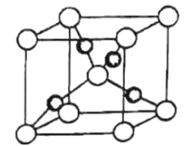
(4)一个 晶胞(见图)中,Cu原子的数目为
晶胞(见图)中,Cu原子的数目为___________ 。
(1)氨气极易溶于水,原因是
(2)
 的VSEPR理想模型名称为
的VSEPR理想模型名称为(3)
 中存在的化学键类型有
中存在的化学键类型有①离子键 ②极性共价键 ③非极性共价键 ④氢键
(4)一个
 晶胞(见图)中,Cu原子的数目为
晶胞(见图)中,Cu原子的数目为
您最近一年使用:0次
2 . Ⅰ.食品添加剂能改善食物色香味、延长保质期、调整营养结构。我国对食品添加剂的品种、适用范围、最大用量及残留量都制定了严格的标准。
(1)下列关天食品添加剂的说法正确的是________ 。
A制作豆腐时,加入石膏做凝固剂
B.制作糕点时,加入小苏打做防腐剂
C.生产加碘食盐时,加入碘单质作补碘剂
Ⅱ.SO2是葡萄、荔枝等水果储存时常用的保鲜剂,能降低水果腐烂率,提高维生素C留存率。
(2)硫原子的结构示意图为________ 。
(3)与SO2所含化学键类型相同的是________。
(4)硫与硅为同一周期元素,通过下列事实能比较两者非金属性强弱的是________(双选)。
(5)保鲜时若SO2不慎用量过大,会使水果表面明显褪色,上述现象说明SO2________ 。
A.易溶于水B.是酸性氧化物C.具有漂白作用
Ⅲ.《食品安全国家标准·食品添加剂使用标准》(GB 2760-2014)中规定,水果中SO2残留量不得高于0.05g/kg。某种测定水果中残留SO2的方法所涉及的主要反应有:SO2+ H2O2=H2SO4、 +Ba2+=BaSO4↓。
+Ba2+=BaSO4↓。
已知:ω(SO2残留量) =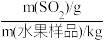 。
。
(6)称取某水果样品2 kg,经过一系列处理后,最终得到BaSO4,沉淀的质量为0.233 g。通过计算,判断该水果样品中SO2残留量是否超标______ (写出计算过程)。
(1)下列关天食品添加剂的说法正确的是
A制作豆腐时,加入石膏做凝固剂
B.制作糕点时,加入小苏打做防腐剂
C.生产加碘食盐时,加入碘单质作补碘剂
Ⅱ.SO2是葡萄、荔枝等水果储存时常用的保鲜剂,能降低水果腐烂率,提高维生素C留存率。
(2)硫原子的结构示意图为
(3)与SO2所含化学键类型相同的是________。
| A.NH4Cl | B.CaCl2 | C.AlCl3 | D.NaOH |
| A.热稳定性:H2S>SiH4 | B.溶解度:SO2> SiO2 |
| C.单质的熔点:Si > S | D.酸性:H2SO4> H2SiO3 |
A.易溶于水B.是酸性氧化物C.具有漂白作用
Ⅲ.《食品安全国家标准·食品添加剂使用标准》(GB 2760-2014)中规定,水果中SO2残留量不得高于0.05g/kg。某种测定水果中残留SO2的方法所涉及的主要反应有:SO2+ H2O2=H2SO4、
 +Ba2+=BaSO4↓。
+Ba2+=BaSO4↓。已知:ω(SO2残留量) =
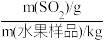 。
。(6)称取某水果样品2 kg,经过一系列处理后,最终得到BaSO4,沉淀的质量为0.233 g。通过计算,判断该水果样品中SO2残留量是否超标
您最近一年使用:0次
解题方法
3 . 人体必需的一些元素在周期表中的分布情况如下:
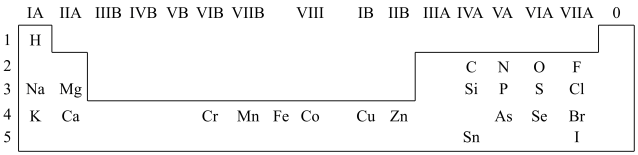
(1)请在上图中画出金属与非金属的分界线______ 。
(2)Na与O形成的原子个数比为1:1的化合物所含的化学键类型为______ 。
(3)锡(Sn)与C为同一主族元素,Sn原子比C原子多三个电子层,则Sn的原子序数为______ 。
(4)X射线衍射法可以测定某些分子的结构,下列分子结构模型中正确是______ (填字母)。
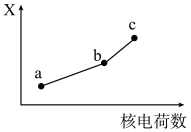
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是______(填字母)。
(6)某小组为探究 、
、 、
、 的氧化性强弱,设计实验如下:
的氧化性强弱,设计实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
实验②观察到的现象是______ ,甲同学根据此现象得出结论:氧化性 。乙同学认为实验②不能充分证明氧化性
。乙同学认为实验②不能充分证明氧化性 ,其理由是
,其理由是______ 。试从原子结构的角度解释卤素单质的氧化性递变规律:同一主族元素从上到下,______ ,因此,元素的非金属性逐渐减弱,对应的单质的氧化性逐渐减弱。

(1)请在上图中画出金属与非金属的分界线
(2)Na与O形成的原子个数比为1:1的化合物所含的化学键类型为
(3)锡(Sn)与C为同一主族元素,Sn原子比C原子多三个电子层,则Sn的原子序数为
(4)X射线衍射法可以测定某些分子的结构,下列分子结构模型中正确是
| A | B | C | D |
| HCl | H₂O | CO₂ | CH₄ |
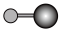 | 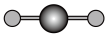 | 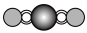 | 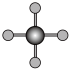 |
| 直线形 | 直线形 | 直线形 | 平面正方形 |
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是______(填字母)。

| A.若a、b、c表示碱金属元素,则X表示对应单质的密度 |
| B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性 |
| C.若a、b、c表示第ⅥA族元素,则X表示对应氢化物的稳定性 |
| D.若a、b、c表示第ⅡA族元素,则X表示最高价氧化物对应水化物的碱性 |
(6)某小组为探究
 、
、 、
、 的氧化性强弱,设计实验如下:
的氧化性强弱,设计实验如下:资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
| 序号 | 实验① | 实验② |
| 实验操作 |  |  |
| 现象 | 溶液变为黄色 |
 。乙同学认为实验②不能充分证明氧化性
。乙同学认为实验②不能充分证明氧化性 ,其理由是
,其理由是
您最近一年使用:0次
解题方法
4 . 现有下列六种物质:
① ②过氧化钠 ③
②过氧化钠 ③ ④
④ 溶液 ⑤碳酸氢钠 ⑥
溶液 ⑤碳酸氢钠 ⑥ 。请根据上述物质回答下列问题:
。请根据上述物质回答下列问题:
(1)在上述物质中属于酸性氧化物的有___________ (填①~⑥序号)。
(2)含有 氧原子的②与足量①反应,产生的气体在标准状况下的体积为
氧原子的②与足量①反应,产生的气体在标准状况下的体积为___________ L。
(3)写出⑥在水溶液中的电离方程式___________ 。
(4)②所含化学键类型为___________ 。
(5)某同学帮助水质检测站配制 ④以备使用。
④以备使用。
①该同学应用托盘天平称取 固体
固体___________ g。
②配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、___________ 。
③定容时仰视刻度线,则所配制的溶液的浓度会___________ (填“偏高”、“偏低”、“不变”)。
(6)④和⑤的溶液混合,发生反应的离子方程式为___________ 。
①
 ②过氧化钠 ③
②过氧化钠 ③ ④
④ 溶液 ⑤碳酸氢钠 ⑥
溶液 ⑤碳酸氢钠 ⑥ 。请根据上述物质回答下列问题:
。请根据上述物质回答下列问题:(1)在上述物质中属于酸性氧化物的有
(2)含有
 氧原子的②与足量①反应,产生的气体在标准状况下的体积为
氧原子的②与足量①反应,产生的气体在标准状况下的体积为(3)写出⑥在水溶液中的电离方程式
(4)②所含化学键类型为
(5)某同学帮助水质检测站配制
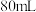 ④以备使用。
④以备使用。①该同学应用托盘天平称取
 固体
固体②配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、
③定容时仰视刻度线,则所配制的溶液的浓度会
(6)④和⑤的溶液混合,发生反应的离子方程式为
您最近一年使用:0次
名校
5 . 按要求完成下列填空。
I.下列物质:① ②
② ③NaOH④
③NaOH④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧
(1)含有共价键的离子化合物是___________ (填序号,下同)。
(2)属于共价化合物是___________ 。
(3)只含有非极性键的物质是___________ 。
(4)写出①的结构式___________ ,写出⑥的电子式___________ 。
II.下列变化:①蔗糖溶于水② 升华③烧碱熔化④NaCl溶解⑤
升华③烧碱熔化④NaCl溶解⑤ 溶解⑥硫酸氢钾溶于水
溶解⑥硫酸氢钾溶于水
(5)只有离子键被破坏的是___________ 。
(6)只有共价键被破坏的是___________ 。
(7)只破坏分子间作用力的是___________ 。
I.下列物质:①
 ②
② ③NaOH④
③NaOH④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧
(1)含有共价键的离子化合物是
(2)属于共价化合物是
(3)只含有非极性键的物质是
(4)写出①的结构式
II.下列变化:①蔗糖溶于水②
 升华③烧碱熔化④NaCl溶解⑤
升华③烧碱熔化④NaCl溶解⑤ 溶解⑥硫酸氢钾溶于水
溶解⑥硫酸氢钾溶于水(5)只有离子键被破坏的是
(6)只有共价键被破坏的是
(7)只破坏分子间作用力的是
您最近一年使用:0次
2024-02-07更新
|
270次组卷
|
2卷引用:甘肃省兰州第一中学2023-2024学年高一上学期1月期末化学试题
解题方法
6 . 下图为元素周期表的一部分,用化学用语回答下列问题:
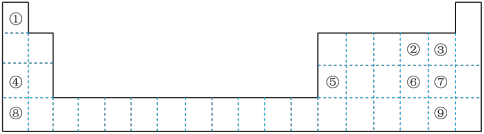
(1)请画出上述九种元素中非金属性最强的元素的原子结构示意图___________ 。
(2)④⑤⑧的阳离子中氧化性最强的是___________ (填离子符号)。
(3)上述元素中最高价氧化物对应的水化物中酸性最强的酸与氢氧化钠反应的化学方程式为___________ 。
(4)用电子式表示⑥和④形成化合物的过程___________ 。
(5)②和④形成原子个数比为1 :1的化合物中所含化学键类型为___________ 。
(6)现在含有元素硒(Se)的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多2个电子层,则下列叙述中正确的是___________。
(7)①和④可形成AB型离子化合物,该离子化合物的电子式为___________ ,其与水反应放出气体的化学方程式为___________ 。

(1)请画出上述九种元素中非金属性最强的元素的原子结构示意图
(2)④⑤⑧的阳离子中氧化性最强的是
(3)上述元素中最高价氧化物对应的水化物中酸性最强的酸与氢氧化钠反应的化学方程式为
(4)用电子式表示⑥和④形成化合物的过程
(5)②和④形成原子个数比为1 :1的化合物中所含化学键类型为
(6)现在含有元素硒(Se)的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多2个电子层,则下列叙述中正确的是___________。
| A.原子序数为34 |
| B.气态氢化物的还原性H2Se>H2S |
| C.SeO2不能与氢氧化钠反应 |
| D.SeO2既有氧化性又有还原性 |
(7)①和④可形成AB型离子化合物,该离子化合物的电子式为
您最近一年使用:0次
名校
7 . 下表列出了①~⑨九种元素在周期表中的位置:
请按要求回答下列问题:
(1)上述元素中、金属性最强的是___________ (填元素名称),最高价氧化物对应水化物酸性最强的是___________ (写出酸的化学式)。
(2)由④、⑤、⑥三种元素形成的简单离子半径由大到小的顺序是_______ (用离子符号表示)。
(3)由元素②形成的单质的电子式为___________ ;元素⑤和⑧可形成化合物乙,请用电子式表示化合物乙的形成过程___________ 。
(4)元素③的最简单氢化物的化学式是___________ ,该氢化物在常温下与元素⑨发生反应的化学方程式是___________ ,所得溶液的pH___________ 7。
(5)元素⑥的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是___________ 。
| 族周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | |||||||
(1)上述元素中、金属性最强的是
(2)由④、⑤、⑥三种元素形成的简单离子半径由大到小的顺序是
(3)由元素②形成的单质的电子式为
(4)元素③的最简单氢化物的化学式是
(5)元素⑥的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是
您最近一年使用:0次
名校
8 . 有下列物质:① ②
② ③
③ ④
④ ⑤
⑤ ⑥氩气,回答下列问题(填序号):
⑥氩气,回答下列问题(填序号):
(1)不存在化学键的是___________
(2)只存在非极性键的是___________
(3)只存在离子键的是___________
(4)既存在离子键又存在极性键的是___________
(5)既存在离子键又存在非极性键的是___________
 ②
② ③
③ ④
④ ⑤
⑤ ⑥氩气,回答下列问题(填序号):
⑥氩气,回答下列问题(填序号):(1)不存在化学键的是
(2)只存在非极性键的是
(3)只存在离子键的是
(4)既存在离子键又存在极性键的是
(5)既存在离子键又存在非极性键的是
您最近一年使用:0次
名校
9 . 下列变化:①烧碱熔化;② 升华;③
升华;③ 溶于水;④
溶于水;④ 溶于水;⑤
溶于水;⑤ 溶于水;⑥
溶于水;⑥ 受热分解为
受热分解为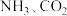 和
和 。其中仅离子键被破坏的是
。其中仅离子键被破坏的是_______ (填序号,下同)仅共价键被破坏的是_______ ;
 升华;③
升华;③ 溶于水;④
溶于水;④ 溶于水;⑤
溶于水;⑤ 溶于水;⑥
溶于水;⑥ 受热分解为
受热分解为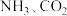 和
和 。其中仅离子键被破坏的是
。其中仅离子键被破坏的是
您最近一年使用:0次
名校
10 . 已知:氢化锂(LiH)是一种离子化合物,其中锂元素显+1价。在氢化锂中存在的化学键为_______ ;LiH中的两种离子半径大小比较_______ ;写出NaH的电子式_______
您最近一年使用:0次



