名校
1 . 1869年门捷列夫提出元素周期表,根据元素周期表和周期律,回答问题。
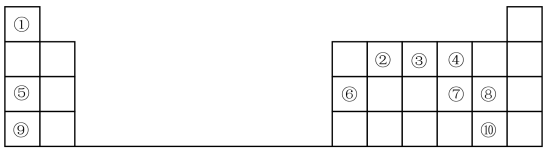
(1)元素⑦在周期表中的位置_______ 。
(2)元素①和⑤形成的化合物中化学键类型是_______ 。
(3)在①~⑧元素中,原子半径最大的是_______ (填元素名称);其某种氧化物可用于潜水艇中的供氧剂,该氧化物中阴离子与阳离子个数比为_______ 。
(4)元素⑦⑧⑨的简单离子半径由大到小的顺序是_______ (用离子符号表示),元素⑨的最高价氧化物对应水化物与元素⑥的最高价氧化物对应的水化物反应的离子方程式为_______ 。
(5)元素的非金属性⑩_______ ⑧(填“>”或“<”);下列事实不能证明上述结论的是_______ 。
A.元素⑧的单质与⑩的氢化物的水溶液反应,溶液变为橙黄色
B.元素⑧的氢化物的还原性比元素⑩的弱
C.元素⑧和⑩的氢化物受热分解,前者的分解温度高
D.元素⑧的最高价氧化物对应水化物的酸性比元素⑩的强
E.元素⑧的氢化物的水溶液的酸性比元素⑩的弱
(6)⑤的最高价氧化物对应的水化物的电子式为_______ ,用电子式表示氯化钠的形成过程_______ 。

(1)元素⑦在周期表中的位置
(2)元素①和⑤形成的化合物中化学键类型是
(3)在①~⑧元素中,原子半径最大的是
(4)元素⑦⑧⑨的简单离子半径由大到小的顺序是
(5)元素的非金属性⑩
A.元素⑧的单质与⑩的氢化物的水溶液反应,溶液变为橙黄色
B.元素⑧的氢化物的还原性比元素⑩的弱
C.元素⑧和⑩的氢化物受热分解,前者的分解温度高
D.元素⑧的最高价氧化物对应水化物的酸性比元素⑩的强
E.元素⑧的氢化物的水溶液的酸性比元素⑩的弱
(6)⑤的最高价氧化物对应的水化物的电子式为
您最近一年使用:0次
名校
解题方法
2 . 明朝《天工开物》中有世界上最早的“火法”炼锌技术的记载,锌是生命体必需的微量元素,被称为“生命之花”。
(1)基态Zn原子核外的最高能层符号是___________ 。
(2)乳酸锌(如图)是一种很好的食品锌强化剂,其中存在的作用力有___________ (填编号),乳酸锌中C原子的杂化方式有___________ 。
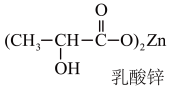
A离子键 B.极性共价键 C.金属键 D.配位键 E.范德华力
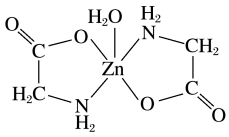
(3)一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图所示。其中所涉及的非金属元素的电负性由大到小的顺序是___________ , 的配位数为
的配位数为___________ ;甘氨酸易溶于水,试从结构角度解释___________ 。
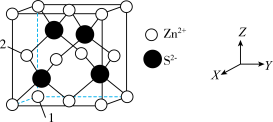
(4)Zn与S形成某种化合物的晶胞如图所示。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。例如图中原子1的坐标为(0,0,0),则原子2的坐标为___________ 。
②已知晶胞参数为apm,阿伏伽德罗常数为 ,求该晶胞的密度
,求该晶胞的密度
___________  (写计算表达式)。
(写计算表达式)。
(1)基态Zn原子核外的最高能层符号是
(2)乳酸锌(如图)是一种很好的食品锌强化剂,其中存在的作用力有

A离子键 B.极性共价键 C.金属键 D.配位键 E.范德华力
(3)一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图所示。其中所涉及的非金属元素的电负性由大到小的顺序是
 的配位数为
的配位数为
(4)Zn与S形成某种化合物的晶胞如图所示。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。例如图中原子1的坐标为(0,0,0),则原子2的坐标为
②已知晶胞参数为apm,阿伏伽德罗常数为
 ,求该晶胞的密度
,求该晶胞的密度
 (写计算表达式)。
(写计算表达式)。
您最近一年使用:0次
名校
解题方法
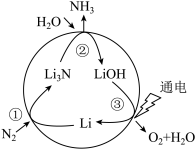
3 . 物质的类别和核心元素的化合价是研究物质性质的两个重要角度。部分含氮及氯物质的价类二维图如下,回答下列问题:
(2)固氮是将游离态的氮转变为氮的化合物,一种新型人工固氮的原理如图:_______ 为氧化还原反应(填编号)。
b.参与该人工固氮转化的物质中含有的化学键类型有_______ (填字母)。
A.离子键 B.极性键 C.非极性键 D.氢键
c.假设每一步均完全转化,每生成1 mol NH3,同时生成_______ mol O2。
(3)由氮和氯组成的一种二元化合物分子中,各原子最外层均达到8电子的稳定结构,该液态化合物遇水可生成一种具有漂白性的化合物,试写出该反应的化学方程式:_______ 。
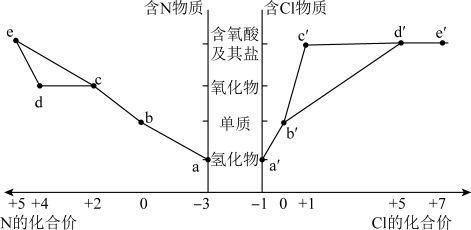
| A.a和c可在一定条件下反应生成b |
| B.工业上通过a→b→d→e来制备HNO3 |
C.浓的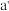 溶液和浓的 溶液和浓的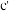 溶液反应可以得到 溶液反应可以得到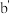 |
D.a和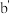 可在一定条件下反应生成b 可在一定条件下反应生成b |
b.参与该人工固氮转化的物质中含有的化学键类型有
A.离子键 B.极性键 C.非极性键 D.氢键
c.假设每一步均完全转化,每生成1 mol NH3,同时生成
(3)由氮和氯组成的一种二元化合物分子中,各原子最外层均达到8电子的稳定结构,该液态化合物遇水可生成一种具有漂白性的化合物,试写出该反应的化学方程式:
您最近一年使用:0次
2023-04-07更新
|
259次组卷
|
2卷引用:四川省成都市树德中学2022-2023学年高一下学期4月月考化学试题
名校
解题方法
4 . 有A、B、C、D四种元素,它们的原子序数由A到D逐渐增大。①D的氧化物分子式为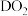 ,D的最高价氧化物中,D的质量百分含量为40%,而且D的原子核中,质子数和中子数相等,②A和B原子有相同的电子层数,A原子的最外层电子数是次外层电子数的2倍;⑧B的阴离子与C的阳离子和Ne原子的电子层结构相同。通常状况下,B的单质是气体,
,D的最高价氧化物中,D的质量百分含量为40%,而且D的原子核中,质子数和中子数相等,②A和B原子有相同的电子层数,A原子的最外层电子数是次外层电子数的2倍;⑧B的阴离子与C的阳离子和Ne原子的电子层结构相同。通常状况下,B的单质是气体, 和
和 完全反应时,有
完全反应时,有 个电子转移,C的单质在高温下与B的单质充分反应,可生成浅黄色固体,此生成物与
个电子转移,C的单质在高温下与B的单质充分反应,可生成浅黄色固体,此生成物与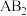 反应可生成B的单质。根据以上叙述试回答:
反应可生成B的单质。根据以上叙述试回答:
(1)指出四种元素的名称:A_______ ;B_______ ;C_______ ;D_______
(2)写出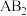 的结构式:
的结构式:_______ ;含有的化学键类型为:_______
(3)写出B和C在加热条件反应的化学方程式:_______ ;并写出所得化合物的电子式:_______
(4)B和D的气态氢化物稳定性强弱:_______ >_______
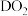 ,D的最高价氧化物中,D的质量百分含量为40%,而且D的原子核中,质子数和中子数相等,②A和B原子有相同的电子层数,A原子的最外层电子数是次外层电子数的2倍;⑧B的阴离子与C的阳离子和Ne原子的电子层结构相同。通常状况下,B的单质是气体,
,D的最高价氧化物中,D的质量百分含量为40%,而且D的原子核中,质子数和中子数相等,②A和B原子有相同的电子层数,A原子的最外层电子数是次外层电子数的2倍;⑧B的阴离子与C的阳离子和Ne原子的电子层结构相同。通常状况下,B的单质是气体, 和
和 完全反应时,有
完全反应时,有 个电子转移,C的单质在高温下与B的单质充分反应,可生成浅黄色固体,此生成物与
个电子转移,C的单质在高温下与B的单质充分反应,可生成浅黄色固体,此生成物与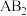 反应可生成B的单质。根据以上叙述试回答:
反应可生成B的单质。根据以上叙述试回答:(1)指出四种元素的名称:A
(2)写出
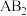 的结构式:
的结构式:(3)写出B和C在加热条件反应的化学方程式:
(4)B和D的气态氢化物稳定性强弱:
您最近一年使用:0次
2023-03-28更新
|
69次组卷
|
2卷引用:四川省广安市育才学校2022-2023学年高一下学期3月月考化学试题
5 . A、B、C、D、E、F为六种短周期元素,相关信息如下:
根据以上信息提示,回答下列问题。
(1)C元素在周期表中的位置为_______ 。简单氢化物沸点最低的是(填化学式)_______ 。
(2)由B、C、D三元素按原子个数2∶3∶4之比形成物质的化学式为_______ ,化合物DEC所含化学键的类型有_______ (填“金属键”、“离子键”、“极性共价键”或“非极性共价键”)。
(3)将BD3通入到FEC溶液中可制得B2D4,该反应的离子方程式为_______ 。
(4)一种淡黄色固体F2C2,其电子式为_______ 。该固体与硫酸亚铁溶液(按物质的量之比为1∶1)反应。反应过程中有气体生成,则该反应的还原剂为_______ 。
| 序号 | 信息 |
| ① | A、B、C原子序数依次增大,均可与D形成含10e-的分子 |
| ② | C为地壳中含量最高的元素 |
| ③ | E与F同周期,且E在同周期元素中非金属性最强 |
| ④ | F为短周期中原子半径最大的元素 |
(1)C元素在周期表中的位置为
(2)由B、C、D三元素按原子个数2∶3∶4之比形成物质的化学式为
(3)将BD3通入到FEC溶液中可制得B2D4,该反应的离子方程式为
(4)一种淡黄色固体F2C2,其电子式为
您最近一年使用:0次
名校
解题方法
6 . 研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1) 基态原子电子排布式为
基态原子电子排布式为_______ 。元素 与O中,第一电离能较大的是
与O中,第一电离能较大的是_______ ,基态原子核外未成对电子数较多的是_______ 。
(2)CO2和CH3OH分子中C原子的杂化形式分别为_______ 和_______ 。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_______ ,原因是_______ 。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在_______ 。
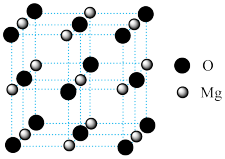
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为_______  。该晶体的密度为
。该晶体的密度为_______  (列出计算式,NA为阿伏加德罗常数的值)。
(列出计算式,NA为阿伏加德罗常数的值)。
(1)
 基态原子电子排布式为
基态原子电子排布式为 与O中,第一电离能较大的是
与O中,第一电离能较大的是(2)CO2和CH3OH分子中C原子的杂化形式分别为
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为
 。该晶体的密度为
。该晶体的密度为 (列出计算式,NA为阿伏加德罗常数的值)。
(列出计算式,NA为阿伏加德罗常数的值)。
您最近一年使用:0次
名校
7 . 回答下列问题
(1)请用下列10种物质的序号填空:
①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2
其中既含离子键又含非极性键的是_______ ;既含离子键又含极性键的是_______ 。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为_______ ;若XY2为共价化合物时(已知硫磺易溶于其中),其结构式为_______ 。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190 ℃,但在180 ℃就开始升华。据此判断,氯化铝是_______ (填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是_______ 。
(4)现有a~g 7种短周期元素,它们在元素周期表中的位置如图所示,请据此回答下列问题:
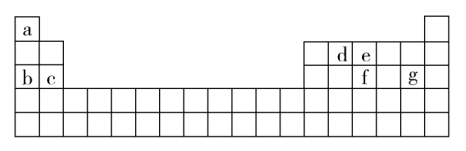
①元素的原子间反应最容易形成离子键的是_______ (填选项,下同),容易形成共价键的是_______ 。
A.c和f B.b和g C.d和g D.b和e
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式_______ 。
(5)a与e能形成氢化物的空间构型为_______ ,其所含化学键类型为_______ ,将其通入到炽热的黑色氧化铜粉末中,出现了红色固体,其他产物对环境友好,请写出相关方程:_______ 。
(1)请用下列10种物质的序号填空:
①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2
其中既含离子键又含非极性键的是
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190 ℃,但在180 ℃就开始升华。据此判断,氯化铝是
(4)现有a~g 7种短周期元素,它们在元素周期表中的位置如图所示,请据此回答下列问题:

①元素的原子间反应最容易形成离子键的是
A.c和f B.b和g C.d和g D.b和e
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式
(5)a与e能形成氢化物的空间构型为
您最近一年使用:0次
2022-10-24更新
|
278次组卷
|
2卷引用:四川省宜宾市第四中学校2022-2023学年高一下学期6月期末考试化学试题
名校
8 . 已知有五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族;A与B形成的离子化合物A2B中所有离子的电子数都相同,其电子总数为30;D和E可形成4核10电子分子。试回答下列问题:
(1)C、D两种元素的名称分别为_______ 、_______ 。
(2)A,B,C离子半径从大到小的顺序_______ (用具体离子符号表示)。
(3)写出D元素形成的单质的结构式:_______ 。
(4)比较B、D氢化物的稳定性:_______ (用化学式表示)。
(5)A、B两种元素组成的化合物A2B2属于_______ (填“离子”或“共价”)化合物,存在的化学键类型是_______ ;写出A2B2与水反应的化学方程式:_______ 。
(6)D元素的最高价氧化物对应水化物的稀溶液与Cu反应的离子方程式:_______ 。
(1)C、D两种元素的名称分别为
(2)A,B,C离子半径从大到小的顺序
(3)写出D元素形成的单质的结构式:
(4)比较B、D氢化物的稳定性:
(5)A、B两种元素组成的化合物A2B2属于
(6)D元素的最高价氧化物对应水化物的稀溶液与Cu反应的离子方程式:
您最近一年使用:0次
名校
解题方法
9 . 碳是形成化合物种类最多的元素,其单质及其化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程:
 ΔH=+88.6 kJ/mol ,则M、N相比,较稳定的是
ΔH=+88.6 kJ/mol ,则M、N相比,较稳定的是___________ 。
(2)已知CH3OH(1)的燃烧热为-726.5 kJ ·mol-1,CH3OH(1)+ O2(g)=CO2(g)+ 2H2O(g) ΔH=-a kJ·mol-1,则a
O2(g)=CO2(g)+ 2H2O(g) ΔH=-a kJ·mol-1,则a___________ 726.5(填“>”“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应生成1 mol CO2时的热化学方程式:___________ 。
(4)隐形战机采用Fe(CO)5(羰基铁)作为吸波材料,羰基铁在常温下为红棕色液体,固体羰基铁属于___________ 晶体,CO与N2属于等电子体,则CO的结构式为___________ 。
(1)有机物M经过太阳光光照可转化成N,转化过程:

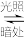
 ΔH=+88.6 kJ/mol ,则M、N相比,较稳定的是
ΔH=+88.6 kJ/mol ,则M、N相比,较稳定的是(2)已知CH3OH(1)的燃烧热为-726.5 kJ ·mol-1,CH3OH(1)+
 O2(g)=CO2(g)+ 2H2O(g) ΔH=-a kJ·mol-1,则a
O2(g)=CO2(g)+ 2H2O(g) ΔH=-a kJ·mol-1,则a(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应生成1 mol CO2时的热化学方程式:
(4)隐形战机采用Fe(CO)5(羰基铁)作为吸波材料,羰基铁在常温下为红棕色液体,固体羰基铁属于
您最近一年使用:0次
名校
解题方法
10 . I、①碘的升华 ②烧碱熔化 ③氯化钠溶于水 ④氯化氢溶于水 ⑤氧气溶于水
⑥氯化铵受热分解。
未发生化学键破坏的是___________ ;仅发生离子键破坏的是___________ ;仅发生共价键破坏的是___________ ;既发生离子键又发生共价键破坏的是___________ ;
II、下列8种化学符号: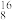 O2、
O2、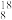 O2、
O2、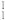 H、
H、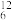 C、
C、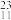 Na、
Na、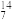 N、
N、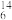 C、
C、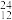 Mg。
Mg。
(1)表示核素的符号共___________ 种。
(2)互为同位素的是___________ 。
(3)质量相同的H216O和D216O所含中子数之比为___________ 。
根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(4)写出Be与NaOH溶液反应生成Na2BeO2的离子方程式:___________ 。
(5)Be(OH)2与Mg(OH)2可用___________ 试剂鉴别。
⑥氯化铵受热分解。
未发生化学键破坏的是
II、下列8种化学符号:
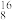 O2、
O2、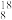 O2、
O2、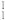 H、
H、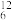 C、
C、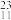 Na、
Na、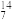 N、
N、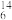 C、
C、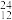 Mg。
Mg。(1)表示核素的符号共
(2)互为同位素的是
(3)质量相同的H216O和D216O所含中子数之比为
根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(4)写出Be与NaOH溶液反应生成Na2BeO2的离子方程式:
(5)Be(OH)2与Mg(OH)2可用
您最近一年使用:0次
2021-05-24更新
|
225次组卷
|
2卷引用:四川省内江市威远中学2020-2021学年高一下学期第一次月考化学试题



