名校
1 . 以金属钌作催化剂可以从空气中捕获CO2直接转化为甲醇,其转化原理如图所示。下列说法正确的是
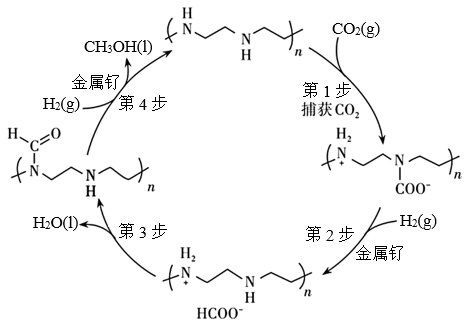

A.第1步反应可表示为 +CO2→ +CO2→ |
| B.第2步反应产物为离子化合物 |
| C.第4步反应中断开化学键只有C-N键和H-H键 |
D.该过程的总反应为CO2+3H2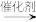 CH3OH+H2O CH3OH+H2O |
您最近一年使用:0次
2021-09-02更新
|
342次组卷
|
2卷引用:山东省烟台市2021届高三下学期适应性练习(二)化学试题
名校
解题方法
2 . 下列说法有几项是正确的
①质子数相同的粒子一定属于同一种元素
②含金属元素的离子可能是阴离子
③化学键可存在于相邻的原子之间,也可存在于相邻的分子之间
④某化合物在水溶液中能导电,可以证明该化合物内一定存在离子键
⑤两种非金属元素形成AB型化合物,它一定含共价键
⑥物质中化学键被破坏,一定发生化学变化
⑦氢氟酸贮存在细口玻璃瓶里
①质子数相同的粒子一定属于同一种元素
②含金属元素的离子可能是阴离子
③化学键可存在于相邻的原子之间,也可存在于相邻的分子之间
④某化合物在水溶液中能导电,可以证明该化合物内一定存在离子键
⑤两种非金属元素形成AB型化合物,它一定含共价键
⑥物质中化学键被破坏,一定发生化学变化
⑦氢氟酸贮存在细口玻璃瓶里
| A.2 | B.3 | C.4 | D.5 |
您最近一年使用:0次
2023-08-10更新
|
152次组卷
|
2卷引用:山东省烟台市莱阳市第一中学2023-2024学年高一下学期3月月考化学试题
名校
解题方法
3 . 一氧化碳甲烷化反应为:CO(g) + 3H2(g) = CH4(g) + H2O(g)。下图是使用某种催化剂时转化过程中的能量变化(部分物质省略)。
CO(g)+H2(g) CO(g)+·H
CO(g)+·H  ·CHO
·CHO  ·CH+H2O(g→CH4(g)
·CH+H2O(g→CH4(g)
下列说法不正确的是

CO(g)+H2(g)
 CO(g)+·H
CO(g)+·H  ·CHO
·CHO  ·CH+H2O(g→CH4(g)
·CH+H2O(g→CH4(g)下列说法不正确的是
| A.步骤①只有非极性键断裂 |
| B.步骤②的原子利用率为 100% |
| C.过渡态Ⅱ能量最高,因此其对应的步骤③反应速率最慢 |
| D.该方法可以清除剧毒气体CO,从而保护环境 |
您最近一年使用:0次
2020-07-01更新
|
447次组卷
|
3卷引用:山东省烟台第二中学2021-2022学年高一3月月月考化学试题
山东省烟台第二中学2021-2022学年高一3月月月考化学试题北京市海淀区北京大学附中2020 届高三化学阶段性测试化学试题(已下线)专题07 化学反应中的能量变化-2020年高考真题和模拟题化学分项汇编
解题方法
4 . 下列说法错误的是
| A.非金属单质中一定不含离子键,一定只含共价键 |
| B.化学键是相邻原子之间的强相互作用 |
| C.酸雨后钢铁易发生析氢腐蚀,日常铁锅存留盐液时易发生吸氧腐蚀 |
| D.电热水器有镁棒防止内胆腐蚀是牺牲阳极保护法 |
您最近一年使用:0次
解题方法
5 . 下列关于化合物和化学键类型的叙述正确的是
| HClO | Na2O2 | NaCl | NH4Cl | |
| A | 共价化合物 共价键 | 离子化合物 离子键 | 离子化合物 离子键 | 共价化合物 共价键 |
| B | 共价化合物 共价键 | 离子化合物 共价键 | 离子化合物 离子键 | 离子化合物 共价键 |
| C | 共价化合物 共价键 | 离子化合物 离子键、共价键 | 离子化合物 离子键 | 离子化合物 离子键、共价键 |
| D | 共价化合物 离子键 | 离子化合物 离子键、共价键 | 离子化合物 离子键 | 离子化合物 离子键、共价键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-02-14更新
|
309次组卷
|
2卷引用:山东省烟台市2018-2019学年高一下学期期末学业水平诊断化学试题
6 . 下列每组物质均为含有共价键的离子化合物的是
| A.CaCO3、Ca(OH)2、NaHS | B.MgO、MgSO4、NH4Cl |
| C.H2SO4、HNO3、HClO4 | D.MgF2、Al2O3、Mg3N2 |
您最近一年使用:0次
解题方法
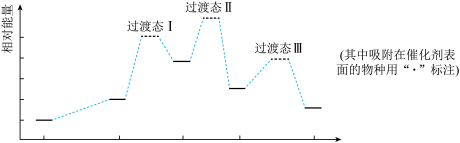
7 . 盐酸阿比多尔是一种盐酸盐,其主要作用是通过抑制流感病毒脂膜与宿主细胞的融合而阻断病毒的复制,结构如图。回答下列问题:
(1)盐酸阿比多尔中所含N、O、S三种元素第一电离能由大到小的顺序为___ 。O原子核外有___ 种不同运动状态的电子,基态S原子的价电子排布图不是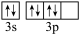 ,是因为该排布方式违背了
,是因为该排布方式违背了___ 。
(2)该结构中N原子的杂化方式是___ 。已知在氨分子中,H—N—H键角为107.3°,但是在[Zn(NH3)6]2+离子中H—N—H键角变为109.5°,分析原因为___ 。
(3)盐酸阿比多尔中不含有的化学键类型为___ (填选项字母)。
A.离子键 B.配位键 C.金属键 D.σ键 E.π键 F.极性键 G.非极性键
(4)以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点。GaN晶胞如图1所示,图2为晶胞沿y轴的投影1∶1平面图。
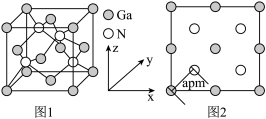
①氮化硼与氮化镓的结构类似,氮化硼熔点3000℃,氮化镓熔点1700℃,分析它们熔点不同的原因____ 。
②晶胞中与一个Ga原子距离最近且相等的N原子有____ 个。
③设阿伏加 德罗常数的值为NA,则该晶胞的密度是___ g·cm−3(列出计算表达式)。

(1)盐酸阿比多尔中所含N、O、S三种元素第一电离能由大到小的顺序为
 ,是因为该排布方式违背了
,是因为该排布方式违背了(2)该结构中N原子的杂化方式是
(3)盐酸阿比多尔中不含有的化学键类型为
A.离子键 B.配位键 C.金属键 D.σ键 E.π键 F.极性键 G.非极性键
(4)以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点。GaN晶胞如图1所示,图2为晶胞沿y轴的投影1∶1平面图。

①氮化硼与氮化镓的结构类似,氮化硼熔点3000℃,氮化镓熔点1700℃,分析它们熔点不同的原因
②晶胞中与一个Ga原子距离最近且相等的N原子有
③设阿伏加 德罗常数的值为NA,则该晶胞的密度是
您最近一年使用:0次
名校
解题方法
8 . 下列有关化学键类型的叙述正确的是( )
| A.全部由非金属构成的化合物中肯定不存在离子键 |
| B.所有物质中都存在化学键 |
| C.已知乙炔的结构式为H—C≡C—H,则乙炔中存在2个σ键(C—H)和3个π键(C≡C) |
| D.乙烷分子中只存在σ键,不存在π键 |
您最近一年使用:0次
2020-02-15更新
|
179次组卷
|
7卷引用:山东省烟台第二中学2019-2020学年高二上学期12月月考化学试题
名校
9 . 下列有关说法正确的是
| A.NaOH 是只含离子键的离子化合物 |
| B.HCl 溶于水没有破坏共价键 |
| C.碳在O2中燃烧时,破坏碳和O2中化学键吸收的总能量大于形成CO2中化学键释放的总能量 |
| D.在Cl2+2NaBr=2NaCl+Br2反应过程中有离子键和共价键的断裂,也有离子键和共价键形成 |
您最近一年使用:0次
2019-04-17更新
|
203次组卷
|
2卷引用:【全国百强校】山东省招远一中2018-2019学年高一下学期4月月考化学试题
名校
10 . A、B、C、D、E、F 六种短周期主族元素,它们的原子序数依次增大。A 与 E 同主族,D 与 F 同主族,且 A 与 D 能形成两种液态化合物;B 的某种单质是自然界中硬度最大的物质,C 与D 形成的化合物是大气常见污染物之一。请回答下列问题:
(1)F 在元素周期表中的位置是_____ ,D、E、F 三种元素简单离子半径由大到小的顺序是________ (用离子符号表示)。
(2)元素 E、F 可形成多原子化合物E2Fx(x ≥ 2)。该化合物中所含的化学键类型是_____ 。
(3)实验室可利用_____ (填试剂名称)清洗附着于试管内壁的 F 单质。
(4)处理含 BC−废水的方法之一是在微生物的作用下,BC−被 D 的单质氧化成 ABD−,同时生成C 的简单氢化物,该反应的离子方程式为_____ 。
(1)F 在元素周期表中的位置是
(2)元素 E、F 可形成多原子化合物E2Fx(x ≥ 2)。该化合物中所含的化学键类型是
(3)实验室可利用
(4)处理含 BC−废水的方法之一是在微生物的作用下,BC−被 D 的单质氧化成 ABD−,同时生成C 的简单氢化物,该反应的离子方程式为
您最近一年使用:0次



