名校
解题方法
1 . 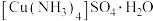 是一种农业杀虫剂,下列相关说法错误的是
是一种农业杀虫剂,下列相关说法错误的是
 是一种农业杀虫剂,下列相关说法错误的是
是一种农业杀虫剂,下列相关说法错误的是A.该化合物中 的中心原子的杂化轨道类型为 的中心原子的杂化轨道类型为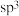 |
| B.该化合物中存在的化学键有离子键,共价键,配位键和氢键 |
C. 极易溶于 极易溶于 形成氨水,氨水中最多可形成4种氢键 形成氨水,氨水中最多可形成4种氢键 |
D.根据VSEPR模型预测的 的空间结构是正四面体形 的空间结构是正四面体形 |
您最近一年使用:0次
2 . 下列各物质的晶体中,化学键类型完全相同,晶体类型也相同的是
| A.SiF4与SiC | B.HCOOCH3与NH4NO3 |
| C.CaO与Na2O2 | D.NF3与CS2 |
您最近一年使用:0次
名校
解题方法
3 . 明朝《天工开物》中有世界上最早的“火法”炼锌技术的记载,锌是生命体必需的微量元素,被称为“生命之花”。
(1)基态Zn原子核外的最高能层符号是___________ 。
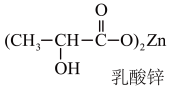
(2)乳酸锌(如图)是一种很好的食品锌强化剂,其中存在的作用力有___________ (填编号),乳酸锌中C原子的杂化方式有___________ 。
A离子键 B.极性共价键 C.金属键 D.配位键 E.范德华力
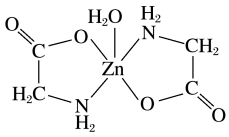
(3)一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图所示。其中所涉及的非金属元素的电负性由大到小的顺序是___________ , 的配位数为
的配位数为___________ ;甘氨酸易溶于水,试从结构角度解释___________ 。
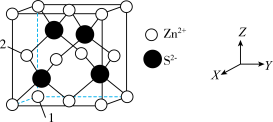
(4)Zn与S形成某种化合物的晶胞如图所示。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。例如图中原子1的坐标为(0,0,0),则原子2的坐标为___________ 。
②已知晶胞参数为apm,阿伏伽德罗常数为 ,求该晶胞的密度
,求该晶胞的密度
___________  (写计算表达式)。
(写计算表达式)。
(1)基态Zn原子核外的最高能层符号是
(2)乳酸锌(如图)是一种很好的食品锌强化剂,其中存在的作用力有

A离子键 B.极性共价键 C.金属键 D.配位键 E.范德华力
(3)一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图所示。其中所涉及的非金属元素的电负性由大到小的顺序是
 的配位数为
的配位数为
(4)Zn与S形成某种化合物的晶胞如图所示。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。例如图中原子1的坐标为(0,0,0),则原子2的坐标为
②已知晶胞参数为apm,阿伏伽德罗常数为
 ,求该晶胞的密度
,求该晶胞的密度
 (写计算表达式)。
(写计算表达式)。
您最近一年使用:0次
名校
解题方法
4 . 下列说法中,正确的一组是
①两种元素组成的共价化合物的分子中的化学键都是极性键
②两种不同非金属元素的原子之间形成的化学键都是极性键
③2p能级上有两个未成对电子的简单氢化物属于非极性分子
④氯化铵和五水硫酸铜都属于配合物
⑤离子化合物中一定含有离子键
⑥分子内可能没有共价键
⑦非金属单质都是非极性分子
⑧σ键和π键可以都单独存在
①两种元素组成的共价化合物的分子中的化学键都是极性键
②两种不同非金属元素的原子之间形成的化学键都是极性键
③2p能级上有两个未成对电子的简单氢化物属于非极性分子
④氯化铵和五水硫酸铜都属于配合物
⑤离子化合物中一定含有离子键
⑥分子内可能没有共价键
⑦非金属单质都是非极性分子
⑧σ键和π键可以都单独存在
| A.②⑤⑥⑦ | B.②⑤⑥ | C.①②③⑤⑥⑧ | D.②③⑤⑥⑦ |
您最近一年使用:0次
5 . 在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是
| A.范德华力、范德华力、范德华力 | B.范德华力、范德华力、共价键 |
| C.范德华力、共价键、共价键 | D.共价键、共价键、共价键 |
您最近一年使用:0次
2023-07-11更新
|
544次组卷
|
51卷引用:四川省武胜烈面中学校2019-2020学年高二下学期期中考试化学试题
四川省武胜烈面中学校2019-2020学年高二下学期期中考试化学试题2015-2016学年辽宁沈阳市第二中学高二下期末考化学卷2016-2017学年黑龙江大庆实验中学高二上开学考化学卷(已下线)同步君 选修3 第二章 第三节 范德华力和氢键及其对物质性质的影响2016-2017学年河北省衡水中学高二上学期五调考试化学试卷【全国百强校】宁夏银川唐徕回民中学2017-2018学年高二下学期期中考试化学试题吉林省汪清县第六中学2018-2019学年高二6月月考化学试题河南省新乡市辉县市第二高级中学2019-2020学年高二下学期期中考试化学试题新疆喀什地区巴楚县第一中学2020-2021学年高二上学期期中考试化学试题(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第4节 分子间作用力(已下线)第二章 分子结构与性质【过关测试基础卷】-2020-2021学年高二化学单元复习(新教材人教版选择性必修2)黑龙江省哈尔滨市阿城区龙涤中学2020-2021学年高二4月月考化学试题四川省成都市实验外国语学校(西区)2019-2020 学年高一下学期期中考试化学试题黑龙江省鸡西市英桥高级中学2021-2022学年高二下学期期中考试化学试卷山东省泰安市2022-2023学年高二下学期期末考试化学试题广东省云浮市罗定中学2022-2023学年高二下学期第2周周测(分子结构与性质)化学试题(已下线)2.3.2 分子间作用力 分子的手性(巩固)山东省泰安第二中学2023-2024学年高二下学期3月月考化学试题海南省文昌中学2023-2024学年高二下学期第一次月考化学试题广东省肇庆市加美学校2023-2024学年高二下学期竞赛化学试题山东省日照市五莲中学2023-2024学年高二3月月考化学试题2014年全国普通高等学校招生统一考试理科综合能力测试化学(上海卷)(已下线)2015届北京市重点中学高三上学期第一次月考化学试卷2015届河北省永年县第二中学高三12月月考化学试卷2016届湖南省益阳市箴言中学高三上学期第三次模拟化学试卷2016届上海市徐汇区高三上学期学习能力诊断化学试卷2017届浙江省台州中学高三上统考四化学试卷浙江省2018版考前特训(2017年10月)学考70快练:5 原子、分子中的概念辨析与判断山东省滕州市第一中学2015-2016学年高一4月竞赛化学试题高中化学人教版 选修三 第2章 分子结构与性质 范德华力及其对物质性质的影响(已下线)2019高考备考二轮复习精品资料-专题7 物质结构与元素周期律(教学案)(已下线)考点06 原子结构 化学键——备战2019年浙江新高考化学考点上海市浦外教育集团2018-2019学年高三上学期月考化学试题上海市复旦大学附属中学2016-2017学年高一上学期期末考试化学试题2上海市建平中学2019届高三上学期期中考试化学试题上海市市东中学2019-2020学年高三上学期期中考试化学试题辽宁省实验中学东戴河分校2019-2020学年高一上学期12月月考化学试题上海市顾村中学2018-2019学年高三上学期期中考试化学试题上海市民本中学2016-2017学年高三上学期第一次月考化学试题湖北省武汉市钢城第四中学2019-2020高一下学期期中考试化学试题河北省沧州市泊头市第一中学2019-2020学年高一下学期期末考试化学试题(已下线)5.2.2 共价键 分子间作用力练习(2)——《高中新教材同步备课》(苏教版 必修第一册)(已下线)专题05 元素周期律(元素框图推断、“位、构、性”、化学键)-2021年高考化学必做热点专题(已下线)考点08 分子间作用力 氢键-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点08 微粒间作用力-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点08 微粒间相互作用力-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)4.3化学键-同步学习必备知识上海市嘉定区2023届高三一模化学试题(已下线)专题09 原子结构及性质(已下线)考点08 微粒间相互作用力(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)题型20 物质结构与性质基础-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
6 . 下列化合物中,只含有共价键的是
| A.NaOH | B.KCl | C. | D.CaO |
您最近一年使用:0次
名校
7 . 已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是宇宙中含量最丰富的元素,Y元素的最高正价与最低负价的绝对值相等,Z的核电荷数是Y的2倍,W的最外层电子数是其最内层电子数的3倍。下列说法不正确的是
| A.Y的最高价氧化物对应的水化物是弱酸 |
| B.最简单氢化物的热稳定性:R>W |
| C.R与X形成的化合物同W与Z形成的化合物的化学键类型完全相同 |
| D.原子半径:Z>W>R |
您最近一年使用:0次
名校
解题方法
8 . 向由0.1 mol CrCl3·6H2O配成的溶液中加入足量AgNO3溶液,产生0.2 mol沉淀。配合物CrCl3·6H2O的配位数为6,下列说法错误的是
| A.该配合物的中心离子是Cr3+ |
| B.该配合物的配体是H2O和Cl− |
| C.每1 mol配离子[Cr(H2O)5Cl]2+中含有6NA个共价键 |
| D.该配合物中存在的化学键有:共价键、配位键、离子键 |
您最近一年使用:0次
名校
9 . 研究物质的结构,用来探寻物质的性质,是我们学习化学的重要方法。回答下列问题:
(1)Fe、Ru、Os在元素周期表中处于同一列,人们已经发现和应用了Ru、Os的四氧化物,Ru、Os体现+8价。量子化学理论预测铁也存在四氧化物,但最终人们发现铁的化合价不是+8而是+6.你预测铁的“四氧化物”分子的结构式为___________ 。
(2)氰酸铵( )是一种铵盐,除氢原子外,各原子均满足8电子稳定结构,且无双键存在,请写出氰酸铵的电子式
)是一种铵盐,除氢原子外,各原子均满足8电子稳定结构,且无双键存在,请写出氰酸铵的电子式___________ 。
(3)抗坏血酸(结构简式如图所示)易溶于水的主要原因___________ 。

(4)氢键的本质是缺电子的氢原子和富电子的原子或原子团之间的一种弱的电性作用。近年来,人们发现了双氢键,双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性相互作用。下列不可能形成双氢键的是___________ 。(已知电负性:H-2.1 Be-1.5 B -2.0 N-3.0 O-3.5 Al-1.5 Si-1.8)
a.Be—H...H—O b.O—H...H—N c.B—H...H—N d.Si—H...H—Al
(5)冰晶石(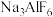 )主要用作电解氧化铝的助熔剂,也用作研磨产品的耐磨添加剂。
)主要用作电解氧化铝的助熔剂,也用作研磨产品的耐磨添加剂。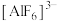 中Al原子处于6个F原子形成的正八面体中心,则中心原子周围的成键电子总数是
中Al原子处于6个F原子形成的正八面体中心,则中心原子周围的成键电子总数是___________ 个。
(1)Fe、Ru、Os在元素周期表中处于同一列,人们已经发现和应用了Ru、Os的四氧化物,Ru、Os体现+8价。量子化学理论预测铁也存在四氧化物,但最终人们发现铁的化合价不是+8而是+6.你预测铁的“四氧化物”分子的结构式为
(2)氰酸铵(
 )是一种铵盐,除氢原子外,各原子均满足8电子稳定结构,且无双键存在,请写出氰酸铵的电子式
)是一种铵盐,除氢原子外,各原子均满足8电子稳定结构,且无双键存在,请写出氰酸铵的电子式(3)抗坏血酸(结构简式如图所示)易溶于水的主要原因

(4)氢键的本质是缺电子的氢原子和富电子的原子或原子团之间的一种弱的电性作用。近年来,人们发现了双氢键,双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性相互作用。下列不可能形成双氢键的是
a.Be—H...H—O b.O—H...H—N c.B—H...H—N d.Si—H...H—Al
(5)冰晶石(
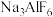 )主要用作电解氧化铝的助熔剂,也用作研磨产品的耐磨添加剂。
)主要用作电解氧化铝的助熔剂,也用作研磨产品的耐磨添加剂。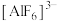 中Al原子处于6个F原子形成的正八面体中心,则中心原子周围的成键电子总数是
中Al原子处于6个F原子形成的正八面体中心,则中心原子周围的成键电子总数是
您最近一年使用:0次
名校
解题方法
10 . 下列说法正确的是
A. 是一种稳定的化合物,这是由于 是一种稳定的化合物,这是由于 分子之间形成氢键所致 分子之间形成氢键所致 |
| B.稀有气体原子最外层电子已达到饱和,不能与其它元素形成化合物 |
C. 是由离子构成的,其溶于水形成溶液的过程中既有离子键、共价键的断裂又有离子键、共价键的形成 是由离子构成的,其溶于水形成溶液的过程中既有离子键、共价键的断裂又有离子键、共价键的形成 |
D.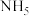 是既含有离子键又含有共价键的离子化合物,所有原子的最外层都符合同周期的稀有气体原子的最外层电子结构 是既含有离子键又含有共价键的离子化合物,所有原子的最外层都符合同周期的稀有气体原子的最外层电子结构 |
您最近一年使用:0次
2023-04-20更新
|
113次组卷
|
2卷引用:四川省广元中学2021-2022学年高二下学期第一次段考化学试题



