1 . 以粗盐和石英砂为原料制备纯碱和精硅的流程如下图所示,结合题意回答下列问题:
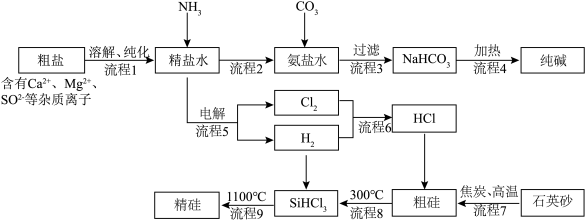
(1)流程1可在实验室完成,过程如下图所示,若只加一种试剂,则A化学式为________________ 。
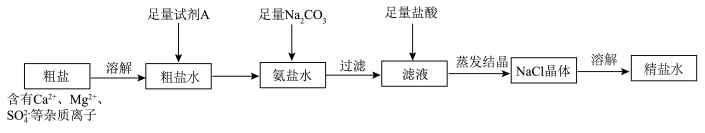
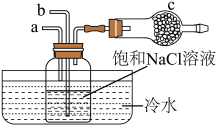
(2)流程2和流程3也可在实验室模拟完成,具体过程如图所示,则a口通入________________ 气体,c装置固体为________________ 。
(3)流程4生成的Na2CO3,其含有的化学键为________________ 。
(4)流程7的化学方程式________________ 。
(5)流程9整个制备过程必须严格控制无氧,若混入O2,可能引起的后果是________________ 。
(6)制得的精硅含有微量硼,会影响芯片性能。某实验室利用区域熔炼技术制高纯硅的装置剖面图如图1,将含微量杂质硼的硅晶棒装入石英保温管中,利用加热环自左向右缓慢移动对其进行加热熔炼,已知杂质硼在不同状态的硅中含量分布如图2所示。
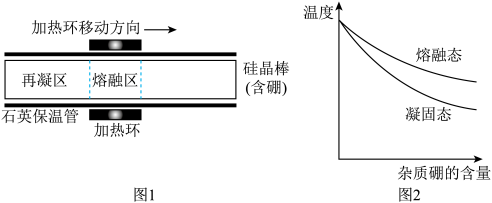
下列说法中错误的是________________。

(1)流程1可在实验室完成,过程如下图所示,若只加一种试剂,则A化学式为

(2)流程2和流程3也可在实验室模拟完成,具体过程如图所示,则a口通入

(3)流程4生成的Na2CO3,其含有的化学键为
(4)流程7的化学方程式
(5)流程9整个制备过程必须严格控制无氧,若混入O2,可能引起的后果是
(6)制得的精硅含有微量硼,会影响芯片性能。某实验室利用区域熔炼技术制高纯硅的装置剖面图如图1,将含微量杂质硼的硅晶棒装入石英保温管中,利用加热环自左向右缓慢移动对其进行加热熔炼,已知杂质硼在不同状态的硅中含量分布如图2所示。

下列说法中错误的是________________。
| A.混有杂质硼的硅晶棒熔点低于纯硅 |
| B.熔炼前,可以用普通玻璃管替换石英保温管 |
| C.熔炼时,加热环移动速度过快可能导致杂质硼分离不彻底 |
| D.熔炼后,硅晶棒纯度右端高于左端 |
您最近半年使用:0次
名校
解题方法
2 . (I)小明同学想通过比较两种最高价氧化物水化物的酸性强弱来验证S与C的非金属性的强弱,他查阅了资料:可以利用强酸制备弱酸的原理来判断酸性强弱。于是小明采用了下图所示的装置进行实验。请回答:

(1)仪器A的名称是________ ,应盛放下列药品中的__________ 。
a.稀硫酸 b.亚硫酸 c.氢硫酸 d.盐酸
(2)仪器B的名称是________ ,应盛放下列药品中的__________ 。
a.碳酸钙 b.硫酸钠 c.氯化钠 d.碳酸钠
(3)仪器C中盛放的药品是澄清石灰水,如果看到的现象是澄清石灰水变浑浊,证明B中发生反应生成了_____________ ,即可说明H2SO4 比H2CO3 酸性强,非金属性S比C强,B中发生反应的离子方程式为______________________________ 。
(II)(1)用电子式表示下列化合物的形成过程:
CaF2:_____________________________________________
H2S:______________________________________________
(2)有下列物质:①NaOH ②I2 ③MgCl2 ④Na2O2 ⑤氩气 回答下列问题:
①不存在化学键的是_________________________ ,
②既存在离子键又存在极性键的是__________________ 。

(1)仪器A的名称是
a.稀硫酸 b.亚硫酸 c.氢硫酸 d.盐酸
(2)仪器B的名称是
a.碳酸钙 b.硫酸钠 c.氯化钠 d.碳酸钠
(3)仪器C中盛放的药品是澄清石灰水,如果看到的现象是澄清石灰水变浑浊,证明B中发生反应生成了
(II)(1)用电子式表示下列化合物的形成过程:
CaF2:
H2S:
(2)有下列物质:①NaOH ②I2 ③MgCl2 ④Na2O2 ⑤氩气 回答下列问题:
①不存在化学键的是
②既存在离子键又存在极性键的是
您最近半年使用:0次
3 . A、B、C、D、E、F、G、H八种前四周期元素,原子序数依次增大,A、B、F三者原子序数之和为25,且知B、F同主族, 与G的气态氢化物的水溶液反应生成
与G的气态氢化物的水溶液反应生成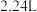 氢气
氢气 标准状况下
标准状况下 ,
,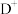 和E的离子具有相同的电子层结构,工业上用电解元素B和E能形成离子化合物的方法冶炼E单质,H元素常温下遇浓硫酸钝化,其一种核素质量数56,中子数30。试判断并回答下列问题:
和E的离子具有相同的电子层结构,工业上用电解元素B和E能形成离子化合物的方法冶炼E单质,H元素常温下遇浓硫酸钝化,其一种核素质量数56,中子数30。试判断并回答下列问题:
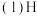 该元素在周期表中的位置
该元素在周期表中的位置__________ .
 由F、G二种元素形成化合物
由F、G二种元素形成化合物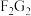 的电子式
的电子式______ ,含有化学键的类别为___________ .
 、C、F形成的最简单气态氢化物沸点由低到高的顺序依次为
、C、F形成的最简单气态氢化物沸点由低到高的顺序依次为________  用化学式表示
用化学式表示
 由A、B、D、F四种元素可以组成两种盐,写出这两种盐反应的离子方程式
由A、B、D、F四种元素可以组成两种盐,写出这两种盐反应的离子方程式__________
 在碱性条件下,G的单质可与
在碱性条件下,G的单质可与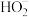 反应制备一种可用于净水的盐
反应制备一种可用于净水的盐 ,该反应的离子方程式是
,该反应的离子方程式是_______ .
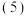 熔融盐燃料电池用熔融的碳酸盐作为电解质,负极充入燃料气
熔融盐燃料电池用熔融的碳酸盐作为电解质,负极充入燃料气 ,用空气与
,用空气与 的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。写出充入
的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。写出充入 的一极发生反应的电极反应式
的一极发生反应的电极反应式______ 。
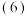 利用上述燃料电池,按图1所示装置进行电解,A、B、C、D均为铂电极,
利用上述燃料电池,按图1所示装置进行电解,A、B、C、D均为铂电极,
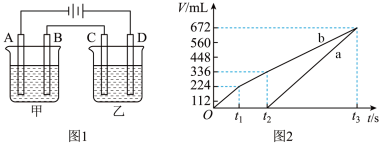
Ⅰ 甲槽电解的是
甲槽电解的是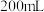 一定浓度的NaCl与
一定浓度的NaCl与 的混合溶液,理论上两极所得气体的体积随时间变化的关系如图2所示
的混合溶液,理论上两极所得气体的体积随时间变化的关系如图2所示 气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计
气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计 。
。 的物质的量浓度为
的物质的量浓度为________  。
。
Ⅱ 乙槽为
乙槽为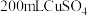 溶液,通电一段时间,当C极析出
溶液,通电一段时间,当C极析出 物质时停止通电,若使乙槽内的溶液完全复原,可向乙槽中加入
物质时停止通电,若使乙槽内的溶液完全复原,可向乙槽中加入________  填字母
填字母 。
。
A. B.
B. C.
C. D.
D.
 若通电一段时间后,向所得的乙槽溶液中加入
若通电一段时间后,向所得的乙槽溶液中加入 的
的 才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为
才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为________ 。
 与G的气态氢化物的水溶液反应生成
与G的气态氢化物的水溶液反应生成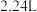 氢气
氢气 标准状况下
标准状况下 ,
,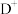 和E的离子具有相同的电子层结构,工业上用电解元素B和E能形成离子化合物的方法冶炼E单质,H元素常温下遇浓硫酸钝化,其一种核素质量数56,中子数30。试判断并回答下列问题:
和E的离子具有相同的电子层结构,工业上用电解元素B和E能形成离子化合物的方法冶炼E单质,H元素常温下遇浓硫酸钝化,其一种核素质量数56,中子数30。试判断并回答下列问题: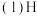 该元素在周期表中的位置
该元素在周期表中的位置 由F、G二种元素形成化合物
由F、G二种元素形成化合物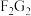 的电子式
的电子式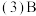 、C、F形成的最简单气态氢化物沸点由低到高的顺序依次为
、C、F形成的最简单气态氢化物沸点由低到高的顺序依次为 用化学式表示
用化学式表示
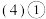 由A、B、D、F四种元素可以组成两种盐,写出这两种盐反应的离子方程式
由A、B、D、F四种元素可以组成两种盐,写出这两种盐反应的离子方程式 在碱性条件下,G的单质可与
在碱性条件下,G的单质可与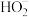 反应制备一种可用于净水的盐
反应制备一种可用于净水的盐 ,该反应的离子方程式是
,该反应的离子方程式是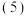 熔融盐燃料电池用熔融的碳酸盐作为电解质,负极充入燃料气
熔融盐燃料电池用熔融的碳酸盐作为电解质,负极充入燃料气 ,用空气与
,用空气与 的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。写出充入
的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。写出充入 的一极发生反应的电极反应式
的一极发生反应的电极反应式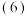 利用上述燃料电池,按图1所示装置进行电解,A、B、C、D均为铂电极,
利用上述燃料电池,按图1所示装置进行电解,A、B、C、D均为铂电极,
Ⅰ
 甲槽电解的是
甲槽电解的是 一定浓度的NaCl与
一定浓度的NaCl与 的混合溶液,理论上两极所得气体的体积随时间变化的关系如图2所示
的混合溶液,理论上两极所得气体的体积随时间变化的关系如图2所示 气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计
气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计 。
。 的物质的量浓度为
的物质的量浓度为 。
。Ⅱ
 乙槽为
乙槽为 溶液,通电一段时间,当C极析出
溶液,通电一段时间,当C极析出 物质时停止通电,若使乙槽内的溶液完全复原,可向乙槽中加入
物质时停止通电,若使乙槽内的溶液完全复原,可向乙槽中加入 填字母
填字母 。
。A.
 B.
B. C.
C. D.
D.
 若通电一段时间后,向所得的乙槽溶液中加入
若通电一段时间后,向所得的乙槽溶液中加入 的
的 才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为
才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为
您最近半年使用:0次
名校
4 . 氮化钙(Ca3N2)是一种重要的化工试剂,遇水剧烈水解。实验室可由氮气和钙加热制得氮化钙,实验装置如下图(省略部分固定装置)。
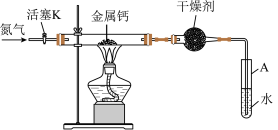
(1)氮化钙中所含的化学键有(填“共价键”或“离子键”)_________ 。
(2)球形干燥管中的干燥剂可选用(至少写一种)_________ ,结合化学方程式解释其作用_________ 。
(3)制备过程中末端导管必须始终插入试管A的水中,目的是①便于观察N2的流速;②_________ 。
(4)制备氮化钙的操作步骤:①按图示连接好实验装置;②_________ ;③打开活塞K并通入N2;④点燃酒精灯,进行反应;⑤反应结束后,熄灭酒精灯,继续通N2,使装置冷却至室温;⑥拆除装置,取出产物。
(5)上述步骤中③和④_________ (填“能”或“不能”)交换,理由是_________ 。
(6)氮气不足会影响实验制得Ca3N2的纯度。为测定氮化钙的纯度,实验结束后取一定量的固体混合物于足量水中,微热使气体完全逸出,收集到气体共6.72 L(已折算到标准状况),将该气体通入装有足量灼热CuO的硬质玻璃管中充分反应,测得硬质玻璃管中固体质量减轻6.4 g。则Ca3N2的纯度为_________ (用百分数表示,保留一位小数)(注:氨气能被灼热氧化铜氧化,生成一种对环境无污染气体)。

(1)氮化钙中所含的化学键有(填“共价键”或“离子键”)
(2)球形干燥管中的干燥剂可选用(至少写一种)
(3)制备过程中末端导管必须始终插入试管A的水中,目的是①便于观察N2的流速;②
(4)制备氮化钙的操作步骤:①按图示连接好实验装置;②
(5)上述步骤中③和④
(6)氮气不足会影响实验制得Ca3N2的纯度。为测定氮化钙的纯度,实验结束后取一定量的固体混合物于足量水中,微热使气体完全逸出,收集到气体共6.72 L(已折算到标准状况),将该气体通入装有足量灼热CuO的硬质玻璃管中充分反应,测得硬质玻璃管中固体质量减轻6.4 g。则Ca3N2的纯度为
您最近半年使用:0次
2019-02-26更新
|
392次组卷
|
3卷引用:四川省成都石室中学2019届高三下学期2月开学考试理科综合化学试题



