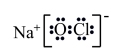名校
1 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。下列说法正确的是


| A.D中含有的化学键类型只有离子键 |
| B.将E溶液滴入碳酸氢钠溶液中,有大量气泡产生 |
| C.A、B、C均属于电解质 |
| D.C的酸性和氧化性均强于E |
您最近半年使用:0次
名校
2 . 设NA表示阿伏加德罗常数的数值,下列对应关系正确 的是
| A.14gC2H4和C3H6的混合物含2NA个共用电子对 |
| B.6gH2与过量的N2反应生成的NH3的数目为2NA |
| C.标准状况下,11.2LCCl4中含有原子的数目为2.5NA |
D.0.5mol 分子中极性键数目为4NA 分子中极性键数目为4NA |
您最近半年使用:0次
2022-03-28更新
|
78次组卷
|
2卷引用:福建省厦门外国语学校石狮分校2021-2022学年高二下学期3月月考化学试题
名校
3 . 表中相关物质的信息都正确的一项是
| 选项 | 化学式 | 电子式或含有的化学键类型 | 物质的性质 | 与性质相对应的用途 |
| A |  | 离子键、共价键 | 强氧化性 | 消毒液 |
| B |  | 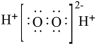 | 不稳定,易分解 | 医用消毒剂 |
| C | W(钨) | 金属键 | 银白色,具有金属光泽 | 制成灯丝 |
| D |  | 离子键 | 受热易分解 | 治疗胃酸过多 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
4 . C、N、O、F等元素的化合物在航天、美容、食品等多领域中有广泛的用途,请回答:
(1)OF2主要用于火箭工程液体助燃剂,该分子的空间结构为______ ;N、O、F的第一电离能由大到小的顺序为_____ (用元素符号表示)。
(2)XeF2是一种选择性很好的氟化试剂,但在室温下易升华,推测XeF2为______ 晶体(填晶体类型)。
(3)FeSO4是一种重要的食品和饲料添加剂:
①Fe在周期表中位于第______ 周期第______ 族。
②FeSO4·7H2O的结构示意图如图所示,H2O与Fe2+、SO 的作用类型分别是
的作用类型分别是______ 、______ 。
A.离子键 B.配位键 C.氢键 D.金属键
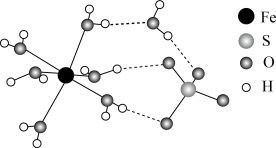
③比较H2O分子和SO 中键角的大小并解释原因:
中键角的大小并解释原因:______ 。
(1)OF2主要用于火箭工程液体助燃剂,该分子的空间结构为
(2)XeF2是一种选择性很好的氟化试剂,但在室温下易升华,推测XeF2为
(3)FeSO4是一种重要的食品和饲料添加剂:
①Fe在周期表中位于第
②FeSO4·7H2O的结构示意图如图所示,H2O与Fe2+、SO
 的作用类型分别是
的作用类型分别是A.离子键 B.配位键 C.氢键 D.金属键

③比较H2O分子和SO
 中键角的大小并解释原因:
中键角的大小并解释原因:
您最近半年使用:0次
2023高三·全国·专题练习
解题方法
5 . 铁、钛、镁等金属及其化合物有广泛用途。回答下列问题:
(1)基态Ti原子的价层电子排布图是_______ ,基态Fe原子共有_______ 种不同能级的电子。
(2)某含钛半夹心结构催化剂R能催化乙烯、丙烯等的聚合,其结构如图所示:
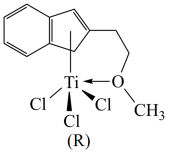
①组成R的元素中,电负性最大的是_______ (填元素符号),氧原子的杂化方式是_______ 。
②R中含有的化学键有_______ (填字母)。
A. 键 B.
键 B. 键 C.离子键 D.配位键 E.金属键
键 C.离子键 D.配位键 E.金属键
(1)基态Ti原子的价层电子排布图是
(2)某含钛半夹心结构催化剂R能催化乙烯、丙烯等的聚合,其结构如图所示:

①组成R的元素中,电负性最大的是
②R中含有的化学键有
A.
 键 B.
键 B. 键 C.离子键 D.配位键 E.金属键
键 C.离子键 D.配位键 E.金属键
您最近半年使用:0次
解题方法
6 . 氯及其化合物在生产生活中有着重要用途。请回答下列问题:
(1)下列与氯元素同一主族的元素是____ 。
a.Br b.Sr c.F d.B
(2)下列含氯物质:①CCl4②Cl2③CaCl2④NaClO⑤HClO4⑥NH4Cl⑦HCl,其中只含有离子键的是_____ (填序号);只含有共价键的是____ (填序号);属于强电解质的是____ (填序号)。
(3)将氯气通入到NaBr溶液中,发生反应的离子方程式为____ 。
(4)亚硝酸钠与氯化铵共热能发生反应,其化学方程式为:NaNO2+NH4Cl NaCl+X↑+2H2O,则X的化学式为
NaCl+X↑+2H2O,则X的化学式为____ 。该化学方程式里的含氮物质中,氮元素未表现出的化合价为____ 价(填序号)。
A.+3 B.-3 C.0 D.+5
(1)下列与氯元素同一主族的元素是
a.Br b.Sr c.F d.B
(2)下列含氯物质:①CCl4②Cl2③CaCl2④NaClO⑤HClO4⑥NH4Cl⑦HCl,其中只含有离子键的是
(3)将氯气通入到NaBr溶液中,发生反应的离子方程式为
(4)亚硝酸钠与氯化铵共热能发生反应,其化学方程式为:NaNO2+NH4Cl
 NaCl+X↑+2H2O,则X的化学式为
NaCl+X↑+2H2O,则X的化学式为A.+3 B.-3 C.0 D.+5
您最近半年使用:0次
名校
解题方法
7 . 回答下列问题
(1)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2取代形成的另一种氮的氢化物。
① NH3分子的空间结构是_______ ;N2H4分子中氮原子轨道的杂化类型是 _______ 。
② 肼可用作火箭燃料,燃烧时发生的反应是N2O4(l) + 2N2H4(l)=3N2(g) + 4H2O(g) ΔH= -1038.7 kJ·mol-1,若该反应中有4 mol N-H断裂,则形成的 π 键有_______ mol。
③ 肼能与硫酸反应生成N2H6SO4,N2H6SO4与硫酸铵化合物类型相同,则N2H6SO4晶体不存在_______ (填标号)。
a. 离子键 b. 共价键 c. 范德华力
(2)第ⅥA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。请回答下列问题:
① H2Se的还原性比H2S_______ (填“强”或“弱”)。气态SeO3分子的空间结构为_______ ,SO2的VSEPR模型为_______ ,空间结构为_______ 。
② H2O内的O-H、水分子间的范德华力和氢键,从强到弱依次为_______ ,H+可与H2O形成H3O+,H3O+中O采用_______ 杂化,H3O+中H-O-H键角比H2O中的_______ (填“大”或“小”)
(1)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2取代形成的另一种氮的氢化物。
① NH3分子的空间结构是
② 肼可用作火箭燃料,燃烧时发生的反应是N2O4(l) + 2N2H4(l)=3N2(g) + 4H2O(g) ΔH= -1038.7 kJ·mol-1,若该反应中有4 mol N-H断裂,则形成的 π 键有
③ 肼能与硫酸反应生成N2H6SO4,N2H6SO4与硫酸铵化合物类型相同,则N2H6SO4晶体不存在
a. 离子键 b. 共价键 c. 范德华力
(2)第ⅥA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。请回答下列问题:
① H2Se的还原性比H2S
② H2O内的O-H、水分子间的范德华力和氢键,从强到弱依次为
您最近半年使用:0次
2022-07-30更新
|
338次组卷
|
2卷引用:天津市第三中学2021-2022学年高二下学期期末质量检测化学试题
8 . 金属锂及其化合物用途广泛。在“氮的固定”中其转化过程如图所示,下列说法错误的是


| A.该转化过程Li,Li3N,LiOH均为中间产物 |
| B.过程I发生了共价键的断裂和离子键的形成 |
| C.过程II发生复分解反应,不涉及电子转移 |
| D.该转化过程总反应为2N2+6H2O=4NH3+3O2 |
您最近半年使用:0次
2021·全国·模拟预测
9 . 下表中相关物质的信息都正确的一项是
选项 | 化学式 | 电子式或含有的化学键类型 | 物质的性质 | 与性质相对应的用途 |
A | NaClO |
| 强氧化性 | 消毒液 |
B | H2O2 |
| 不稳定,易分解 | 医用消毒剂 |
C | NH3 | 共价键 | 水溶液呈弱碱性 | 工业制硝酸 |
D | KAl(SO4)2 | 离子键 | 易水解 | 净水 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
10 . 卤族元素的化合物在生活、医药、化工中有着重要的用途。
I.过氧化氢氧化法制备碘酸钾(KIO3)的方法如图:

(1)氧原子核外有_______ 种运动状态不同的电子;碘原子最外层电子的排布式为_______ ;K2CO3固体中含有的化学键有_______ 。
(2)合成步骤中的化学方程式为_______ 。
(3)当合成温度高于70℃,碘酸钾产率会降低,请写出可能的两种原因:_______ 。
Ⅱ.ClO2和Cl2都可以用于自来水消毒杀菌,可以通过下列方法制取:
2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
(4)该反应的氧化产物为_______ ,若反应过程中有4 mol HCl参与反应,则电子转移的数目为_______ 。
Ⅲ.目前从海水中提溴(Br2)大致有“浓缩”、“氧化”、“提取”等步骤。
(5)向浓缩的海水中通入Cl2,将海水中的Br-氧化为Br2。“氧化”时先在卤水中加入硫酸酸化,然后再通入氯气,硫酸酸化可以提高氯气的利用率,原因是_______ 。
(6)用热空气将Br2从上述溶液中吹出,并由浓Na2CO3溶液吸收,转变为NaBr、NaBrO3和CO2。吸收1 mol Br2需消耗Na2CO3_______ mol。
I.过氧化氢氧化法制备碘酸钾(KIO3)的方法如图:

(1)氧原子核外有
(2)合成步骤中的化学方程式为
(3)当合成温度高于70℃,碘酸钾产率会降低,请写出可能的两种原因:
Ⅱ.ClO2和Cl2都可以用于自来水消毒杀菌,可以通过下列方法制取:
2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
(4)该反应的氧化产物为
Ⅲ.目前从海水中提溴(Br2)大致有“浓缩”、“氧化”、“提取”等步骤。
(5)向浓缩的海水中通入Cl2,将海水中的Br-氧化为Br2。“氧化”时先在卤水中加入硫酸酸化,然后再通入氯气,硫酸酸化可以提高氯气的利用率,原因是
(6)用热空气将Br2从上述溶液中吹出,并由浓Na2CO3溶液吸收,转变为NaBr、NaBrO3和CO2。吸收1 mol Br2需消耗Na2CO3
您最近半年使用:0次