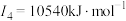1 . 我国硒储量居世界首位,硒广泛用于冶金、陶瓷、电子、太阳能等领域。工业上常将含硒废料处理得到亚硒酸(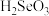 )和硒酸(
)和硒酸(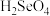 ),进而制备单质硒。
),进而制备单质硒。
(1)基态硒原子核外电子的空间运动状态有________ 种。
(2)甲硒醇(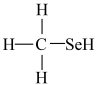 )的熔沸点低于甲醇(
)的熔沸点低于甲醇(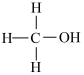 ),原因是
),原因是________________ 。
(3) 亚硒酸溶液中含硒微粒的分布系数
亚硒酸溶液中含硒微粒的分布系数 与溶液
与溶液 的关系如图所示。(分布系数即各组分的平衡浓度占总浓度的分数)
的关系如图所示。(分布系数即各组分的平衡浓度占总浓度的分数)
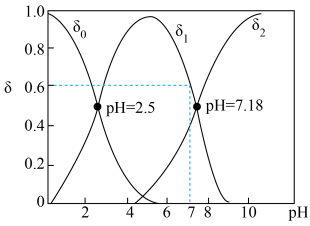
①曲线 表示的含硒微粒是
表示的含硒微粒是________ 。
②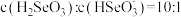 ,溶液
,溶液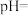
________ 。
③向溶液中滴入氨水, 由5.5增大到7.3的过程中,主要反应的离子方程式为
由5.5增大到7.3的过程中,主要反应的离子方程式为________________ , 时,溶液中
时,溶液中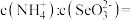
_______ 。
④在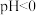 的酸性环境下,向溶液中通入
的酸性环境下,向溶液中通入 制得单质
制得单质 的离子方程式为
的离子方程式为________________ 。
(4) 可以用于测定粗硒中硒的含量,操作步骤如下:
可以用于测定粗硒中硒的含量,操作步骤如下:
Ⅰ.用浓 将样品中的
将样品中的 氧化为
氧化为 ;
;
Ⅱ.用 溶液还原
溶液还原 为
为 ,同时生成
,同时生成 ;
;
Ⅲ.以淀粉为指示剂,用 标准溶液滴定Ⅱ中生成的
标准溶液滴定Ⅱ中生成的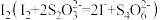 。
。
实验中准确称量 粗硒样品,滴定中消耗
粗硒样品,滴定中消耗 的
的 标准溶液
标准溶液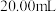 。
。
①滴定终点的现象为________ 。
②粗硒样品中硒的质量分数为________ 。
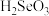 )和硒酸(
)和硒酸(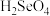 ),进而制备单质硒。
),进而制备单质硒。(1)基态硒原子核外电子的空间运动状态有
(2)甲硒醇(
 )的熔沸点低于甲醇(
)的熔沸点低于甲醇( ),原因是
),原因是(3)
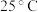 亚硒酸溶液中含硒微粒的分布系数
亚硒酸溶液中含硒微粒的分布系数 与溶液
与溶液 的关系如图所示。(分布系数即各组分的平衡浓度占总浓度的分数)
的关系如图所示。(分布系数即各组分的平衡浓度占总浓度的分数)
①曲线
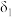 表示的含硒微粒是
表示的含硒微粒是②
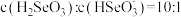 ,溶液
,溶液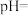
③向溶液中滴入氨水,
 由5.5增大到7.3的过程中,主要反应的离子方程式为
由5.5增大到7.3的过程中,主要反应的离子方程式为 时,溶液中
时,溶液中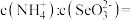
④在
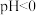 的酸性环境下,向溶液中通入
的酸性环境下,向溶液中通入 制得单质
制得单质 的离子方程式为
的离子方程式为(4)
 可以用于测定粗硒中硒的含量,操作步骤如下:
可以用于测定粗硒中硒的含量,操作步骤如下:Ⅰ.用浓
 将样品中的
将样品中的 氧化为
氧化为 ;
; Ⅱ.用
 溶液还原
溶液还原 为
为 ,同时生成
,同时生成 ;
;Ⅲ.以淀粉为指示剂,用
 标准溶液滴定Ⅱ中生成的
标准溶液滴定Ⅱ中生成的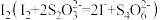 。
。实验中准确称量
 粗硒样品,滴定中消耗
粗硒样品,滴定中消耗 的
的 标准溶液
标准溶液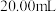 。
。①滴定终点的现象为
②粗硒样品中硒的质量分数为
您最近一年使用:0次
2010·上海浦东新·一模
解题方法
2 . 现有部分短周期元素的性质或结构如下表:
(1)X原子中电子运动状态共有____ 种。Z元素最简单的气态氢化物分子的空间构型是___ 。
(2)写出Y元素最高价氧化物对应水化物的电离方程式____________ 。
(3)下列说法能证明M、Z、X三种元素形成的化合物属于离子化合物的是______ 。
a.熔点比氯化钠高 b.水溶液能导电 c.液态时能导电 d.固体能导电
(4)与X同周期且非金属性强于X的元素是______ (填元素名称),写出能说明这一事实的化学方程式___________ 。
| 元素编号 | 元素性质或结构 |
| X | 海水中质量分数最大的元素,其氢化物是最常用的溶剂 |
| Y | 地壳中含量最多的金属元素 |
| Z | 形成化合物最多的元素 |
| M | 短周期主族元素中原子半径最大的元素 |
(2)写出Y元素最高价氧化物对应水化物的电离方程式
(3)下列说法能证明M、Z、X三种元素形成的化合物属于离子化合物的是
a.熔点比氯化钠高 b.水溶液能导电 c.液态时能导电 d.固体能导电
(4)与X同周期且非金属性强于X的元素是
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
3 . 根据信息,回答下列问题。
I.铜及其化合物在生产、生活中有着广泛应用。最近科学家开发出石墨炔调控Cu单原子电催化剂(Cu1)实现CO2还原制备CH4,反应式为CO2(g)+4H2(g) CH4(g)+2H2O(g)。
CH4(g)+2H2O(g)。
(1)基态Cu原子的未成对电子占据原子轨道的形状为_______ 。
(2)上述反应涉及的化合物中,VSEPR模型和空间结构相同,且为非极性分子的是_______ (填分子式)。
Ⅱ.甘氨酸亚铁晶体是一种新型的固体螯合补铁剂。其实验室合成路线如下:
(3)写出上述合成路线中生成FeCO3沉淀的离子方程式:_______ 。
(4)甘氨酸亚铁晶体结构的分析。
步骤1:准确称取甘氨酸亚铁晶体纯品0.4800g于锥形瓶中,加3mol·L-1H2SO4溶液15mL将样品溶解完全后,加入指示剂,立即用0.1000mol·L-1(NH4)2Ce(SO4)3标准液滴定至终点,用去标准液20.20mL(离子方程式为Ce4++Fe2+=Ce3++Fe3+)。
步骤2:不加产品,重复步骤1操作,滴定至终点,用去标准液0.20mL。
①滴定时应选择_______ 滴定管。
②进一步分析表明:甘氨酸亚铁晶体中,阴阳离子只有H2NCH2COO-和Fe2+,且含2个结晶水;Fe2+的配位数为6,且存在五元螯合环;该配合物整体是中心对称,则甘氨酸亚铁晶体的结构示意图为_______ 。
③计算甘氨酸亚铁晶体中铁元素的质量分数____ (用百分数表示,保留小数点后一位,写出计算过程)。
I.铜及其化合物在生产、生活中有着广泛应用。最近科学家开发出石墨炔调控Cu单原子电催化剂(Cu1)实现CO2还原制备CH4,反应式为CO2(g)+4H2(g)
 CH4(g)+2H2O(g)。
CH4(g)+2H2O(g)。(1)基态Cu原子的未成对电子占据原子轨道的形状为
(2)上述反应涉及的化合物中,VSEPR模型和空间结构相同,且为非极性分子的是
Ⅱ.甘氨酸亚铁晶体是一种新型的固体螯合补铁剂。其实验室合成路线如下:
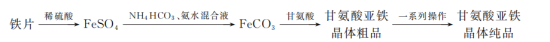
(3)写出上述合成路线中生成FeCO3沉淀的离子方程式:
(4)甘氨酸亚铁晶体结构的分析。
步骤1:准确称取甘氨酸亚铁晶体纯品0.4800g于锥形瓶中,加3mol·L-1H2SO4溶液15mL将样品溶解完全后,加入指示剂,立即用0.1000mol·L-1(NH4)2Ce(SO4)3标准液滴定至终点,用去标准液20.20mL(离子方程式为Ce4++Fe2+=Ce3++Fe3+)。
步骤2:不加产品,重复步骤1操作,滴定至终点,用去标准液0.20mL。
①滴定时应选择
②进一步分析表明:甘氨酸亚铁晶体中,阴阳离子只有H2NCH2COO-和Fe2+,且含2个结晶水;Fe2+的配位数为6,且存在五元螯合环;该配合物整体是中心对称,则甘氨酸亚铁晶体的结构示意图为
③计算甘氨酸亚铁晶体中铁元素的质量分数
您最近一年使用:0次
名校
4 . X、Y、Z、W为原子序数依次增大的前20号主族元素,且四种元素的原子序数之和为43.X元素被称为“元素之母”,Y的单质是空气中含量最多的成分,W焰色试验的颜色为砖红色。下列说法正确的是
| A.X和W均为元素周期表中的p区元素 |
| B.Y、Z的氧化物对应的水化物均为强酸 |
| C.X和Y形成的二元化合物常温常压下均为气态 |
| D.W所在周期基态原子最高能层电子数为1的元素有3种 |
您最近一年使用:0次
5 . 甘蔗含糖量十分丰富,其中蔗糖(结构如图所示)、葡萄糖及果糖的含量可达12%,它们极易被人体吸收利用。下列说法正确的是
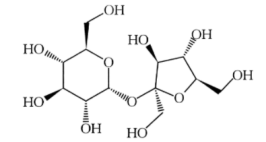
| A.蔗糖不能使酸性高锰酸钾溶液褪色 |
| B.葡萄糖和果糖互为同分异构体 |
| C.蔗糖分子中碳元素含量最高 |
| D.基态氢原子中电子云轮廓图形状为哑铃形 |
您最近一年使用:0次
2024-05-03更新
|
214次组卷
|
3卷引用:湖南省长沙市第一中学、长沙市一中城南中学等多校2023-2024学年高二下学期期中考试化学试题
湖南省长沙市第一中学、长沙市一中城南中学等多校2023-2024学年高二下学期期中考试化学试题广东省部分学校2023-2024学年高二下学期期中联考化学试题(已下线)猜想07 生物大分子、合成高分子【考题猜想】(8大题型)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)
名校
解题方法
6 . 现有A、B、C、D、E、F、G、H八种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
A元素的核外电子数和电子层数相等,也是宇宙中含量最丰富的元素 |
B元素是形成化合物种类最多的元素 |
C元素基态原子的核外p电子数比s电子数少1 |
D元素基态原子的核外p轨道中有两个未成对电子 |
E元素的气态基态原子的第一至第四电离能分别如下:
|
F元素的主族序数与周期数的差为4 |
G元素是前四周期中电负性最小的元素 |
H元素位于元素周期表中的第八纵列 |
(1)C2A4的电子式为
(2)B元素的原子核外共有
(3)E元素基态原子的电离能I3远远大于I2,其原因是
(4)B、C、D、E四种元素的第一电离能由大到小的顺序是
(5)用惰性电极电解EF2的水溶液的离子方程式为
(6)H位于元素周期表中
您最近一年使用:0次
解题方法
7 . X、Y、Z、M、Q为原子序数依次增大的短周期主族元素,X在电池能源领域有重要而广泛的用途,Y的价层空轨道数目是半充满轨道数目的一半,Z的一种单质是常见的消毒剂,M与X为同主族元素,Q是地壳中含量最多的金属元素,下列说法不正确 的是
| A.X的2s电子云比1s电子云更扩散 |
| B.Z与Q形成的晶体是典型的分子晶体 |
| C.五种元素的原子中第一电离能最高的是Z |
| D.最高价氧化物对应水化物的酸性:Y>Q |
您最近一年使用:0次
8 . 下图所示的漂白剂可用于漂白羊毛,其中W、Y、Z为不同周期不同主族的短周期元素,Y的最高能层的p能级上只有一个单电子,X是地壳中含量最多的元素。W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述正确的是
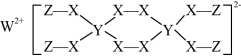
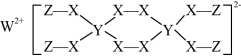
| A.Y元素的第一电离能介于同周期相邻元素的第一电离能之间 |
| B.元素Y的氟化物分子为极性分子 |
| C.基态W原子核外电子的空间运动状态有6种 |
D.该漂白剂的漂白原理与 漂白纸浆相同 漂白纸浆相同 |
您最近一年使用:0次
名校
解题方法
9 . 2020年9月科学家发现金星上有磷化氢( ),实验室制备
),实验室制备 的常用方法有两种:
的常用方法有两种:
①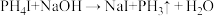
②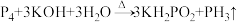
完成下列填空:
(1)P核外能量最高的电子具有相同的___________ (填写序号)。
A.轨道B.自旋方向C.电子云形状D.电子云伸展反应
(2)已知 与
与 的结构相似,
的结构相似, 的空间结构是
的空间结构是___________ 。 的分解温度比
的分解温度比
___________ (填“高”、“低”),判断的依据是___________ 。
(3)已知 为三元酸,其结构式为:
为三元酸,其结构式为: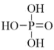 。
。
①次磷酸(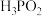 中的P的成键情况与
中的P的成键情况与 中的相同,则
中的相同,则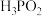 的结构式是
的结构式是___________ 。
②利用反应②制备 时,即使KOH过量,仍只生成
时,即使KOH过量,仍只生成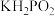 ,说明
,说明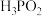 是
是___________ 元酸。
(4)常温下, 在不同pH的溶液中,各种含磷微粒的质量分数如图所示。
在不同pH的溶液中,各种含磷微粒的质量分数如图所示。

①电离平衡常数与化学平衡常数意义相同,写出 第二步电离平衡常数表达式
第二步电离平衡常数表达式
___________ 。
(2)图中可推断 溶液呈
溶液呈___________ (填“酸”、“碱”、“中”)性,可能的原因是___________ 。 溶液中各含磷微粒以及
溶液中各含磷微粒以及 按浓度由大到小的顺序排列
按浓度由大到小的顺序排列___________ 。
 ),实验室制备
),实验室制备 的常用方法有两种:
的常用方法有两种:①
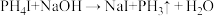
②
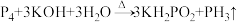
完成下列填空:
(1)P核外能量最高的电子具有相同的
A.轨道B.自旋方向C.电子云形状D.电子云伸展反应
(2)已知
 与
与 的结构相似,
的结构相似, 的空间结构是
的空间结构是 的分解温度比
的分解温度比
(3)已知
 为三元酸,其结构式为:
为三元酸,其结构式为: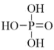 。
。①次磷酸(
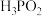 中的P的成键情况与
中的P的成键情况与 中的相同,则
中的相同,则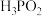 的结构式是
的结构式是②利用反应②制备
 时,即使KOH过量,仍只生成
时,即使KOH过量,仍只生成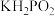 ,说明
,说明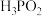 是
是(4)常温下,
 在不同pH的溶液中,各种含磷微粒的质量分数如图所示。
在不同pH的溶液中,各种含磷微粒的质量分数如图所示。
①电离平衡常数与化学平衡常数意义相同,写出
 第二步电离平衡常数表达式
第二步电离平衡常数表达式
(2)图中可推断
 溶液呈
溶液呈 溶液中各含磷微粒以及
溶液中各含磷微粒以及 按浓度由大到小的顺序排列
按浓度由大到小的顺序排列
您最近一年使用:0次
2021-04-02更新
|
224次组卷
|
4卷引用:上海市杨浦区2020-2021学年度高三下学期高中等级考模拟质量调研(3月)化学试题
上海市杨浦区2020-2021学年度高三下学期高中等级考模拟质量调研(3月)化学试题上海市杨浦区2021届高三二模化学试题河北省张家口宣化一中2021届高三下学期阶段模拟(六)化学试题(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(上海卷)
2014·上海松江·三模
解题方法
10 . 地球化学中,通常用热重分析研究矿物在受热时的质量变化以确定其组成。取66.6 mg由高岭石[Al4Si4O10(OH)8]和方解石(CaCO3)组成的矿物,加热到673K~1123K区间内分解为氧化物,样品总失重13.8 mg。高岭石受热分解反应方程式:Al4Si4O10(OH)8 →2Al2O3+4SiO2+4H2O
(1)硅原子核外电子排布在____ 个不同的电子层中,核外最外层电子分布在____ 个不同的轨道中。
(2)硅与铝同周期且相邻,化学性质有相似性,写出Si与NaOH溶液反应的化学方程式________ 。
(3)高岭石是长石的一种,不同类长石其氧原子的物质的量分数相同。由钙长石化学式CaAl2Si2O8可推知钠长石的化学式为_________________ 。
(4)此矿物中高岭石的质量分数为____________ 。
a. 44% b. 56% c. 77.5% d. 80%
(5)若对高岭土进行煅烧活化,然后利用盐酸进行分解,对于分解出的氯化铝溶液及二氧化硅再分别加入碱溶液进行去杂提纯,最后得到的氯化铝溶液可制备氧化铝。写出由氯化铝溶液得到纯净氧化铝的化学反应方程式(要求最节约):_____________________ 。
(6)用焦炭与石英砂(SiO2)混合高温,产生粗硅,现由两种方法将粗硅提纯:
第一种方法:Si+2Cl2 SiCl4 SiCl4+2H2
SiCl4 SiCl4+2H2 Si+4HCl
Si+4HCl
第二种方法:Si+3HCl SiHCl3 SiHCl3+H2
SiHCl3 SiHCl3+H2 Si+3HCl。
Si+3HCl。
工业上常用第二种方法来提纯单晶硅,其原因是_________________ 。
(1)硅原子核外电子排布在
(2)硅与铝同周期且相邻,化学性质有相似性,写出Si与NaOH溶液反应的化学方程式
(3)高岭石是长石的一种,不同类长石其氧原子的物质的量分数相同。由钙长石化学式CaAl2Si2O8可推知钠长石的化学式为
(4)此矿物中高岭石的质量分数为
a. 44% b. 56% c. 77.5% d. 80%
(5)若对高岭土进行煅烧活化,然后利用盐酸进行分解,对于分解出的氯化铝溶液及二氧化硅再分别加入碱溶液进行去杂提纯,最后得到的氯化铝溶液可制备氧化铝。写出由氯化铝溶液得到纯净氧化铝的化学反应方程式(要求最节约):
(6)用焦炭与石英砂(SiO2)混合高温,产生粗硅,现由两种方法将粗硅提纯:
第一种方法:Si+2Cl2
 SiCl4 SiCl4+2H2
SiCl4 SiCl4+2H2 Si+4HCl
Si+4HCl第二种方法:Si+3HCl
 SiHCl3 SiHCl3+H2
SiHCl3 SiHCl3+H2 Si+3HCl。
Si+3HCl。工业上常用第二种方法来提纯单晶硅,其原因是
您最近一年使用:0次

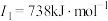 ,
,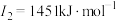 ,
,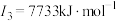 ,
,