名校
解题方法
1 . 我国科学家利用锰簇催化剂(Mn4CaOx,x代表氧原子数)解密光合作用。锰簇的可逆结构异构化反应如图:
(1)基态钙原子中能量最高的电子所占据原子轨道的电子云轮廓图为_______ 形。
(2)已知:在元素周期表中Mn、Cr相邻,第二电离能与第一电离能之差较小的是_______ (填“Mn”或“Cr”),理由是_______ 。
(3)在上述异构化反应中,1molA中由Mn形成的σ键有_______ mol。
(4)MnS晶胞与NaCl晶胞属于同种类型,MnS晶胞结构如图所示:_______ ,距离Mn原子最近的Mn原子有_______ 个。
②以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在MnS晶胞坐标系中,1号S原子坐标为(0,0,0),3号S原子坐标为(1,1,1),则2号S原子坐标为_______ 。
③已知:MnS晶体的密度为ρg·cm3, 为阿伏加德罗常数的值,则MnS晶胞中阴、阳离子最近距离为
为阿伏加德罗常数的值,则MnS晶胞中阴、阳离子最近距离为_______ pm(列出计算式即可)。

(1)基态钙原子中能量最高的电子所占据原子轨道的电子云轮廓图为
(2)已知:在元素周期表中Mn、Cr相邻,第二电离能与第一电离能之差较小的是
(3)在上述异构化反应中,1molA中由Mn形成的σ键有
(4)MnS晶胞与NaCl晶胞属于同种类型,MnS晶胞结构如图所示:

②以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在MnS晶胞坐标系中,1号S原子坐标为(0,0,0),3号S原子坐标为(1,1,1),则2号S原子坐标为
③已知:MnS晶体的密度为ρg·cm3,
 为阿伏加德罗常数的值,则MnS晶胞中阴、阳离子最近距离为
为阿伏加德罗常数的值,则MnS晶胞中阴、阳离子最近距离为
您最近一年使用:0次
名校
解题方法
2 . 现有七种元素,其中A、B、C、D、E为短周期主族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息回答问题:
(1)B的元素符号为___________ ,基态原子价电子轨道表示式为___________ 。
(2)基态D原子中能量最高的电子所在的原子轨道的电子云在空间有___________ 个伸展方向,原子轨道呈___________ 形。
(3)某同学根据上述信息,推断C基态原子的核外电子轨道表示式为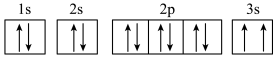 ,该同学所写的轨道表示式违反了
,该同学所写的轨道表示式违反了___________ 。
(4)E元素原子核外有___________ 种运动状态不同的电子。
(5)检验F元素的方法是___________ 。
| A | 元素原子半径在周期表中最小,也是宇宙中最丰富的元素 |
| B | 元素原子的核外p轨道总电子数比s轨道总电子数少1 |
| C | 元素的第一至第四电离能分别是I1=738 kJ·mol-1、I2=1 451 kJ·mol-1、I3=7 733 kJ·mol-1、I4=10 540 kJ·mol-1 |
| D | 原子核外所有p轨道全满或半满 |
| E | 元素的主族序数与周期序数的差为4,原子半径在同周期中最小 |
| F | 是前四周期中电负性最小的元素 |
(1)B的元素符号为
(2)基态D原子中能量最高的电子所在的原子轨道的电子云在空间有
(3)某同学根据上述信息,推断C基态原子的核外电子轨道表示式为
 ,该同学所写的轨道表示式违反了
,该同学所写的轨道表示式违反了(4)E元素原子核外有
(5)检验F元素的方法是
您最近一年使用:0次
3 . 下列表达不正确的是
| A.原子轨道能量:1s<2s<3s<4s |
| B.p能级的轨道数比s能级的多,能量比s能级的高 |
| C.4s电子能量较高,在比3s电子离核更远的地方出现的概率更大 |
| D.同一周期,碱金属元素的第一电离能最小,最容易失电子 |
您最近一年使用:0次
解题方法
4 . John B.Goodenough等三位科学家因在发展锂离子电池方面做出的贡献而获得了诺贝尔化学奖。回答下列问题:
(1)锰酸锂( LiMn2O4)电池具有原料成本低合成工艺简单等优点。原子中运动的电子有两种相反的身旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态Li原子,其核外电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态Li原子,其核外电子自旋磁量子数的代数和为_______ 。基态 Mn原子核外价层电子的运动状态有_______ 种。
(2)锂离子电池的电解液一般为溶有LiPF6的碳酸酯类有机溶剂,LiPF6遇水反应生成PF3和POF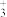 , PF
, PF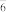 中心原子的价层电子对数为
中心原子的价层电子对数为_______ ,POF3的空间构型为_______ 。 下列对PF5中心原子杂化方式的推断合理的是_______ (填字母)。
A. sp2 B. sp3 C. sp3d D. sp3d2
(3)三元正极材料LiC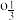 N
N jMnO2掺杂Al3+可使其性能更优,第三电离能:Fe
jMnO2掺杂Al3+可使其性能更优,第三电离能:Fe_______ (填“大于”或“小于”)Mn,原因是_______ 。
(4)链化锂被认为是很有潜力的正极材料,晶胞结构如图所示。
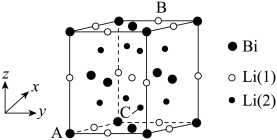
①晶施可以看作是由铋原子构成的面心立方晶格,锂原子填充在其中的四面体和八面体空隙处,晶体的化学式为_______ 。
②图中原子坐标参数:A为(0,0,0),B为(1,0.5,1),则C的坐标为_______ ,Bi与Li(1)和Li(2)之间的最短距离的比值为_______ 。
(1)锰酸锂( LiMn2O4)电池具有原料成本低合成工艺简单等优点。原子中运动的电子有两种相反的身旋状态,若一种自旋状态用+
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态Li原子,其核外电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态Li原子,其核外电子自旋磁量子数的代数和为(2)锂离子电池的电解液一般为溶有LiPF6的碳酸酯类有机溶剂,LiPF6遇水反应生成PF3和POF
 , PF
, PF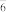 中心原子的价层电子对数为
中心原子的价层电子对数为A. sp2 B. sp3 C. sp3d D. sp3d2
(3)三元正极材料LiC
 N
N jMnO2掺杂Al3+可使其性能更优,第三电离能:Fe
jMnO2掺杂Al3+可使其性能更优,第三电离能:Fe(4)链化锂被认为是很有潜力的正极材料,晶胞结构如图所示。

①晶施可以看作是由铋原子构成的面心立方晶格,锂原子填充在其中的四面体和八面体空隙处,晶体的化学式为
②图中原子坐标参数:A为(0,0,0),B为(1,0.5,1),则C的坐标为
您最近一年使用:0次
解题方法
5 . 我国科学家及其合作团队研究发现,六方相(hcp)Fe—H、Fe—C和Fe—O合金在地球内核温压下转变成超离子态。该研究表明地球内核并非传统认知的固态,而是由固态铁和流动的轻元素组成的超离子态。请用所学知识回答下列问题:
(1)基态铁原子最外层电子所在能级的电子云轮廓图为_______ 形。
(2)H、C、O三种元素的电负性由大到小的排序为_______ (填元素符号)。
(3)锰和铁处于同一周期,锰、铁电离能数据如表所示:
请解释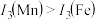 的主要原因:
的主要原因:_______ 。
(4)H、C,O三种元素可以组成很多种物质。
① 、
、 、
、 、
、 、
、 中属于非极性分子的有
中属于非极性分子的有_______ (填化学式),其中 的立体构型为
的立体构型为_______ 。
② 的沸点
的沸点_______ (填“大于”、“小于”或“等于”) 的沸点。
的沸点。
(5)用X射线衍射仪测定发现铁晶体有两种晶胞结构,如图1、图2所示。
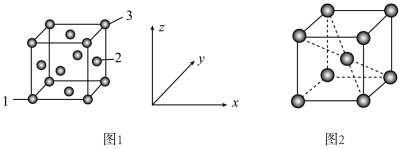
①原子坐标参数可以描述晶胞内部各微粒的相对位置。设图1中1号原子的坐标参数为(0,0,0),3号原子的坐标参数为(1,1,1),则2号原子的坐标参数为_______ 。
②若图2中晶胞参数为apm,设 为阿伏加德罗常数的值,则晶体的密度为
为阿伏加德罗常数的值,则晶体的密度为_______ (用含a、 的代数式表示)
的代数式表示) 。
。
(1)基态铁原子最外层电子所在能级的电子云轮廓图为
(2)H、C、O三种元素的电负性由大到小的排序为
(3)锰和铁处于同一周期,锰、铁电离能数据如表所示:
| 元素 | 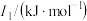 |  |  |
| Mn | 717.3 | 1509.9 | 3248 |
| Fe | 762.5 | 1561.9 | 2953 |
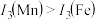 的主要原因:
的主要原因:(4)H、C,O三种元素可以组成很多种物质。
①
 、
、 、
、 、
、 、
、 中属于非极性分子的有
中属于非极性分子的有 的立体构型为
的立体构型为②
 的沸点
的沸点 的沸点。
的沸点。(5)用X射线衍射仪测定发现铁晶体有两种晶胞结构,如图1、图2所示。

①原子坐标参数可以描述晶胞内部各微粒的相对位置。设图1中1号原子的坐标参数为(0,0,0),3号原子的坐标参数为(1,1,1),则2号原子的坐标参数为
②若图2中晶胞参数为apm,设
 为阿伏加德罗常数的值,则晶体的密度为
为阿伏加德罗常数的值,则晶体的密度为 的代数式表示)
的代数式表示) 。
。
您最近一年使用:0次
6 . 下列说法不正确的是
| A.电子云图中小点的疏密程度表示电子在原子核外单位体积内出现概率的大小 |
B.核外电子排布由 的变化需要吸收能量 的变化需要吸收能量 |
C.在基态多电子原子中,p轨道电子的能量不一定高于 轨道电子的能量 轨道电子的能量 |
| D.在同一电子层上运动的电子,其自旋方向肯定不同 |
您最近一年使用:0次
2021-07-10更新
|
484次组卷
|
3卷引用:福建省南平市2020-2021学年高二下学期期末质量检测化学试题
福建省南平市2020-2021学年高二下学期期末质量检测化学试题(已下线)第1.1.2讲 构造原理与电子排布式 电子云与原子轨道-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)辽宁省朝阳市建平县实验中学2023-2024学年高二上学期12月月考化学试题
名校
解题方法
7 . 碳和硅在元素周期表中都处于第ⅣA族,但他们的性质并不相同,碳和硅的性质差异清晰地显示出它们各自在有机化学和无机化学(硅酸盐)中占据统治地位的作用。
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用___ 形象化描述,基态硅原子的核外电子排布式为___ ,其基态原子核外有___ 种不同空间运动状态的电子。
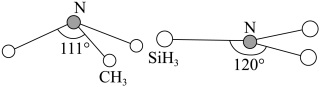
(2)由于硅的价层有d轨道可以利用,而碳没有,因此它们的化合物结构和性质存在较大差异。化合物N(CH3)3(三角锥形)和N(SiH3)3(平面形)的结构如图所示,则二者中N的杂化方式分别为___ 。更易形成配合物的是___ 。
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同。
第IIA族部分碳酸盐受热分解温度
试解释,ⅡA族碳酸盐的分解温度随着阳离子半径的增大逐步升高的原因___ 。
(4)石墨烯与金属R可以形成一种插层化合物。其中R层平行于石墨层,晶胞如图甲所示,其垂直于石墨层方向的投影如图乙所示。则该插层化合物的化学式为___ 。
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用
(2)由于硅的价层有d轨道可以利用,而碳没有,因此它们的化合物结构和性质存在较大差异。化合物N(CH3)3(三角锥形)和N(SiH3)3(平面形)的结构如图所示,则二者中N的杂化方式分别为

(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同。
第IIA族部分碳酸盐受热分解温度
| 碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
(4)石墨烯与金属R可以形成一种插层化合物。其中R层平行于石墨层,晶胞如图甲所示,其垂直于石墨层方向的投影如图乙所示。则该插层化合物的化学式为

您最近一年使用:0次
解题方法
8 . 闪锌矿与纤锌矿的主要成分均为ZnS。在一定条件下ZnO与ZnS、Se共热可制备荧光材料ZnSe。回答下列问题:
(1)基态Zn原子占据最高能层的电子云轮廓图形状为___________ ;基态Zn与S原子成对电子数之比为___________ 。
(2)根据下列锌卤化物的熔点和溶解性,判断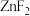 晶体的类型为
晶体的类型为___________ ;分析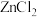 、
、 、
、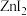 的熔点依次增大的原因
的熔点依次增大的原因___________ 。
(3)固态 是以
是以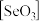 角锥体以角相连接的展平的聚合结构,每一锥体带有一悬垂的终端O原子(如图所示)。图中Se-O键键长较短的是
角锥体以角相连接的展平的聚合结构,每一锥体带有一悬垂的终端O原子(如图所示)。图中Se-O键键长较短的是___________ (填“a”或“b”)。其原因是___________ 。
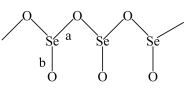
(4)ZnSe晶胞与ZnS晶胞相似(如图),晶胞中距离最近的两个 的距离为anm,请计算ZnSe晶胞的密度
的距离为anm,请计算ZnSe晶胞的密度___________  。
。

(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。ZnSe晶胞中部分原子的分数坐标为:A点 ,B点
,B点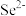 的分数坐标为
的分数坐标为___________ ;从该晶胞中找出距离B点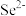 最远的
最远的 的位置
的位置___________ (用分数坐标表示)。
(1)基态Zn原子占据最高能层的电子云轮廓图形状为
(2)根据下列锌卤化物的熔点和溶解性,判断
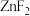 晶体的类型为
晶体的类型为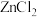 、
、 、
、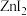 的熔点依次增大的原因
的熔点依次增大的原因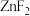 | 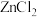 |  | 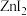 | |
| 熔点/℃ | 872 | 275 | 394 | 446 |
| 在乙醇、乙醚中的溶解性 | 不溶 | 溶解 | 溶解 | 溶解 |
 是以
是以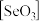 角锥体以角相连接的展平的聚合结构,每一锥体带有一悬垂的终端O原子(如图所示)。图中Se-O键键长较短的是
角锥体以角相连接的展平的聚合结构,每一锥体带有一悬垂的终端O原子(如图所示)。图中Se-O键键长较短的是
(4)ZnSe晶胞与ZnS晶胞相似(如图),晶胞中距离最近的两个
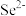 的距离为anm,请计算ZnSe晶胞的密度
的距离为anm,请计算ZnSe晶胞的密度 。
。
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。ZnSe晶胞中部分原子的分数坐标为:A点
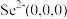 ,B点
,B点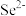 的分数坐标为
的分数坐标为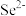 最远的
最远的 的位置
的位置
您最近一年使用:0次
2021-05-06更新
|
158次组卷
|
2卷引用:山西省运城市2020-2021学年高二下学期期中考试化学(A)试题
解题方法
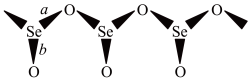
9 . SeO2是一种常见的氧化剂,易被还原成 。根据X射线衍射分析,SeO2晶体是如下图所示的长链状结构:
。根据X射线衍射分析,SeO2晶体是如下图所示的长链状结构:
完成下列填空:
(1) 与S同属于VIA族,该族元素原子最外层电子的轨道表示式为
与S同属于VIA族,该族元素原子最外层电子的轨道表示式为_______ ,原子核外占据最高能级的电子云形状为_______ 形。
(2) SeO2在315℃时升华,蒸气中存在二聚态的SeO2,红外研究表明,二聚态的SeO2结构中存在四元环,写出该二聚态的结构式_______ 。
(3) SeO2属于_______ 晶体,其熔点远高于 的理由是
的理由是_______ 。解释键能 的原因
的原因_______ 。
(4) SeO2可将 的水溶液氧化成
的水溶液氧化成 ,反应的化学方程式为
,反应的化学方程式为_______ 。常温下,在稀溶液中硫酸的电离方式为: ;
; 。则在相同浓度
。则在相同浓度 与
与 的稀溶液中,
的稀溶液中,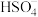 的电离程度较大的是
的电离程度较大的是_______ ,两种溶液中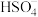 电离程度不同的原因是
电离程度不同的原因是_______ 。
 。根据X射线衍射分析,SeO2晶体是如下图所示的长链状结构:
。根据X射线衍射分析,SeO2晶体是如下图所示的长链状结构:
键长 | |
| a | 178 |
| b | 160.7 |
(1)
 与S同属于VIA族,该族元素原子最外层电子的轨道表示式为
与S同属于VIA族,该族元素原子最外层电子的轨道表示式为(2) SeO2在315℃时升华,蒸气中存在二聚态的SeO2,红外研究表明,二聚态的SeO2结构中存在四元环,写出该二聚态的结构式
(3) SeO2属于
 的理由是
的理由是 的原因
的原因(4) SeO2可将
 的水溶液氧化成
的水溶液氧化成 ,反应的化学方程式为
,反应的化学方程式为 ;
; 。则在相同浓度
。则在相同浓度 与
与 的稀溶液中,
的稀溶液中,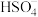 的电离程度较大的是
的电离程度较大的是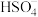 电离程度不同的原因是
电离程度不同的原因是
您最近一年使用:0次
解题方法
10 . A、B、C、D、E、F是前四周期的六种元素,原子序数依次增大。A、B、D三种元素分别位于不同短周期的不同主族。C、D对应的简单离子核外电子排布相同,A、B、C、D元素可形成一种新型漂白剂(结构如图),E元素正三价阳离子的3d轨道为半充满状态,F元素最外层只有一个电子,焰色反应为蓝绿色。

回答下列问题:
(1)基态A原子电子占据最高能级的电子云轮廓图为___________ 形。D元素基态原子核外M层电子的自旋状态___________ (填“相同”或“相反”)。基态原子与F同周期且最外层电子数相等的元素还有___________ (填元素符号)。E元素位于元素周期表___________ 区。
(2)B元素名称是___________ 。新型漂白剂中C元素的化合价为___________ 。C元素能形成两种常见单质,其中沸点高的是___________ (填分子式),原因是___________ 。
(3)元素E与F的第二电离能 I2(F)>I2(E)的原因是___________ 。
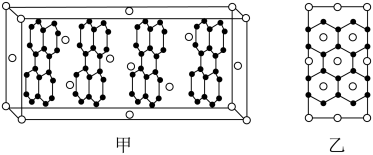
(4)E的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的截面图是___________ (填字母序号) 。
。
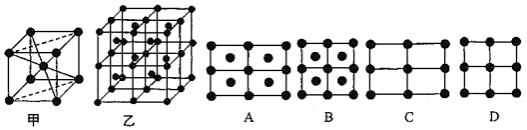

回答下列问题:
(1)基态A原子电子占据最高能级的电子云轮廓图为
(2)B元素名称是
(3)元素E与F的第二电离能 I2(F)>I2(E)的原因是
(4)E的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的截面图是
 。
。
您最近一年使用:0次



