名校
解题方法
1 . 下列关于原子结构、原子轨道的说法正确的是
| A.N能层中有4s、4p、4d、4f四个能级,共16个轨道,可容纳32种运动状态的电子 |
| B.在K能层中,有自旋相反的两条轨道 |
| C.s电子绕核运动,其轨道为球面,而p电子在纺锤形曲面上运动 |
| D.电子云通常是用小黑点来表示电子的多少 |
您最近一年使用:0次
2020-10-29更新
|
919次组卷
|
8卷引用:第16单元 物质的结构与性质(选考)(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷
(已下线)第16单元 物质的结构与性质(选考)(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷(已下线)第1讲 原子结构 核外电子排布四川省内江市第六中学2020-2021学年高二上学期第一次月考化学试题(已下线)练习11 原子结构-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)(已下线)第1章 原子结构与元素性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)河北省邯郸市大名县第一中学2021-2022学年高二上学期第二次月考化学试题四川省泸州市叙永第一中学校2023-2024学年高二上学期1月期末化学试题吉林省通化市梅河口市第五中学2023-2024学年高二上学期第三次月考化学试题
20-21高三上·江苏南通·阶段练习
名校
解题方法
2 . 短周期主族元素X、Y、Z、W原子序数依次增大,且X、Z同主族,Y的基态原子中含11种运动状态不同的电子, Z原子的最外层电子数与核外电子总数之比为3∶8。下列说法正确的是
| A.原子的半径:r(X)<r(Y)<r(Z)<r(W) |
| B.X与Y组成的化合物中均不含共价键 |
| C.简单气态氢化物的沸点X的比Z的高 |
| D.由X、Y、W三种元素组成的化合物的水溶液一定呈碱性 |
您最近一年使用:0次
2020-10-15更新
|
168次组卷
|
3卷引用:江苏省如皋市2021届高三上学期教学质量调研(一)化学(选修)试题
(已下线)江苏省如皋市2021届高三上学期教学质量调研(一)化学(选修)试题江苏省南京市第十三中学2021届高三上学期教学质量调研(一)化学试题江苏省镇江第一中学2020-2021学年高二下学期阶段性检测化学试题
名校
3 . 铋(83Bi)为第V A族元素,常见化合价为+3和+5。化合物NaBiO3为黄色固体,常温下微溶于水,在空气中逐渐分解产生Bi2O3、NaOH等物质。
(1)铋元素最外层电子分布在_____ 种能级中,共有_____ 种运动状态。
(2)铋酸钠NaBiO3中属于短周期元素的离子半径大小关系为_________ 。
(3)元素Na、Bi、O的金属性依次减弱,非金属性依次增强,请列举判断依据:_______ 。
(4)铋酸钠NaBiO3在空气中分解所得到产物中,化学键类型是______ 。
A.金属键 B.离子键 C.极性键 D.非极性键
(5)将NaBiO3加入MnSO4和H2SO4的混合溶液里加热,发生如下反应:
[ ]NaBiO3+[ ]MnSO4+[ ]H2SO4→[ ]Na2SO4+[ ]Bi2(SO4)3+[ ]NaMnO4+[ ]H2O
①配平该化学方程式,将系数填写在对应位置上。
______ NaBiO3+______ MnSO4+______ H2SO4→______ Na2SO4+______ Bi2(SO4)3+______ NaMnO4+______ H2O
②若有2mol氧化剂在该反应中被还原,则生成的MnO 被还原为Mn2+时,能将
被还原为Mn2+时,能将____ mol HCl氧化成Cl2。
(6)写出NaBiO3固体溶于HCl时发生反应的离子方程式:_________ 。
(1)铋元素最外层电子分布在
(2)铋酸钠NaBiO3中属于短周期元素的离子半径大小关系为
(3)元素Na、Bi、O的金属性依次减弱,非金属性依次增强,请列举判断依据:
(4)铋酸钠NaBiO3在空气中分解所得到产物中,化学键类型是
A.金属键 B.离子键 C.极性键 D.非极性键
(5)将NaBiO3加入MnSO4和H2SO4的混合溶液里加热,发生如下反应:
[ ]NaBiO3+[ ]MnSO4+[ ]H2SO4→[ ]Na2SO4+[ ]Bi2(SO4)3+[ ]NaMnO4+[ ]H2O
①配平该化学方程式,将系数填写在对应位置上。
②若有2mol氧化剂在该反应中被还原,则生成的MnO
 被还原为Mn2+时,能将
被还原为Mn2+时,能将(6)写出NaBiO3固体溶于HCl时发生反应的离子方程式:
您最近一年使用:0次
名校
解题方法
4 . 下列说法正确的是( )
| A.电子在原子核外排布时,总是尽量先排在能量最低的电子层上 |
B.单核离子最外层电子数一定满足 或 或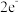 的稳定结构 的稳定结构 |
| C.元素的性质随着元素相对原子质量的递增而呈周期性变化的规律叫元素周期律 |
| D.周期表中元素种类最多的族是VⅢ族,VⅢ族有三个纵行 |
您最近一年使用:0次
2020-08-30更新
|
332次组卷
|
3卷引用:浙江省名校新高考研究联盟(Z20联盟)2020届高三第三次联考化学试题
名校
解题方法
5 . 下列关于含氮微粒的表述正确的是( )
A.N2的电子式为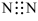 | B.N3-的最外层电子数为6 |
| C.N3-的质子数是20 | D.氮原子未成对电子的电子云形状相同 |
您最近一年使用:0次
2020-05-11更新
|
436次组卷
|
7卷引用:2018年上海市高中化学等级考试卷
名校
解题方法
6 . 下表是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是( )
| 元素 | A | B | C | D | E |
| 最低化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| A.C、D、E的简单氢化物的稳定性:C>D>E |
| B.元素A的原子最外层中无自旋状态相同的电子 |
| C.元素B、C之间不可能形成化合物 |
D.与元素B同周期且在该周期中第一电离能最小的元素的单质能与 发生置换反应 发生置换反应 |
您最近一年使用:0次
2020-04-09更新
|
782次组卷
|
25卷引用:专题11.1 原子结构与性质(练)-《2020年高考一轮复习讲练测》
(已下线)专题11.1 原子结构与性质(练)-《2020年高考一轮复习讲练测》2016-2017学年安徽省六安市第一中学高二下学期第一次阶段检测化学试卷宁夏回族自治区银川市长庆高级中学2018-2019学年高二下学期第二次月考化学试题宁夏回族自治区吴忠市青铜峡市高级中学2019-2020学年高二上学期期末考试化学试题云南省开远市第二中学校2019-2020学年高二上学期期末考试化学试题人教化学选修3第一章第二节课时4人教化学选修3第一章第二节课时5天津市第二十中学2019-2020学年高二下学期阶段性检测化学试题第1章 原子结构——B拓展区综合拓展(鲁科版选修3)山东省济南市章丘区第四中学2019-2020学年高二下学期第六次教学质量检测化学试题(已下线)练习18 原子结构与元素的性质-2020-2021学年【补习教材·寒假作业】高二化学(人教版)鲁科版2019选择性必修2第1章 原子结构与元素性质 微项目 甲醛的危害与去除——利用电负性分析与预测物质性质(人教版2019)选择性必修2 第一章 原子结构与性质 B素养拓展区(已下线)第一单元 原子结构(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)宁夏吴忠市吴忠中学2020-2021学年高二3月月考化学试题河北省衡水市武强中学2020-2021学年高二下学期第一次月考化学试题四川省成都市蒲江县蒲江中学2019-2020学年高二下学期5月月考化学试题河北省石家庄市第一中学2019-2020学年高二下学期第一次月考化学试题辽宁省沈阳市重点高中联合体2021-2022学年高二12月考试化学试题(已下线)1.2.3 元素的电负性及其变化规律-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)1.2.2 原子结构与元素周期律(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)第1章 章末综合测评A-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修1)重庆市育才中学2021-2022学年上学期高二上学期第六次定时练习化学试题安徽省池州市第一中学2022-2023学年高二下学期第一次月考化学试题云南省大理州实验中学2021-2022学年高二下学期化学期中考试题
7 . 下列对核外电子运动状态的描述正确的是( )
| A.电子的运动与行星的运动相似,围绕原子核在固定的轨道上高速旋转 |
| B.能层数为3时,有3s、3p、3d、3f四个轨道 |
| C.氢原子中只有一个电子,故只有一个轨道,不能发生跃迁而产生光谱 |
| D.在同一能级上运动的电子,其运动状态肯定不同 |
您最近一年使用:0次
2020-04-05更新
|
495次组卷
|
7卷引用:考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)
(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第37练 原子结构-2023年高考化学一轮复习小题多维练(全国通用)山东省聊城市2019-2020学年高二上学期期末考试化学试题福建省永安市第三中学2019-2020学年高二下学期期初综合检测试化学试题四川省彭州市濛阳中学2019-2020学年高二下学期开学考试化学试题(已下线)1.1 原子结构(C级检测练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)新疆阿克苏市实验中学2022-2023学年高二下学期第三次月考化学试题
11-12高三上·上海长宁·期末
解题方法
8 . 已知某种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,X元素的原子核外共有20种不同运动状态的电子,Y元素的原子核外共有5种不同能级的电子,且XY2中阳离子和阴离子的电子层结构相同。
(1)该融雪剂的化学式是_________ ;电子式为:_________ ;
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是____________ ;D与E能形成一种非极性分子,该分子的结构式为 ________ ;E的单质中,质软有润滑性的是___________ (填写单质名称)。
(3)元素W在D的同一周期,其单质是原子晶体;元素Z的气态单质分子Z2中有3个共价键;W与Z能形成一种新型无机非金属材料,其化学式可能是___________ 。
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为____________________________________ 。
(1)该融雪剂的化学式是
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是
(3)元素W在D的同一周期,其单质是原子晶体;元素Z的气态单质分子Z2中有3个共价键;W与Z能形成一种新型无机非金属材料,其化学式可能是
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为
您最近一年使用:0次
11-12高三上·上海奉贤·期末
解题方法
9 . 工业制玻璃主要原料有石英、纯碱和石灰石.在玻璃窑中发生主要反应的化学方程式为:Na2CO3+SiO2 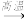 Na2SiO3+CO2↑;CaCO3+SiO2
Na2SiO3+CO2↑;CaCO3+SiO2 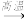 CaSiO3+CO2↑
CaSiO3+CO2↑
(1)普通玻璃的成分是Na2CaSi6O14,它的氧化物形式为________ ,则原料中SiO2、Na2CO3、CaCO3的物质的量之比为_________________________ 。
(2)在上述反应的反应物和生成物中,属于非极性分子的电子式___________________ ,有_____________ 种不同类型的晶体(填数字)
(3)在上述普通玻璃的组成元素中某元素与铝元素同周期且原子半径比铝原子半径大,该元素离子半径比铝离子半径___________ (填“大”或“小”),该元素与铝元素两者的最高价氧化物的水化物之间发生反应的离子方程式为__________________________ 。
(4)在上述普通玻璃的组成元素中,与铝元素同周期的另一元素的原子最外层共有________ 种不同运动状态的电子、________ 种不同能级的电子。
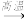 Na2SiO3+CO2↑;CaCO3+SiO2
Na2SiO3+CO2↑;CaCO3+SiO2 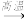 CaSiO3+CO2↑
CaSiO3+CO2↑(1)普通玻璃的成分是Na2CaSi6O14,它的氧化物形式为
(2)在上述反应的反应物和生成物中,属于非极性分子的电子式
(3)在上述普通玻璃的组成元素中某元素与铝元素同周期且原子半径比铝原子半径大,该元素离子半径比铝离子半径
(4)在上述普通玻璃的组成元素中,与铝元素同周期的另一元素的原子最外层共有
您最近一年使用:0次
14-15高三上·上海浦东新·阶段练习
名校
解题方法
10 . 关于硫原子核外电子的叙述错误的是( )
| A.排布在K、L、M三个电子层上 |
| B.3p亚层上有2个空轨道 |
| C.共有16种不同的运动状态 |
| D.共有5种不同的能量 |
您最近一年使用:0次
2020-03-23更新
|
150次组卷
|
3卷引用:上海市建平中学2015届高三10月月考化学试题



