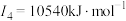解题方法
1 . 烯烃的加氢甲酰化反应是醛合成中重要的均相催化工业反应之一。我国科学家利用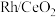 催化剂实现烯烃甲酰化。回答下列问题:
催化剂实现烯烃甲酰化。回答下列问题: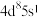 ,位于周期表第五周期第
,位于周期表第五周期第_____ 族,位于_____ 区。
(2)基态O原子核外电子有_____ 种不同的空间运动状态。
(3)乙中C原子的杂化类型是_____ 。
(4)丙分子中所含元素电负性由大到小顺序为_____ 。丙分子有_____ 个手性碳原子。
(5)已知: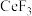 、
、 的熔点分别为1640℃、650℃,其熔点差异很大的主要原因是
的熔点分别为1640℃、650℃,其熔点差异很大的主要原因是_____ 。
(6) 的立方晶胞结构如图所示。已知
的立方晶胞结构如图所示。已知 为阿伏加德罗常数的值,晶胞参数为
为阿伏加德罗常数的值,晶胞参数为 。
。_____ 。该晶体密度为_____  。
。
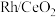 催化剂实现烯烃甲酰化。回答下列问题:
催化剂实现烯烃甲酰化。回答下列问题:
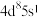 ,位于周期表第五周期第
,位于周期表第五周期第(2)基态O原子核外电子有
(3)乙中C原子的杂化类型是
(4)丙分子中所含元素电负性由大到小顺序为
(5)已知:
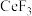 、
、 的熔点分别为1640℃、650℃,其熔点差异很大的主要原因是
的熔点分别为1640℃、650℃,其熔点差异很大的主要原因是(6)
 的立方晶胞结构如图所示。已知
的立方晶胞结构如图所示。已知 为阿伏加德罗常数的值,晶胞参数为
为阿伏加德罗常数的值,晶胞参数为 。
。
 。
。
您最近一年使用:0次
名校
解题方法
2 . 第四周期的元素在工业、农业、科学技术以及人类生活等方面有重要作用。回答下列问题:
(1)钒(V)及其化合物广泛应用于工业催化、新材料等领域。
①周期表中铬位于钒旁边,基态铬原子的价层电子排布图为___________ 。
② 是一种常见的催化剂,在合成硫酸中起到重要作用,其结构式如图所示:则
是一种常见的催化剂,在合成硫酸中起到重要作用,其结构式如图所示:则 分子中σ键和π键数目之比为
分子中σ键和π键数目之比为___________ 。 溶解在NaOH溶液中,可得到钒酸钠(
溶解在NaOH溶液中,可得到钒酸钠(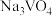 )。
)。 与
与 的空间构型相同,其中V原子的杂化方式为
的空间构型相同,其中V原子的杂化方式为___________ 。 作光催化剂可处理废水中的
作光催化剂可处理废水中的 ,则
,则 的电子式为
的电子式为___________ 。
② 是一种储氢材料。第一电离能介于B、N之间的第2周期元素有
是一种储氢材料。第一电离能介于B、N之间的第2周期元素有___________ 种。
(3)“玉兔二号”月球车是通过砷化镓(GaAs)太阳能电池提供能量进行工作的。第ⅤA族的As元素可以形成多种含氧酸,如 、
、 等,请预测:键角:
等,请预测:键角:
___________  (填“>”“<”或“=”)。基态砷原子的电子占据最高能级的电子云轮廓图为
(填“>”“<”或“=”)。基态砷原子的电子占据最高能级的电子云轮廓图为___________ 形。
(4)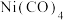 常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测
常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测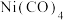 是
是___________ 分子(填“极性”或“非极性”)。
(5)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态Ge原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态Ge原子,其价电子自旋磁量子数的代数和为___________ 。
(1)钒(V)及其化合物广泛应用于工业催化、新材料等领域。
①周期表中铬位于钒旁边,基态铬原子的价层电子排布图为
②
 是一种常见的催化剂,在合成硫酸中起到重要作用,其结构式如图所示:则
是一种常见的催化剂,在合成硫酸中起到重要作用,其结构式如图所示:则 分子中σ键和π键数目之比为
分子中σ键和π键数目之比为 溶解在NaOH溶液中,可得到钒酸钠(
溶解在NaOH溶液中,可得到钒酸钠(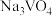 )。
)。 与
与 的空间构型相同,其中V原子的杂化方式为
的空间构型相同,其中V原子的杂化方式为
 作光催化剂可处理废水中的
作光催化剂可处理废水中的 ,则
,则 的电子式为
的电子式为②
 是一种储氢材料。第一电离能介于B、N之间的第2周期元素有
是一种储氢材料。第一电离能介于B、N之间的第2周期元素有(3)“玉兔二号”月球车是通过砷化镓(GaAs)太阳能电池提供能量进行工作的。第ⅤA族的As元素可以形成多种含氧酸,如
 、
、 等,请预测:键角:
等,请预测:键角:
 (填“>”“<”或“=”)。基态砷原子的电子占据最高能级的电子云轮廓图为
(填“>”“<”或“=”)。基态砷原子的电子占据最高能级的电子云轮廓图为(4)
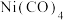 常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测
常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测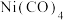 是
是(5)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态Ge原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态Ge原子,其价电子自旋磁量子数的代数和为
您最近一年使用:0次
名校
解题方法
3 . 我国科学家利用锰簇催化剂(Mn4CaOx,x代表氧原子数)解密光合作用。锰簇的可逆结构异构化反应如图:
(1)基态钙原子中能量最高的电子所占据原子轨道的电子云轮廓图为_______ 形。
(2)已知:在元素周期表中Mn、Cr相邻,第二电离能与第一电离能之差较小的是_______ (填“Mn”或“Cr”),理由是_______ 。
(3)在上述异构化反应中,1molA中由Mn形成的σ键有_______ mol。
(4)MnS晶胞与NaCl晶胞属于同种类型,MnS晶胞结构如图所示:_______ ,距离Mn原子最近的Mn原子有_______ 个。
②以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在MnS晶胞坐标系中,1号S原子坐标为(0,0,0),3号S原子坐标为(1,1,1),则2号S原子坐标为_______ 。
③已知:MnS晶体的密度为ρg·cm3, 为阿伏加德罗常数的值,则MnS晶胞中阴、阳离子最近距离为
为阿伏加德罗常数的值,则MnS晶胞中阴、阳离子最近距离为_______ pm(列出计算式即可)。

(1)基态钙原子中能量最高的电子所占据原子轨道的电子云轮廓图为
(2)已知:在元素周期表中Mn、Cr相邻,第二电离能与第一电离能之差较小的是
(3)在上述异构化反应中,1molA中由Mn形成的σ键有
(4)MnS晶胞与NaCl晶胞属于同种类型,MnS晶胞结构如图所示:

②以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在MnS晶胞坐标系中,1号S原子坐标为(0,0,0),3号S原子坐标为(1,1,1),则2号S原子坐标为
③已知:MnS晶体的密度为ρg·cm3,
 为阿伏加德罗常数的值,则MnS晶胞中阴、阳离子最近距离为
为阿伏加德罗常数的值,则MnS晶胞中阴、阳离子最近距离为
您最近一年使用:0次
名校
解题方法
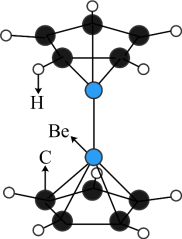
4 . 2023年6月,科学家首次合成含铍-铍能的固态化合物,相关成果发表于《科学》杂质。该分子入选2023年最“炫”分子榜单,其结构如图所示,回答下列问题: 原子最外层电子的电子云轮廓图为
原子最外层电子的电子云轮廓图为_____ (填序号)。
A.球形 B.哑铃形
(2)下列电子排布式分别代表铍微粒,其中失去1个电子所需能量最多的是_____。
(3)“固态双铍化合物的化学式为_____ ,它不含_____ (填标号)。
A.极性键 B.非极性键 C.金属键 D. 键
键
(4)卤化铍的熔点如表所示:
① 中
中 原子的杂化方式为
原子的杂化方式为_____ ;
②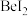
_____ (填“能”或“不能)溶于四氯化碳:
③ 、
、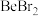 、
、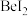 的熔点依次升高的原因是
的熔点依次升高的原因是_____ 。
(5) 易形成配离子
易形成配离子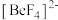 ,其中心阳离子的配位数为
,其中心阳离子的配位数为_____ ,配体是_____ (填化学符号),配离子的空间构型为_____ 。
(6)离子晶体中稳定配位多面体的理论半径比如表所示:
已知铍离子、氧离子的半径分别为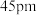 、
、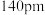 ,
, 的配位多面体是
的配位多面体是_____ 。
(7)Be的某种氧化物晶体是制备氟硼铍酸钾晶体的原料之一,其晶胞结构如图所示。这种氧化物的化学式为_____ ;设晶胞参数为 ,用
,用 表示阿伏加德罗参数的值,则
表示阿伏加德罗参数的值,则 晶体的密度为
晶体的密度为_____  (用含a和
(用含a和 的式子表示)。
的式子表示)。
 原子最外层电子的电子云轮廓图为
原子最外层电子的电子云轮廓图为A.球形 B.哑铃形
(2)下列电子排布式分别代表铍微粒,其中失去1个电子所需能量最多的是_____。
A.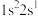 | B. | C.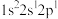 | D. |
(3)“固态双铍化合物的化学式为
A.极性键 B.非极性键 C.金属键 D.
 键
键(4)卤化铍的熔点如表所示:
 | 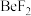 |  | 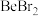 | 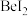 |
熔点/ | 552 | 399 | 488 | 510 |
 中
中 原子的杂化方式为
原子的杂化方式为②
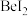
③
 、
、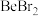 、
、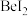 的熔点依次升高的原因是
的熔点依次升高的原因是(5)
 易形成配离子
易形成配离子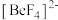 ,其中心阳离子的配位数为
,其中心阳离子的配位数为(6)离子晶体中稳定配位多面体的理论半径比如表所示:
| 配位多面体 | 配位数 | 半径比(r+/r-) |
| 平面三角形 | 3 | 0.15~0.225 |
| 四面体 | 4 | 0.225~0.414 |
| 八面体 | 6 | 0.414~0.732 |
| 立方体 | 8 | 0.732~1.000 |
| 立方八面体 | 12 | 1.000 |
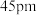 、
、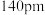 ,
, 的配位多面体是
的配位多面体是(7)Be的某种氧化物晶体是制备氟硼铍酸钾晶体的原料之一,其晶胞结构如图所示。这种氧化物的化学式为
 ,用
,用 表示阿伏加德罗参数的值,则
表示阿伏加德罗参数的值,则 晶体的密度为
晶体的密度为 (用含a和
(用含a和 的式子表示)。
的式子表示)。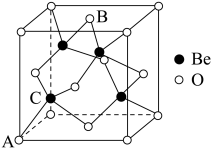
您最近一年使用:0次
名校
解题方法
5 . 现有七种元素,其中A、B、C、D、E为短周期主族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息回答问题:
(1)B的元素符号为___________ ,基态原子价电子轨道表示式为___________ 。
(2)基态D原子中能量最高的电子所在的原子轨道的电子云在空间有___________ 个伸展方向,原子轨道呈___________ 形。
(3)某同学根据上述信息,推断C基态原子的核外电子轨道表示式为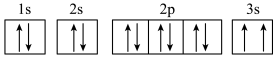 ,该同学所写的轨道表示式违反了
,该同学所写的轨道表示式违反了___________ 。
(4)E元素原子核外有___________ 种运动状态不同的电子。
(5)检验F元素的方法是___________ 。
| A | 元素原子半径在周期表中最小,也是宇宙中最丰富的元素 |
| B | 元素原子的核外p轨道总电子数比s轨道总电子数少1 |
| C | 元素的第一至第四电离能分别是I1=738 kJ·mol-1、I2=1 451 kJ·mol-1、I3=7 733 kJ·mol-1、I4=10 540 kJ·mol-1 |
| D | 原子核外所有p轨道全满或半满 |
| E | 元素的主族序数与周期序数的差为4,原子半径在同周期中最小 |
| F | 是前四周期中电负性最小的元素 |
(1)B的元素符号为
(2)基态D原子中能量最高的电子所在的原子轨道的电子云在空间有
(3)某同学根据上述信息,推断C基态原子的核外电子轨道表示式为
 ,该同学所写的轨道表示式违反了
,该同学所写的轨道表示式违反了(4)E元素原子核外有
(5)检验F元素的方法是
您最近一年使用:0次
名校
解题方法
6 . 现有A、B、C、D、E、F、G、H八种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
A元素的核外电子数和电子层数相等,也是宇宙中含量最丰富的元素 |
B元素是形成化合物种类最多的元素 |
C元素基态原子的核外p电子数比s电子数少1 |
D元素基态原子的核外p轨道中有两个未成对电子 |
E元素的气态基态原子的第一至第四电离能分别如下:
|
F元素的主族序数与周期数的差为4 |
G元素是前四周期中电负性最小的元素 |
H元素位于元素周期表中的第八纵列 |
(1)C2A4的电子式为
(2)B元素的原子核外共有
(3)E元素基态原子的电离能I3远远大于I2,其原因是
(4)B、C、D、E四种元素的第一电离能由大到小的顺序是
(5)用惰性电极电解EF2的水溶液的离子方程式为
(6)H位于元素周期表中
您最近一年使用:0次
7 . 回答下列问题
(1)F2通入稀NaOH溶液中可生成OF2,OF2空间结构为___________ ,电负性O___________ F;其中氧原子的杂化方式为___________ 。
(2)X、Y、Z为短周期元素且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成NH3;Z基态原子的M层与K层电子数相等。 空间结构是
空间结构是___________ ;X与Z形成化合物中含有的化学键是___________ 。
(3) 的空间结构为
的空间结构为___________ 。(用文字描述,下同): 的空间结构是
的空间结构是___________ 。
(4)在BF3分子中: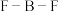 的键角是
的键角是___________ ,B原子的杂化轨道类型为___________ ,BF3和过量NaF作用可生成NaBF4, 的空间结构为
的空间结构为___________ 。
(5)钠在火焰上灼烧产生的黄光是一种___________ (填字母)。
A.吸收光谱 B.发射光谱
(6)已知(CN)2是直线形分子,且有对称性,则(CN)2分子的结构式为___________ ;其中π键与σ键的个数比为___________ 。
(7)基态S原子价电子排布式___________ ;S原子的核外电子运动状态有___________ 种,空间运动状态有___________ 种:能量最高的轨道的电子云的形状是___________ 。
(1)F2通入稀NaOH溶液中可生成OF2,OF2空间结构为
(2)X、Y、Z为短周期元素且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成NH3;Z基态原子的M层与K层电子数相等。
 空间结构是
空间结构是(3)
 的空间结构为
的空间结构为 的空间结构是
的空间结构是(4)在BF3分子中:
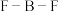 的键角是
的键角是 的空间结构为
的空间结构为(5)钠在火焰上灼烧产生的黄光是一种
A.吸收光谱 B.发射光谱
(6)已知(CN)2是直线形分子,且有对称性,则(CN)2分子的结构式为
(7)基态S原子价电子排布式
您最近一年使用:0次
2024-02-22更新
|
214次组卷
|
2卷引用:天津市耀华中学2023-2024学年高二上学期1月期末化学试题
名校
8 . 如表为元素周期表的一部分,其中的编号代表对应的不同元素。
请回答下列问题:
(1)某元素的价电子排布式为nsnnpn+1,该元素与元素①形成的最简单化合物的电子式为___________ 。
(2)基态③原子中电子占据最高能级的符号是___________ ,占据该能级电子的电子云轮廓图为___________ 形。
(3)写出②的氧化物与NaOH溶液反应的化学方程式:___________ 。
(4)元素④⑤⑥的电负性:___________>___________>___________。(填元素符号)___________
(5)元素⑤(设为字母X)和元素⑧(设为字母Y)形成的化合物XY3与水反应产生有漂白性的物质,写出该反应的化学方程式___________ 。
(6)如表是第三周期元素中某种元素的部分电离能,由此可判断该元素的名称是___________ 。
(7)⑨基态原子的简化电子排布式为___________ ,在周期表中的位置___________ 。
(8)⑩基态原子的价层电子轨道表示式为___________ 。
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ||||||||||||||||
| ⑨ | ⑩ | ||||||||||||||||
(1)某元素的价电子排布式为nsnnpn+1,该元素与元素①形成的最简单化合物的电子式为
(2)基态③原子中电子占据最高能级的符号是
(3)写出②的氧化物与NaOH溶液反应的化学方程式:
(4)元素④⑤⑥的电负性:___________>___________>___________。(填元素符号)
(5)元素⑤(设为字母X)和元素⑧(设为字母Y)形成的化合物XY3与水反应产生有漂白性的物质,写出该反应的化学方程式
(6)如表是第三周期元素中某种元素的部分电离能,由此可判断该元素的名称是
| 元素 | 电离能(kJ•mol-1) | ||||
| I1 | I2 | I3 | I4 | I5 | |
| 某种元素 | 578 | 1817 | 2745 | 11575 | 14830 |
(8)⑩基态原子的价层电子轨道表示式为
您最近一年使用:0次
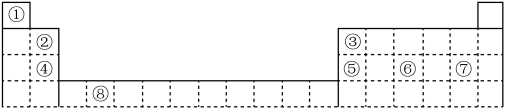
9 . 如图为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区元素的是___________ (填元素符号),其基态原子最高能层的电子的电子云轮廓图为___________ 。
(2)元素③的基态原子的电子排布式为___________ 。
(3)元素⑦的基态原子核外电子云有________ 种不同的伸展方向,核外电子有_________ 种空间运动状态。
(4)元素④⑤⑥的第一电离能由大到小的顺序为___________ (用元素符号表示)。

请回答下列问题:
(1)表中属于d区元素的是
(2)元素③的基态原子的电子排布式为
(3)元素⑦的基态原子核外电子云有
(4)元素④⑤⑥的第一电离能由大到小的顺序为
您最近一年使用:0次
名校
解题方法
10 . 已知五种前四周期的元素X、Y、Z、Q、T。其中,基态X原子的M层上有6种运动状态不同的电子;基态Y原子的简化电子排布式[Ar]3d84s2,基态Z原子的L层的p能级有一个空轨道;基态Q原子的L层的p能级只有一对成对电子;基态T原子的M层上p轨道为半充满状态。根据题给信息,回答有关问题:
(1)试推断这五种元素的符号:X:___________ ,Y:___________ ,Z:___________ ,Q:___________ ,T:___________ 。
(2)Y在元素周期表中的位置为___________ 。
(3)基态Z原子的轨道表示式为___________ 。
(4)对于T原子的p轨道2px、2py、2pz间的差异,下列说法错误的是___________ (填字母)。
a.电子云形状相同 b.原子轨道的对称类型不同
c.电子的能量不同 d.电子云空间伸展方向不同
(5)Z元素的最高价氧化物对应水化物的电离方程式为___________ 。
(1)试推断这五种元素的符号:X:
(2)Y在元素周期表中的位置为
(3)基态Z原子的轨道表示式为
(4)对于T原子的p轨道2px、2py、2pz间的差异,下列说法错误的是
a.电子云形状相同 b.原子轨道的对称类型不同
c.电子的能量不同 d.电子云空间伸展方向不同
(5)Z元素的最高价氧化物对应水化物的电离方程式为
您最近一年使用:0次

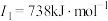 ,
,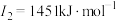 ,
,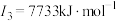 ,
,