解题方法
1 . 金属钛( )密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
)密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
(1) 元素在周期表中的分区是位于
元素在周期表中的分区是位于___________ 区。基态 原子中含有的未成对电子数是
原子中含有的未成对电子数是___________ 。
(2)金红石主要成分是钛的氧化物,该氧化物的晶胞形状为长方体,边长分别为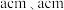 和
和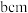 ,结构如下图所示。
,结构如下图所示。___________ , 位于距离最近的
位于距离最近的 构成的
构成的___________ 中心(填字母序号,下同)。
a.三角形 b.四面体 c.六面体 d.八面体
②该氧化物的晶体熔点为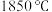 ,其晶体类型
,其晶体类型最不可 能是___________ 。
a.共价晶体 b.离子晶体 c.分子晶体
③若已知 该氧化物晶体体积为
该氧化物晶体体积为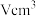 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为___________  。
。
(3)以钓铁矿 为原料,用美还原法冶炼金属钓的生产流程图如下:
为原料,用美还原法冶炼金属钓的生产流程图如下: 元素在元素周期表中的位置是
元素在元素周期表中的位置是___________ 。
②“高温氯化”时还得到一种可燃性气体,写出反应的化学方程式:___________ 。
③结合流程及下表数据,“分离”时所需控制的最低温度应为___________  。
。
④已知 和
和 的晶胞类型相同,
的晶胞类型相同, 和
和 的离子半径大小相近,解释
的离子半径大小相近,解释 熔点高于
熔点高于 的原因:
的原因:___________ 。
 )密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
)密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。(1)
 元素在周期表中的分区是位于
元素在周期表中的分区是位于 原子中含有的未成对电子数是
原子中含有的未成对电子数是(2)金红石主要成分是钛的氧化物,该氧化物的晶胞形状为长方体,边长分别为
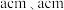 和
和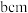 ,结构如下图所示。
,结构如下图所示。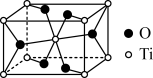
 位于距离最近的
位于距离最近的 构成的
构成的a.三角形 b.四面体 c.六面体 d.八面体
②该氧化物的晶体熔点为
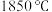 ,其晶体类型
,其晶体类型a.共价晶体 b.离子晶体 c.分子晶体
③若已知
 该氧化物晶体体积为
该氧化物晶体体积为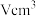 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为 。
。(3)以钓铁矿
 为原料,用美还原法冶炼金属钓的生产流程图如下:
为原料,用美还原法冶炼金属钓的生产流程图如下:
 元素在元素周期表中的位置是
元素在元素周期表中的位置是②“高温氯化”时还得到一种可燃性气体,写出反应的化学方程式:
③结合流程及下表数据,“分离”时所需控制的最低温度应为
 。
。 |  |  | |
熔点/ | 1668 | 651 | 714 |
沸点/ | 3287 | 1107 | 1412 |
 和
和 的晶胞类型相同,
的晶胞类型相同, 和
和 的离子半径大小相近,解释
的离子半径大小相近,解释 熔点高于
熔点高于 的原因:
的原因:
您最近半年使用:0次
解题方法
2 . 金属钛( )广泛应用于航空、军工、医疗等领域。某火电厂粉煤灰(主要成分为
)广泛应用于航空、军工、医疗等领域。某火电厂粉煤灰(主要成分为 、
、 、
、 、
、 、
、 、
、 等)的综合利用具有重要的经济价值和社会效益。工艺流程如下:
等)的综合利用具有重要的经济价值和社会效益。工艺流程如下: 形式存在,易水解;
形式存在,易水解;
②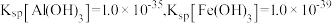 。
。
回答下列问题:
(1)基态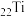 原子有
原子有_______ 个未成对电子,有_______ 个运动状态不同的电子。
(2)“酸浸”时,若要提高浸取速率,可采取的措施是_______ (任写一条)
(3)操作Ⅱ中加热将 水解得
水解得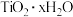 ,写出其反应的离子方程式:
,写出其反应的离子方程式:_______ 。
(4)由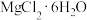 晶体得到无水
晶体得到无水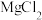 ,需要
,需要_______ 氛围中加热。
(5)为了使滤渣2沉淀完全(离子浓度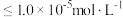 时认为沉淀完全),需“调
时认为沉淀完全),需“调 ”最小为
”最小为_______ 。
 )广泛应用于航空、军工、医疗等领域。某火电厂粉煤灰(主要成分为
)广泛应用于航空、军工、医疗等领域。某火电厂粉煤灰(主要成分为 、
、 、
、 、
、 、
、 、
、 等)的综合利用具有重要的经济价值和社会效益。工艺流程如下:
等)的综合利用具有重要的经济价值和社会效益。工艺流程如下: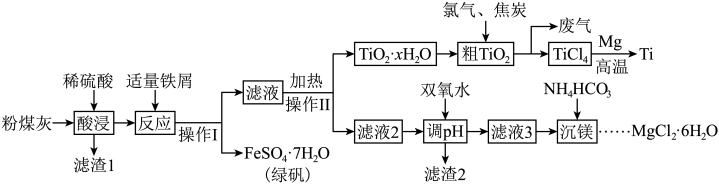
 形式存在,易水解;
形式存在,易水解;②
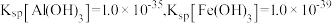 。
。回答下列问题:
(1)基态
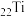 原子有
原子有(2)“酸浸”时,若要提高浸取速率,可采取的措施是
(3)操作Ⅱ中加热将
 水解得
水解得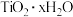 ,写出其反应的离子方程式:
,写出其反应的离子方程式:(4)由
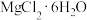 晶体得到无水
晶体得到无水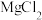 ,需要
,需要(5)为了使滤渣2沉淀完全(离子浓度
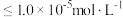 时认为沉淀完全),需“调
时认为沉淀完全),需“调 ”最小为
”最小为
您最近半年使用:0次
名校
解题方法
3 . 铁、铜及其化合物在生产生活中有着广泛应用。回答下列问题:
(1)基态 原子核外电子的运动状态有
原子核外电子的运动状态有___________ 种;
 易被氧化为
易被氧化为 ,画出
,画出 的结构示意图
的结构示意图___________ 。
(2) 是检验
是检验 的特征试剂,
的特征试剂, 中心离子配位数是
中心离子配位数是___________ ;1mol 中含有
中含有___________ mol 键,能够证明
键,能够证明 不能电离的试剂是
不能电离的试剂是___________ (填化学式)。
(3) 可形成配合物
可形成配合物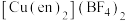 ,其中
,其中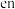 代表
代表 分子。该配合物
分子。该配合物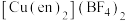 中配位离子所带电荷数为
中配位离子所带电荷数为___________ ,VSEPR模型为四面体的非金属原子共有___________ 个。 单晶的晶胞,其中原子坐标参数A为
单晶的晶胞,其中原子坐标参数A为 ;B为
;B为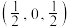 ;C为
;C为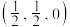 。则D原子的坐标参数为
。则D原子的坐标参数为___________ 。
(1)基态
 原子核外电子的运动状态有
原子核外电子的运动状态有 易被氧化为
易被氧化为 ,画出
,画出 的结构示意图
的结构示意图(2)
 是检验
是检验 的特征试剂,
的特征试剂, 中心离子配位数是
中心离子配位数是 中含有
中含有 键,能够证明
键,能够证明 不能电离的试剂是
不能电离的试剂是(3)
 可形成配合物
可形成配合物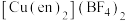 ,其中
,其中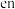 代表
代表 分子。该配合物
分子。该配合物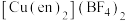 中配位离子所带电荷数为
中配位离子所带电荷数为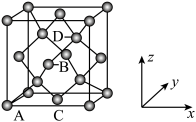
 单晶的晶胞,其中原子坐标参数A为
单晶的晶胞,其中原子坐标参数A为 ;B为
;B为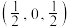 ;C为
;C为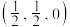 。则D原子的坐标参数为
。则D原子的坐标参数为
您最近半年使用:0次
名校
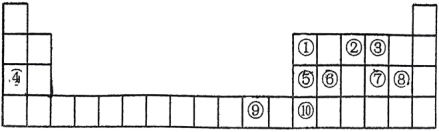
4 . 如图是元素周期表的一部分,根据元素在周期表中的位置,回答下列问题:__________ 种不同空间运动状态。⑨号元素在周期表中的位置是__________ ,基态时其最高能层的电子占据的原子轨道电子云轮廓为__________ 形。第二周期所有元素中第一电离能介于①②之间的有__________ 种。基态⑩原子的简化电子排布式__________ ,该元素位于__________ 区。
(2)元素⑦⑧可形成原子个数比为1:1的共价化合物,分子中各原子最外层均达到8电子的稳定结构,试写出其结构式__________ ,该分子为__________ (填“极性”或“非极性”)分子。
(3)下列有关性质的比较正确且能用元素周期律解释的是__________(填标号)。
(2)元素⑦⑧可形成原子个数比为1:1的共价化合物,分子中各原子最外层均达到8电子的稳定结构,试写出其结构式
(3)下列有关性质的比较正确且能用元素周期律解释的是__________(填标号)。
| A.非金属性:②>③ |
| B.气态最简单氢化物的稳定性:③>⑦ |
| C.最高价氧化物对应的水化物的碱性:④>⑤ |
| D.最简单氢化物的沸点:③>⑦ |
您最近半年使用:0次
5 . 现有六种元素,其中A、B、C、D、E为短周期主族元素,F为第4周期元素,它们的原子序数依次增大。请根据下列相关信息回答问题。
(1)B元素基态原子具有___________ 种运动状态不同的电子,能量最高的电子,其电子云在空间有___________ 个伸 展方向。
(2)根据上述信息,画出C元素基态原子的轨道表示式___________ 。
(3)F在元素周期表中属于___________ 区元素。
(4)写出DA3的电子式:___________ (用元素符号表示)。
| 元素 | 相关信息 |
| A | 元素的原子核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B | 元素原子的核外p电子数比s电子数少1 |
| C | 元素的第一至第四电离能分别是I1=738 kJ/mol、I2=1451 kJ/mol、I3= 7733 kJ/mol、I4= 10540 kJ/mol |
| D | 原子核外填充电子的所有p轨道全满或半满 |
| E | 元素的主族序数与周期序数的差为3 |
| F | 在元素周期表的第6列 |
(2)根据上述信息,画出C元素基态原子的轨道表示式
(3)F在元素周期表中属于
(4)写出DA3的电子式:
您最近半年使用:0次
名校
解题方法
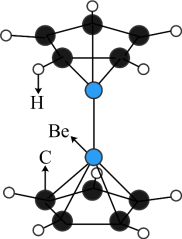
6 . 2023年6月,科学家首次合成含铍-铍能的固态化合物,相关成果发表于《科学》杂质。该分子入选2023年最“炫”分子榜单,其结构如图所示,回答下列问题: 原子最外层电子的电子云轮廓图为
原子最外层电子的电子云轮廓图为_____ (填序号)。
A.球形 B.哑铃形
(2)下列电子排布式分别代表铍微粒,其中失去1个电子所需能量最多的是_____。
(3)“固态双铍化合物的化学式为_____ ,它不含_____ (填标号)。
A.极性键 B.非极性键 C.金属键 D. 键
键
(4)卤化铍的熔点如表所示:
①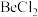 中
中 原子的杂化方式为
原子的杂化方式为_____ ;
②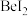
_____ (填“能”或“不能)溶于四氯化碳:
③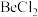 、
、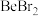 、
、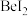 的熔点依次升高的原因是
的熔点依次升高的原因是_____ 。
(5) 易形成配离子
易形成配离子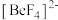 ,其中心阳离子的配位数为
,其中心阳离子的配位数为_____ ,配体是_____ (填化学符号),配离子的空间构型为_____ 。
(6)离子晶体中稳定配位多面体的理论半径比如表所示:
已知铍离子、氧离子的半径分别为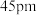 、
、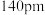 ,
, 的配位多面体是
的配位多面体是_____ 。
(7)Be的某种氧化物晶体是制备氟硼铍酸钾晶体的原料之一,其晶胞结构如图所示。这种氧化物的化学式为_____ ;设晶胞参数为 ,用
,用 表示阿伏加德罗参数的值,则
表示阿伏加德罗参数的值,则 晶体的密度为
晶体的密度为_____  (用含a和
(用含a和 的式子表示)。
的式子表示)。
 原子最外层电子的电子云轮廓图为
原子最外层电子的电子云轮廓图为A.球形 B.哑铃形
(2)下列电子排布式分别代表铍微粒,其中失去1个电子所需能量最多的是_____。
A.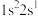 | B.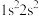 | C.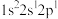 | D. |
(3)“固态双铍化合物的化学式为
A.极性键 B.非极性键 C.金属键 D.
 键
键(4)卤化铍的熔点如表所示:
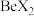 | 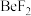 | 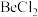 | 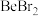 | 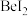 |
熔点/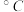 | 552 | 399 | 488 | 510 |
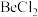 中
中 原子的杂化方式为
原子的杂化方式为②
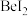
③
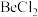 、
、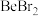 、
、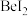 的熔点依次升高的原因是
的熔点依次升高的原因是(5)
 易形成配离子
易形成配离子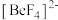 ,其中心阳离子的配位数为
,其中心阳离子的配位数为(6)离子晶体中稳定配位多面体的理论半径比如表所示:
| 配位多面体 | 配位数 | 半径比(r+/r-) |
| 平面三角形 | 3 | 0.15~0.225 |
| 四面体 | 4 | 0.225~0.414 |
| 八面体 | 6 | 0.414~0.732 |
| 立方体 | 8 | 0.732~1.000 |
| 立方八面体 | 12 | 1.000 |
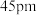 、
、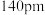 ,
, 的配位多面体是
的配位多面体是(7)Be的某种氧化物晶体是制备氟硼铍酸钾晶体的原料之一,其晶胞结构如图所示。这种氧化物的化学式为
 ,用
,用 表示阿伏加德罗参数的值,则
表示阿伏加德罗参数的值,则 晶体的密度为
晶体的密度为 (用含a和
(用含a和 的式子表示)。
的式子表示)。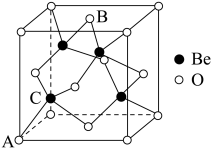
您最近半年使用:0次
名校
解题方法
7 . 现有七种元素,其中A、B、C、D、E为短周期主族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息回答问题:
(1)B的元素符号为___________ ,基态原子价电子轨道表示式为___________ 。
(2)基态D原子中能量最高的电子所在的原子轨道的电子云在空间有___________ 个伸展方向,原子轨道呈___________ 形。
(3)某同学根据上述信息,推断C基态原子的核外电子轨道表示式为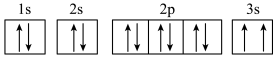 ,该同学所写的轨道表示式违反了
,该同学所写的轨道表示式违反了___________ 。
(4)E元素原子核外有___________ 种运动状态不同的电子。
(5)检验F元素的方法是___________ 。
| A | 元素原子半径在周期表中最小,也是宇宙中最丰富的元素 |
| B | 元素原子的核外p轨道总电子数比s轨道总电子数少1 |
| C | 元素的第一至第四电离能分别是I1=738 kJ·mol-1、I2=1 451 kJ·mol-1、I3=7 733 kJ·mol-1、I4=10 540 kJ·mol-1 |
| D | 原子核外所有p轨道全满或半满 |
| E | 元素的主族序数与周期序数的差为4,原子半径在同周期中最小 |
| F | 是前四周期中电负性最小的元素 |
(1)B的元素符号为
(2)基态D原子中能量最高的电子所在的原子轨道的电子云在空间有
(3)某同学根据上述信息,推断C基态原子的核外电子轨道表示式为
 ,该同学所写的轨道表示式违反了
,该同学所写的轨道表示式违反了(4)E元素原子核外有
(5)检验F元素的方法是
您最近半年使用:0次
解题方法
8 . 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G、H为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)写出BA3的电子式:_________ 。
(2)B元素基态原子中能量最高的电子,其电子云在空间有_____ 个取向,原子轨道呈___ 形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了_____ 。
(4)比较B和D的电负性_________ >_________ (填元素符号)。
(5)G的价电子轨道排布式为_________ 。
(6)H位于_________ 族,__________ 区,该元素的核外电子排布式为__________ 。
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下:I1=738kJ/mol、I2=1451kJ/mol、I3=7733kJ/mol、I4=10540kJ/mol |
| D原子价电子层的p轨道半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G是所在周期中未成对电子最多的元素 |
| H在周期表的第七列 |
(1)写出BA3的电子式:
(2)B元素基态原子中能量最高的电子,其电子云在空间有
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了(4)比较B和D的电负性
(5)G的价电子轨道排布式为
(6)H位于
您最近半年使用:0次
名校
解题方法
9 . 已知五种前四周期的元素X、Y、Z、Q、T。其中,基态X原子的M层上有6种运动状态不同的电子;基态Y原子的简化电子排布式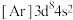 ,基态Z原子的L层的p能级有一个空轨道;基态Q原子的L层的p能级只有一对成对电子;基态T原子的M层上p轨道为半充满状态。根据题给信息,回答问题:
,基态Z原子的L层的p能级有一个空轨道;基态Q原子的L层的p能级只有一对成对电子;基态T原子的M层上p轨道为半充满状态。根据题给信息,回答问题:
(1)试推断这五种元素的符号:X:_____ ,Y:_____ ,Z:_____ ,Q:_____ ,T:_____ 。
(2)Y在元素周期表中的位置为_____________ 。
(3)基态Z原子的轨道表示式为_____________ 。
(4)对于T原子的p轨道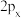 、
、 、
、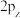 间的差异,下列说法错误的是
间的差异,下列说法错误的是____ (填字母)。
a.电子云形状相同 b.原子轨道的对称类型不同
c.电子的能量不同 d.电子云空间伸展方向不同
(5)Z元素的最高价氧化物对应水化物的电离方程式为______________ 。
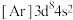 ,基态Z原子的L层的p能级有一个空轨道;基态Q原子的L层的p能级只有一对成对电子;基态T原子的M层上p轨道为半充满状态。根据题给信息,回答问题:
,基态Z原子的L层的p能级有一个空轨道;基态Q原子的L层的p能级只有一对成对电子;基态T原子的M层上p轨道为半充满状态。根据题给信息,回答问题:(1)试推断这五种元素的符号:X:
(2)Y在元素周期表中的位置为
(3)基态Z原子的轨道表示式为
(4)对于T原子的p轨道
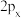 、
、 、
、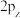 间的差异,下列说法错误的是
间的差异,下列说法错误的是a.电子云形状相同 b.原子轨道的对称类型不同
c.电子的能量不同 d.电子云空间伸展方向不同
(5)Z元素的最高价氧化物对应水化物的电离方程式为
您最近半年使用:0次
名校
解题方法
10 . 氮及其化合物应用广泛。回答下列问题:
(1)基态N原子处于最高能级的电子云轮廓图为__________ 形。
(2)胍(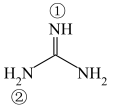 )为平面形分子,存在大π键
)为平面形分子,存在大π键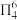 。胍属于
。胍属于__________ 分子(填“极性”或“非极性”),①号N原子H-N-C键角__________ ②号N原子H-N-C键角(填“>”“<”或“=”),胍易吸收空气中H2O和CO2,其原因是____________________________________ 。
(3)氮化钴属于立方晶系,经Cu掺杂得催化剂X,经Li掺杂得催化剂Y。
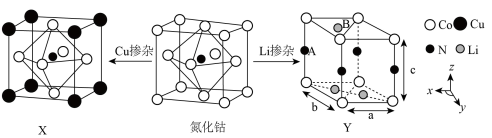
X属于立方晶系,晶胞参数为dpm,距离最近Co原子的核间距为__________ pm,Y属于六方晶系,晶胞参数为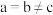 ,
, ,
,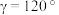 ,如A点原子的分数坐标为
,如A点原子的分数坐标为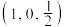 ,则B点Li原子的分数坐标为
,则B点Li原子的分数坐标为____________ ,1个N原子周围距离相等且最近的Li原子数目为_____________ 。
(1)基态N原子处于最高能级的电子云轮廓图为
(2)胍(
 )为平面形分子,存在大π键
)为平面形分子,存在大π键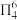 。胍属于
。胍属于(3)氮化钴属于立方晶系,经Cu掺杂得催化剂X,经Li掺杂得催化剂Y。

X属于立方晶系,晶胞参数为dpm,距离最近Co原子的核间距为
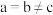 ,
, ,
,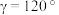 ,如A点原子的分数坐标为
,如A点原子的分数坐标为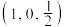 ,则B点Li原子的分数坐标为
,则B点Li原子的分数坐标为
您最近半年使用:0次



