2020·全国·零模
解题方法
1 . [化学——选修3:物质结构与性质](15分)
人体必需的元素包括常量元素与微量元素,常量元素包括碳、氢、氧、氮、钙、镁等,微量元素包括铁、铜、锌、氟、碘等,这些元素形成的化合物种类繁多,应用广泛。
(1)锌、铜、铁、钙四种元素与少儿生长发育息息相关,请写出Fe2+的核外电子排布式__________ 。
(2)1个Cu2+与2个H2N—CH2—COO−形成含两个五元环结构的内配盐(化合物),其结构简式为_______________ (用→标出配位键),在H2N—CH2—COO−中,属于第二周期的元素的第一电离能由大到小的顺序是__________ (用元素符号表示),N、C原子存在的相同杂化方式是_________ 杂化。
(3)碳酸盐中的阳离子不同,热分解温度就不同,查阅文献资料可知,离子半径r(Mg2+)=66 pm,r(Ca2+)=99 pm,r(Sr2+)=112 pm,r(Ba2+)=135 pm;碳酸盐分解温度T(MgCO3)=402℃,T(CaCO3)=825℃,T(SrCO3)=1172℃,T(BaCO3)=1360℃。分析数据得出的规律是_____________ ,解释出现此规律的原因是____________________________________ 。
(4)自然界的氟化钙矿物为萤石或氟石,CaF2的晶体结构呈立方体形,其结构如下:

①两个最近的F−之间的距离是___________ pm(用含m的代数式表示)。
②CaF2晶胞体积与8个F−形成的立方体的体积比为___________ 。
③CaF2晶胞的密度是___________ g·cm−3(化简至带根号的最简式,NA表示阿伏加 德罗常数的值)。
[化学——选修5:有机化学基础](15分)
药物H在人体内具有抑制白色念球菌的作用,H可经下图所示合成路线进行制备。

已知:硫醚键易被浓硫酸氧化。
回答下列问题:
(1)官能团−SH的名称为巯(qiú)基,−SH直接连在苯环上形成的物质属于硫酚,则A的名称为________________ 。D分子中含氧官能团的名称为________________ 。
(2)写出下列反应类型:A→C_____________ ,E→F_____________ 。
(3)F生成G的化学方程式为_______________________________________ 。
(4)下列关于D的说法正确的是_____________ (填标号)。(已知:同时连接四个各不相同的原子或原子团的碳原子称为手性碳原子)
A.分子式为C10H7O3FS
B.分子中有2个手性碳原子
C.能与NaHCO3溶液、AgNO3溶液发生反应
D.能发生取代、氧化、加成、还原等反应
(5)M与A互为同系物,分子组成比A多1个CH2,M分子的可能结构有_______ 种;其中核磁共振氢谱有4组峰,且峰面积比为2∶2∶2∶1的物质的结构简式为_____________ 。
(6)有机化合物K( )是合成广谱抗念球菌药物的重要中间体,参考上述流程,设计以
)是合成广谱抗念球菌药物的重要中间体,参考上述流程,设计以 为原料的合成K的路线。
为原料的合成K的路线。_____________
人体必需的元素包括常量元素与微量元素,常量元素包括碳、氢、氧、氮、钙、镁等,微量元素包括铁、铜、锌、氟、碘等,这些元素形成的化合物种类繁多,应用广泛。
(1)锌、铜、铁、钙四种元素与少儿生长发育息息相关,请写出Fe2+的核外电子排布式
(2)1个Cu2+与2个H2N—CH2—COO−形成含两个五元环结构的内配盐(化合物),其结构简式为
(3)碳酸盐中的阳离子不同,热分解温度就不同,查阅文献资料可知,离子半径r(Mg2+)=66 pm,r(Ca2+)=99 pm,r(Sr2+)=112 pm,r(Ba2+)=135 pm;碳酸盐分解温度T(MgCO3)=402℃,T(CaCO3)=825℃,T(SrCO3)=1172℃,T(BaCO3)=1360℃。分析数据得出的规律是
(4)自然界的氟化钙矿物为萤石或氟石,CaF2的晶体结构呈立方体形,其结构如下:

①两个最近的F−之间的距离是
②CaF2晶胞体积与8个F−形成的立方体的体积比为
③CaF2晶胞的密度是
[化学——选修5:有机化学基础](15分)
药物H在人体内具有抑制白色念球菌的作用,H可经下图所示合成路线进行制备。

已知:硫醚键易被浓硫酸氧化。
回答下列问题:
(1)官能团−SH的名称为巯(qiú)基,−SH直接连在苯环上形成的物质属于硫酚,则A的名称为
(2)写出下列反应类型:A→C
(3)F生成G的化学方程式为
(4)下列关于D的说法正确的是
A.分子式为C10H7O3FS
B.分子中有2个手性碳原子
C.能与NaHCO3溶液、AgNO3溶液发生反应
D.能发生取代、氧化、加成、还原等反应
(5)M与A互为同系物,分子组成比A多1个CH2,M分子的可能结构有
(6)有机化合物K(
 )是合成广谱抗念球菌药物的重要中间体,参考上述流程,设计以
)是合成广谱抗念球菌药物的重要中间体,参考上述流程,设计以 为原料的合成K的路线。
为原料的合成K的路线。
您最近一年使用:0次
2 . 化合物I是制备抗肿瘤药物阿法替尼的重要中间体,化合物I的一种合成路线如图。
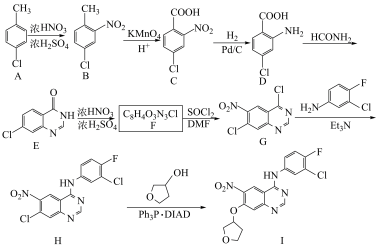
已知:RCH=NH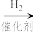 RCH2NH2
RCH2NH2
回答下列问题:
(1)C中含氧官能团的名称是______ 。
(2)A的化学名称为______ 。
(3)B中所含的第二周期元素第一电离能由大到小的顺序是______ 。
(4)F的结构简式为______ ,H→I的反应类型为______ 。
(5)G→H的化学方程式为______ 。
(6)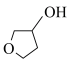 有多种同分异构体,符合下列条件的有
有多种同分异构体,符合下列条件的有______ 种(不考虑立体异构),其中核磁共振氢谱有3组峰,其峰面积比为6∶1∶1的结构简式为______ (写出一种)。
a.能发生银镜反应 b.不含醚键
(7)参考上述合成路线,以HOOCCH2NH2、HCONH2为原料合成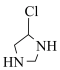 ,合成过程中无机试剂任选
,合成过程中无机试剂任选______ 。

已知:RCH=NH
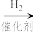 RCH2NH2
RCH2NH2回答下列问题:
(1)C中含氧官能团的名称是
(2)A的化学名称为
(3)B中所含的第二周期元素第一电离能由大到小的顺序是
(4)F的结构简式为
(5)G→H的化学方程式为
(6)
 有多种同分异构体,符合下列条件的有
有多种同分异构体,符合下列条件的有a.能发生银镜反应 b.不含醚键
(7)参考上述合成路线,以HOOCCH2NH2、HCONH2为原料合成
 ,合成过程中无机试剂任选
,合成过程中无机试剂任选
您最近一年使用:0次
2023-10-27更新
|
1051次组卷
|
4卷引用:广西南宁市2024届高三上学期毕业班摸底测试化学试题
广西南宁市2024届高三上学期毕业班摸底测试化学试题(已下线)考点3 烃的衍生物的结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)热点24 有机合成与推断综合题广西部分高中2024届高三第一次摸底测试化学试题
名校
解题方法
3 . 乙二胺四乙酸铁钠可用于感光材料冲洗药品及漂白剂,化学式为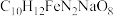 ;工业上可用EDTA与
;工业上可用EDTA与 、NaOH溶液发生反应进行制备,合成路线如下:
、NaOH溶液发生反应进行制备,合成路线如下:
(1)基态氯原子的价层电子排布图为___________ 。
(2)下列氮原子能量最高的是___________(填标号)。
(3)EDTA的组成元素中C、N、O的第一电离能由大到小顺序为___________ (填元素符号)。碳原子的杂化轨道类型为___________ 。
(4)NH3中N—H键的键角小于CH4中C—H键的键角,其原因为___________ 。
(5)某种Fe、N组成的磁性化合物的结构如图1所示,N随机排列在Fe构成的正八面体的空隙中。该磁性化合物的化学式为___________ 。___________ 区(填“s”“p”“d”或“ds”)。铁的某种晶胞沿面对角线的位置切下之后可以得到如图2所示的截面。假设铁的原子半径为a nm,则该铁晶体的密度为___________  (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
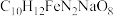 ;工业上可用EDTA与
;工业上可用EDTA与 、NaOH溶液发生反应进行制备,合成路线如下:
、NaOH溶液发生反应进行制备,合成路线如下: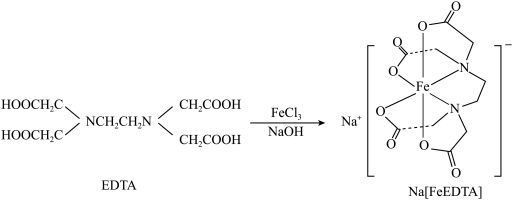
(1)基态氯原子的价层电子排布图为
(2)下列氮原子能量最高的是___________(填标号)。
A.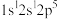 | B. | C. | D.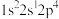 |
(4)NH3中N—H键的键角小于CH4中C—H键的键角,其原因为
(5)某种Fe、N组成的磁性化合物的结构如图1所示,N随机排列在Fe构成的正八面体的空隙中。该磁性化合物的化学式为
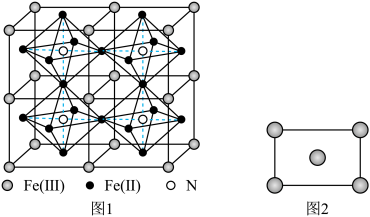
 (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2023-04-23更新
|
875次组卷
|
8卷引用:押题密卷 02-【热题狂飙】2023年高考化学样卷(全国卷专用)
(已下线)押题密卷 02-【热题狂飙】2023年高考化学样卷(全国卷专用)广西壮族自治区南宁市第二中学2023届高三下学期收网考理科综合化学试题(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)北京市第二中学2022-2023学年高二下学期期末考试化学试题北京市首都师范大学附属中学2023-2024学年高三下学期3月月考化学试题福建省百校联盟2023届高三第三次模拟考试化学试题福建省百校联盟2023届高三下学期第三次模拟考试化学试题2023届广西钦州市灵山县那隆中学高三下学期5月考前冲刺保温卷理综试卷-高中化学
4 . 异烟肼是一种抗结核药物的主要成分,可通过以下路线合成.已知吡啶(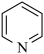 )与苯的性质相似。下列有关说法错误的是
)与苯的性质相似。下列有关说法错误的是
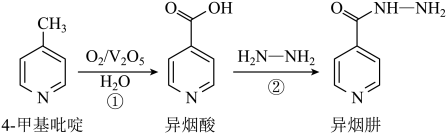
 )与苯的性质相似。下列有关说法错误的是
)与苯的性质相似。下列有关说法错误的是
| A.4-甲基吡啶的二氯取代物有5种 | B.异烟酸中第一电离能最大的元素是N |
| C.异烟肼属于分子晶体 | D.反应①为氧化反应,反应②为取代反应 |
您最近一年使用:0次
解题方法
5 . 我国科学家相继发明了具有重要工业应用价值的新型非线性光学晶体BBO、LBO,又陆续发展了具有重要应用前景的深紫外非线性光学晶体KBBF、SBBO等,为我国光学事业做出了卓越贡献。
请回答下列问题:
(1)KBBF的化学式为KBe2BO3F2,KBBF晶体的棱镜耦合技术在国际上首次实现了Nd:YVO4激光的6倍频谐波光输出。
①B的价电子层排布式为___________ 。
②Y的原子序数为39,其在元素周期表中的位置为___________ 。
③KBe2BO3F2中各元素的第一电离能由小到大的顺序为___________ 。
④KBF4是合成KBBF的原料之一,其阴离子的空间构型为___________ ,与该阴离子互为等电子体的离子为___________ 。
(2)BBO晶体和LBO晶体是我国首次走向国际,并被国际上广泛应用的两种晶体。LBO晶体由Li、B、O三种元素组成,晶胞结构及沿b、c轴的投影图如图甲所示(O原子略去),晶体结构中存在(B3O7)5-基团,Li+分布在基团骨架空隙中,如图乙所示。

①LBO晶体化合物的化学式为___________ 。
②该晶体中含有的化学键有___________ ,晶体类型为___________ ,其中B采取___________ 杂化。
③已知该晶体的晶胞参数分别为apm、bpm、cpm,α=β=y=90°,则该晶体的密度ρ=___________ g·cm-3。(设阿伏加德罗常数的值为NA,用含a、b、c、NA的代数式表示)
请回答下列问题:
(1)KBBF的化学式为KBe2BO3F2,KBBF晶体的棱镜耦合技术在国际上首次实现了Nd:YVO4激光的6倍频谐波光输出。
①B的价电子层排布式为
②Y的原子序数为39,其在元素周期表中的位置为
③KBe2BO3F2中各元素的第一电离能由小到大的顺序为
④KBF4是合成KBBF的原料之一,其阴离子的空间构型为
(2)BBO晶体和LBO晶体是我国首次走向国际,并被国际上广泛应用的两种晶体。LBO晶体由Li、B、O三种元素组成,晶胞结构及沿b、c轴的投影图如图甲所示(O原子略去),晶体结构中存在(B3O7)5-基团,Li+分布在基团骨架空隙中,如图乙所示。

①LBO晶体化合物的化学式为
②该晶体中含有的化学键有
③已知该晶体的晶胞参数分别为apm、bpm、cpm,α=β=y=90°,则该晶体的密度ρ=
您最近一年使用:0次
20-21高三·全国·阶段练习
解题方法
6 . 钛酸锌锂(Li2ZnTi3O8)是锂离子电池电极材料的一种,具有循环性能良好、安全性能优异、结构性能稳定的优点,可以通过TiO2、Li2CO3、(CH3COO)2Zn·2H2O等原料,采用高温固相法合成。回答下列问题:
(1)基态Ti原子的价电子排布式为___ ,第四周期的基态原子中,未成对电子数与基态Ti原子相等的元素有___ (填元素符号)。
(2)CH3COO-中含有的σ键和π键的个数比为___ ;在Li2CO3中,三种元素的第一电离能从大到小的顺序是__ 。CO 的杂化方式
的杂化方式__ 。
(3)Ti与Zn原子都采用六方最密堆积形成金属晶体,两者半径大小相近:Ti(144.8pm)、Zn(133.3pm),但金属Ti的熔点(1660℃)比Zn(419.53℃)高得多,原因是___ 。
(4)某六方晶系的一种钛钡矿石的晶胞如图所示,距离晶胞内的钛原子最近的氧原子有__ 个,Ti原子可看成填充在周围的氧原子组成的正八面体空隙中,则其O—Ti—O的键角为__ (填度数)。设该六方晶胞的棱长分别记为acm、bcm、ccm,阿伏加德罗常数的值为NA,该晶胞密度的表达式为___ g·cm-3。

(1)基态Ti原子的价电子排布式为
(2)CH3COO-中含有的σ键和π键的个数比为
 的杂化方式
的杂化方式(3)Ti与Zn原子都采用六方最密堆积形成金属晶体,两者半径大小相近:Ti(144.8pm)、Zn(133.3pm),但金属Ti的熔点(1660℃)比Zn(419.53℃)高得多,原因是
(4)某六方晶系的一种钛钡矿石的晶胞如图所示,距离晶胞内的钛原子最近的氧原子有

您最近一年使用:0次
解题方法
7 . 以北京大学马丁教授为代表的多个团队,研发出了高效的铁基(如FeC、Fe2C、Fe5C2、Fe3C)费托合成催化剂,以H2和CO为原料可高产率合成烯烃、烷烃,如3CO(g)+ 6H2(g)  CH3CH=CH2(g)+3H2O(g)、nCO+(2n+1)H2
CH3CH=CH2(g)+3H2O(g)、nCO+(2n+1)H2 CnH2n+2+nH2O,为煤的气化、液化使用开拓了新途径。
CnH2n+2+nH2O,为煤的气化、液化使用开拓了新途径。
(1)Fe3+中能量最高的能级上的电子云有_____ 种伸展方向,位于不同方向中运动的电子的能量大小关系是_________ 。当Fe原子电子排布由[Ar]3d64s2→[Ar]3d64s14p1时,体系的能量_______ (填“增大”或“减小”)。
(2)Fe、C、O三种元素的第一电离能由大到小的顺序为_____________ ;CH3CH=CH2分子中碳原子的杂化轨道类型为____ ,题干所述反应中CO分子中断裂的化学键类型为______ (填字母)。
A. 2个σ键、1个π键 B. 1个σ键、2个π键 C. 非极性键
(3)新戊烷[(CH3)4C]分子中5个碳原子形成的空间构型是____________ ,该分子是________ (填“极性”或“非极性”)分子。随着烃分子中碳原子数目的增加,同系物的沸点升高.其原因是__________ 。
(4)碳铁之间可形成多种化合物,其中一种化合物的晶体结构(面心立方结构)如图所示:
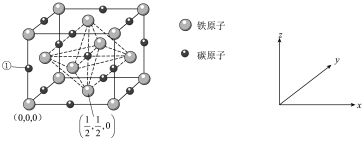
则编号为①的原子的坐标为_______________ ;该化合物的化学式为_______________ ,设该晶体的晶胞多数为a pm,阿伏加 德罗常数的值为NA,则该晶体的密度为_______________ g·cm-3(列出计算式即可)。
 CH3CH=CH2(g)+3H2O(g)、nCO+(2n+1)H2
CH3CH=CH2(g)+3H2O(g)、nCO+(2n+1)H2 CnH2n+2+nH2O,为煤的气化、液化使用开拓了新途径。
CnH2n+2+nH2O,为煤的气化、液化使用开拓了新途径。(1)Fe3+中能量最高的能级上的电子云有
(2)Fe、C、O三种元素的第一电离能由大到小的顺序为
A. 2个σ键、1个π键 B. 1个σ键、2个π键 C. 非极性键
(3)新戊烷[(CH3)4C]分子中5个碳原子形成的空间构型是
(4)碳铁之间可形成多种化合物,其中一种化合物的晶体结构(面心立方结构)如图所示:

则编号为①的原子的坐标为
您最近一年使用:0次



