名校
解题方法
1 . 乙二胺四乙酸铁钠可用于感光材料冲洗药品及漂白剂,化学式为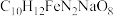 ;工业上可用EDTA与
;工业上可用EDTA与 、NaOH溶液发生反应进行制备,合成路线如下:
、NaOH溶液发生反应进行制备,合成路线如下:
(1)基态氯原子的价层电子排布图为___________ 。
(2)下列氮原子能量最高的是___________(填标号)。
(3)EDTA的组成元素中C、N、O的第一电离能由大到小顺序为___________ (填元素符号)。碳原子的杂化轨道类型为___________ 。
(4)NH3中N—H键的键角小于CH4中C—H键的键角,其原因为___________ 。
(5)某种Fe、N组成的磁性化合物的结构如图1所示,N随机排列在Fe构成的正八面体的空隙中。该磁性化合物的化学式为___________ 。___________ 区(填“s”“p”“d”或“ds”)。铁的某种晶胞沿面对角线的位置切下之后可以得到如图2所示的截面。假设铁的原子半径为a nm,则该铁晶体的密度为___________  (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
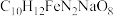 ;工业上可用EDTA与
;工业上可用EDTA与 、NaOH溶液发生反应进行制备,合成路线如下:
、NaOH溶液发生反应进行制备,合成路线如下: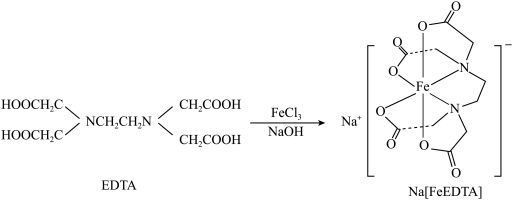
(1)基态氯原子的价层电子排布图为
(2)下列氮原子能量最高的是___________(填标号)。
A.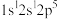 | B.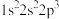 | C. | D.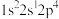 |
(4)NH3中N—H键的键角小于CH4中C—H键的键角,其原因为
(5)某种Fe、N组成的磁性化合物的结构如图1所示,N随机排列在Fe构成的正八面体的空隙中。该磁性化合物的化学式为
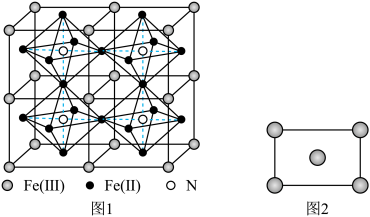
 (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2023-04-23更新
|
875次组卷
|
8卷引用:押题密卷 02-【热题狂飙】2023年高考化学样卷(全国卷专用)
(已下线)押题密卷 02-【热题狂飙】2023年高考化学样卷(全国卷专用)广西壮族自治区南宁市第二中学2023届高三下学期收网考理科综合化学试题(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)北京市第二中学2022-2023学年高二下学期期末考试化学试题北京市首都师范大学附属中学2023-2024学年高三下学期3月月考化学试题福建省百校联盟2023届高三第三次模拟考试化学试题福建省百校联盟2023届高三下学期第三次模拟考试化学试题2023届广西钦州市灵山县那隆中学高三下学期5月考前冲刺保温卷理综试卷-高中化学
名校
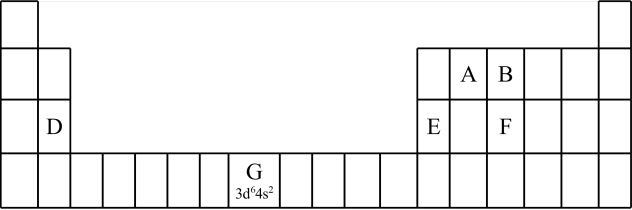
2 . 1869年,俄国化学家门捷列夫提出了元素周期律,并在此基础上发表了第一张元素周期表。为了纪念元素周期表诞生150年,联合国将2019年定为“国际化学元素周期表年”,并认为元素周期表是“科学共同的语言”。
(1)认识元素周期表的结构:___________ 区。
②2017年5月9日我国发布了113号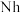 、115号
、115号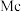 、117号
、117号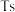 、118号
、118号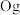 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是___________ (填字母序号)。
a.113号元素在周期表中的位置是第七周期 族
族
b.117号元素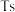 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体
c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:
(2)认识原子结构与元素周期表的关系:见表中元素 的信息,其中 “
的信息,其中 “ ”称为该元素原子的
”称为该元素原子的___________ ,该元素 能层上具有
能层上具有___________ 种不同运动状态的电子。
(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D_______ E(填“>” “<”或“=”)。
②气态氢化物的沸点:B_____ F (填“>”“<”或“=”),理由是___________ 。B的另一种氢化物可以作为火箭推进剂的燃料之一,其电子式为___________ 。
(1)认识元素周期表的结构:
②2017年5月9日我国发布了113号
 、115号
、115号 、117号
、117号 、118号
、118号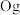 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是a.113号元素在周期表中的位置是第七周期
 族
族b.117号元素
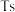 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:

(2)认识原子结构与元素周期表的关系:见表中元素
 的信息,其中 “
的信息,其中 “ ”称为该元素原子的
”称为该元素原子的 能层上具有
能层上具有(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D
②气态氢化物的沸点:B
您最近一年使用:0次
2024-04-26更新
|
57次组卷
|
2卷引用:名校期中好题汇编-分子结构与性质(非选择题)
2023高三·全国·专题练习
3 . 1869年,俄国化学家门捷列夫提出了元素周期律,并在此基础上发表了第一张元素周期表。为了纪念元素周期表诞生150年,联合国将2019年定为“国际化学元素周期表年”,并认为元素周期表是“科学共同的语言”。
(1)认识元素周期表的结构:
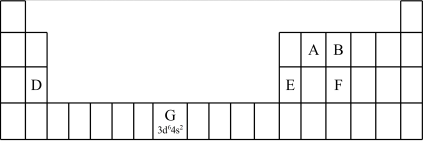
①在元素周期表中,第ⅠB、ⅡB元素属于___________ 区。
②2017年5月9日我国发布了113号Nh、115号Mc、117号Ts、118号Og四种元素,则下列说法正确的是___________ (填字母序号)。
a.113号元素在周期表中的位置是第七周期VB族
b.117号元素Ts位于金属与非金属分界线上,属于准金属,可能是半导体
c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:Nh>Mc
(2)认识原子结构与元素周期表的关系:见表中元素G的信息,其中“3d64s2”称为该元素原子的___________ ,该元素M能层上具有___________ 种不同运动状态的电子。
(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D___________ E(填“>”“<”或“=”)。
②气态氢化物的沸点:B___________ F(填“>”“<”或“=”),理由是___________ 。
(1)认识元素周期表的结构:

①在元素周期表中,第ⅠB、ⅡB元素属于
②2017年5月9日我国发布了113号Nh、115号Mc、117号Ts、118号Og四种元素,则下列说法正确的是
a.113号元素在周期表中的位置是第七周期VB族
b.117号元素Ts位于金属与非金属分界线上,属于准金属,可能是半导体
c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:Nh>Mc
(2)认识原子结构与元素周期表的关系:见表中元素G的信息,其中“3d64s2”称为该元素原子的
(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D
②气态氢化物的沸点:B
您最近一年使用:0次
4 . 不同元素的第一电离能 如下图所示。试根据元素在元素周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
如下图所示。试根据元素在元素周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
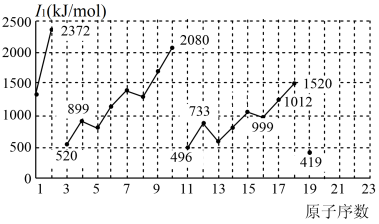
(1)总结同主族内不同元素的 变化的特点
变化的特点______ 。
(2)同周期内,随原子序数增大, 增大。但个别元素的
增大。但个别元素的 出现反常,试预测下列关系中正确的是
出现反常,试预测下列关系中正确的是_______ (填序号)。
① (砷)>
(砷)>  (硒) ②
(硒) ② (砷)<
(砷)<  (硒)
(硒)
③ (溴) >
(溴) >  (硒) ④
(硒) ④ (溴) <
(溴) <  (硒)
(硒)
(3)解释10号元素 较大的原因
较大的原因______ 。
(4)请估计1mol气态基态Ca原子失去最外层一个电子所需能量E的范围______ 。
 如下图所示。试根据元素在元素周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
如下图所示。试根据元素在元素周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
(1)总结同主族内不同元素的
 变化的特点
变化的特点(2)同周期内,随原子序数增大,
 增大。但个别元素的
增大。但个别元素的 出现反常,试预测下列关系中正确的是
出现反常,试预测下列关系中正确的是①
 (砷)>
(砷)>  (硒) ②
(硒) ② (砷)<
(砷)<  (硒)
(硒)③
 (溴) >
(溴) >  (硒) ④
(硒) ④ (溴) <
(溴) <  (硒)
(硒)(3)解释10号元素
 较大的原因
较大的原因(4)请估计1mol气态基态Ca原子失去最外层一个电子所需能量E的范围
您最近一年使用:0次
解题方法
5 . 我国科学家相继发明了具有重要工业应用价值的新型非线性光学晶体BBO、LBO,又陆续发展了具有重要应用前景的深紫外非线性光学晶体KBBF、SBBO等,为我国光学事业做出了卓越贡献。
请回答下列问题:
(1)KBBF的化学式为KBe2BO3F2,KBBF晶体的棱镜耦合技术在国际上首次实现了Nd:YVO4激光的6倍频谐波光输出。
①B的价电子层排布式为___________ 。
②Y的原子序数为39,其在元素周期表中的位置为___________ 。
③KBe2BO3F2中各元素的第一电离能由小到大的顺序为___________ 。
④KBF4是合成KBBF的原料之一,其阴离子的空间构型为___________ ,与该阴离子互为等电子体的离子为___________ 。
(2)BBO晶体和LBO晶体是我国首次走向国际,并被国际上广泛应用的两种晶体。LBO晶体由Li、B、O三种元素组成,晶胞结构及沿b、c轴的投影图如图甲所示(O原子略去),晶体结构中存在(B3O7)5-基团,Li+分布在基团骨架空隙中,如图乙所示。

①LBO晶体化合物的化学式为___________ 。
②该晶体中含有的化学键有___________ ,晶体类型为___________ ,其中B采取___________ 杂化。
③已知该晶体的晶胞参数分别为apm、bpm、cpm,α=β=y=90°,则该晶体的密度ρ=___________ g·cm-3。(设阿伏加德罗常数的值为NA,用含a、b、c、NA的代数式表示)
请回答下列问题:
(1)KBBF的化学式为KBe2BO3F2,KBBF晶体的棱镜耦合技术在国际上首次实现了Nd:YVO4激光的6倍频谐波光输出。
①B的价电子层排布式为
②Y的原子序数为39,其在元素周期表中的位置为
③KBe2BO3F2中各元素的第一电离能由小到大的顺序为
④KBF4是合成KBBF的原料之一,其阴离子的空间构型为
(2)BBO晶体和LBO晶体是我国首次走向国际,并被国际上广泛应用的两种晶体。LBO晶体由Li、B、O三种元素组成,晶胞结构及沿b、c轴的投影图如图甲所示(O原子略去),晶体结构中存在(B3O7)5-基团,Li+分布在基团骨架空隙中,如图乙所示。

①LBO晶体化合物的化学式为
②该晶体中含有的化学键有
③已知该晶体的晶胞参数分别为apm、bpm、cpm,α=β=y=90°,则该晶体的密度ρ=
您最近一年使用:0次
解题方法
6 . 如图是原子序数为1~19的元素第一电离能的变化曲线(其中部分元素第一电离能已经标出数据)。结合元素在元素周期表中的位置,分析图中曲线的变化特点,并回答下列有关问题。
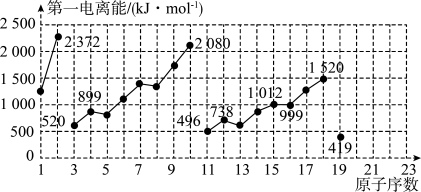
(1)碱金属元素中Li、Na、K的第一电离能分别为_____________  、
、 _____________  、
、 _____________  。
。
(2)同主族中不同元素的第一电离能变化的规律为:_____________ ,碱金属元素这一变化的规律与碱金属的活泼性的关系是 _____________ 。
(3)钙元素的第一电离能的数值范围为_____________ 。

(1)碱金属元素中Li、Na、K的第一电离能分别为
 、
、  、
、  。
。(2)同主族中不同元素的第一电离能变化的规律为:
(3)钙元素的第一电离能的数值范围为
您最近一年使用:0次
解题方法
7 . 利用废镍催化剂(主要含金属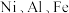 及其氧化物)合成硫酸镍晶体的一种工艺流程如下:
及其氧化物)合成硫酸镍晶体的一种工艺流程如下: 如表所示:
如表所示:
回答下列问题:
(1)“碱浸”时发生的主要反应的离子方程式为___________ 。
(2)“滤液②”中含有的金属离子是___________ 。
(3)若“转化”后的溶液中 浓度为
浓度为 ,则“调
,则“调 ”应控制的
”应控制的 范围是
范围是___________ 。
(4)资料显示,硫酸镍结晶水合物的形态与温度有如下关系。
由 溶液获得稳定的
溶液获得稳定的 晶体的操作依次是蒸发浓缩、
晶体的操作依次是蒸发浓缩、___________ 、过滤、洗涤、干燥。
(5)①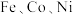 三种元素二价离子的硫酸盐晶体的晶胞类型相同,其熔点由高到低的顺序为
三种元素二价离子的硫酸盐晶体的晶胞类型相同,其熔点由高到低的顺序为___________ ;
② 中阴离子的空间构型为
中阴离子的空间构型为___________ ;
③丁二酮肟常用于检验 。在稀氨水中,丁二酮肟与
。在稀氨水中,丁二酮肟与 反应生成鲜红色沉淀,其结构如图所示:
反应生成鲜红色沉淀,其结构如图所示: 的配位数为
的配位数为___________ ;丁二酮肟分子中所含的第二周期元素的第一电离能由大到小的顺序为___________ 。
 及其氧化物)合成硫酸镍晶体的一种工艺流程如下:
及其氧化物)合成硫酸镍晶体的一种工艺流程如下: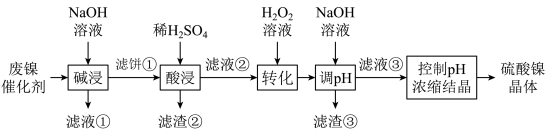
 如表所示:
如表所示:| 金属离子 |  |  |  |  |
开始沉淀时 的 的 | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时 的 的 | 8.7 | 4.7 | 3.2 | 9.0 |
(1)“碱浸”时发生的主要反应的离子方程式为
(2)“滤液②”中含有的金属离子是
(3)若“转化”后的溶液中
 浓度为
浓度为 ,则“调
,则“调 ”应控制的
”应控制的 范围是
范围是(4)资料显示,硫酸镍结晶水合物的形态与温度有如下关系。
| 温度 | 低于30.8℃ | 30.8~53.8℃ | 53.8~280℃ | 高于280℃ |
| 晶体形态 |  |  | 多种结晶水合物 |  |
 溶液获得稳定的
溶液获得稳定的 晶体的操作依次是蒸发浓缩、
晶体的操作依次是蒸发浓缩、(5)①
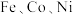 三种元素二价离子的硫酸盐晶体的晶胞类型相同,其熔点由高到低的顺序为
三种元素二价离子的硫酸盐晶体的晶胞类型相同,其熔点由高到低的顺序为②
 中阴离子的空间构型为
中阴离子的空间构型为③丁二酮肟常用于检验
 。在稀氨水中,丁二酮肟与
。在稀氨水中,丁二酮肟与 反应生成鲜红色沉淀,其结构如图所示:
反应生成鲜红色沉淀,其结构如图所示: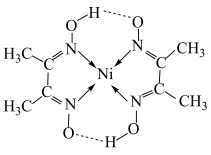
 的配位数为
的配位数为
您最近一年使用:0次



