解题方法
1 . 一个外围电子构型为2s22p5的元素,下列有关它的描述不正确的是
| A.原子序数为9 | B.电负性是所有元素中最大的 |
| C.原子半径是同周期元素中最小的 | D.第一电离能是所有元素中最大的 |
您最近一年使用:0次
名校
解题方法
2 . 现有a、b、c、d、e五种前四周期的元素,它们的原子序数依次增大,请根据下列相关信息,回答有关问题:
(1)元素a的名称是_______ ,b元素的基态电子排布式_______ ,c元素在元素周期表中的位置_______ 。
(2)d元素基态原子中最高能层符号是_______ ,核外电子的空间运动状态有_______ 种。
(3)e元素处于周期表的_______ 区,价层电子排布图为_______ 。
(4)元素a、b、d的电负性由大到小的顺序是_______ (用元素符号表示);元素c的第一电离能比元素d的要小,原因是_______ 。
(5)元素b、c、d的最高价氧化物的水化物酸性由强到弱的顺序是_______ (用化学式表示)。
| a元素的核外电子数等于电子层数 |
| b元素基态原子的核外s电子是p电子的2倍 |
| c元素最高正价与最低负价的代数和为4 |
d元素的价层电子排布式为: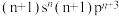 |
| e元素基态原子中单电子数是本周期中最多的元素 |
(2)d元素基态原子中最高能层符号是
(3)e元素处于周期表的
(4)元素a、b、d的电负性由大到小的顺序是
(5)元素b、c、d的最高价氧化物的水化物酸性由强到弱的顺序是
您最近一年使用:0次
3 . 下列有关描述正确的是
| A.第一电离能:B>Be>Li |
| B.电负性:F>N>O |
C. 的核外电子排布式为: 的核外电子排布式为: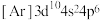 |
D.基态Cr原子的价电子排布图: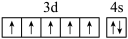 |
您最近一年使用:0次
名校
解题方法
4 . 自然界中不存在氟的单质,得到单质氟的过程中,不少科学家为此献出了宝费的生命。1886年,法国化学家莫瓦桑发明了莫氏电炉,用电解法成功地制取了单质氟,因此荣获1906年诺贝尔化学奖,氟及其化合物在生产及生活中有着广泛的用途。请回答下列问题:
(1)氟磷灰石可用于制取磷肥,基态P原子有_______ 个未成对电子, 的中心P原子的杂化方式为
的中心P原子的杂化方式为_______ 。
(2)氟气可以用于制取情性强于N2的保护气SF6,也可以用于制取聚合反应的催化剂PF3,PF3可以作为工业制取硅单质的中间物质(SiF4)的原料。
①SiF4分子的空间结构为_______ 。
②S、P、Si的第一电离能由大到小的顺序为_______ 。
(3)氟气可以用于制取高化学稳定性材料聚四氟乙烯的原料四氟乙烯(C2F4),50g四氟乙烯含σ键的数目为_______ 。
(4)工业上电解Al2O3制取单质铝,常利用冰晶石Na3AlF6降低Al2O3的熔点。Na、Al、F的电负性由小到大的顺序为_______ ,工业上不用电解AlCl3制取铝的原因为_______ 。
(1)氟磷灰石可用于制取磷肥,基态P原子有
 的中心P原子的杂化方式为
的中心P原子的杂化方式为(2)氟气可以用于制取情性强于N2的保护气SF6,也可以用于制取聚合反应的催化剂PF3,PF3可以作为工业制取硅单质的中间物质(SiF4)的原料。
①SiF4分子的空间结构为
②S、P、Si的第一电离能由大到小的顺序为
(3)氟气可以用于制取高化学稳定性材料聚四氟乙烯的原料四氟乙烯(C2F4),50g四氟乙烯含σ键的数目为
(4)工业上电解Al2O3制取单质铝,常利用冰晶石Na3AlF6降低Al2O3的熔点。Na、Al、F的电负性由小到大的顺序为
您最近一年使用:0次
2024-01-11更新
|
96次组卷
|
3卷引用:河北省石家庄市第二十四中学2023-2024学年高二上学期12月月考化学试题
名校
5 . 助力神舟十三号载人飞船顺利飞向太空的运载火箭发动机以偏二甲肼和液态 为主要燃料,工作时发生的反应为:
为主要燃料,工作时发生的反应为: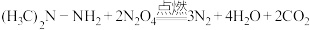 。下列有关说法错误的是
。下列有关说法错误的是
 为主要燃料,工作时发生的反应为:
为主要燃料,工作时发生的反应为: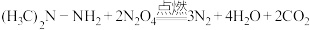 。下列有关说法错误的是
。下列有关说法错误的是A.偏二甲肼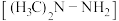 分子中C、N原子的杂化方式不同 分子中C、N原子的杂化方式不同 |
| B.H、C、N、O电负性依次增大 |
| C.C、N、O第一电离能由大到小的顺序为:N、O、C |
D.等物质的量的 、 、 分子含有相同数目的 分子含有相同数目的 键 键 |
您最近一年使用:0次
2023-05-07更新
|
106次组卷
|
2卷引用:河北省唐县第一中学2022-2023学年高二下学期5月月考化学试题
名校
6 . 下列有关物质结构与性质的理解正确的是
| A.电负性大的元素,其第一电离能一定大 |
| B.σ键存在于所有分子中 |
C. 、 、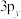 、 、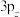 三个轨道相互垂直,能量相等 三个轨道相互垂直,能量相等 |
| D.干冰和冰的结构表明范德华力和氢键通常都具有方向性 |
您最近一年使用:0次
7 .  固定是实现碳达峰、碳中和的有效途径。使用不同催化剂,
固定是实现碳达峰、碳中和的有效途径。使用不同催化剂, 固定的产物也不同。在戊二酸锌催化下,
固定的产物也不同。在戊二酸锌催化下, 固定方式主要有:
固定方式主要有:
(1)一个基态氧原子的价层电子轨道表示式为___________ ;基态碳原子核外有___________ 个未成对电子。
(2)乙中所含元素电负性由大到小的顺序为___________ (填元素符号),乙中碳原子的杂化类型是___________ 。
(3)戊二酸、丙二酸二甲酯的沸点分别为303℃、181℃,它们沸点差别较大的原因是___________ 。
(4)配离子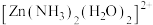 的空间结构只有1种,由此推知
的空间结构只有1种,由此推知 的空间结构是
的空间结构是___________ 。
(5)ZnO晶胞结构如图所示。已知:ZnO晶体的密度为 ,
, 代表阿伏加德罗常数的值。氧和锌的最近距离为
代表阿伏加德罗常数的值。氧和锌的最近距离为___________ nm。
 固定是实现碳达峰、碳中和的有效途径。使用不同催化剂,
固定是实现碳达峰、碳中和的有效途径。使用不同催化剂, 固定的产物也不同。在戊二酸锌催化下,
固定的产物也不同。在戊二酸锌催化下, 固定方式主要有:
固定方式主要有: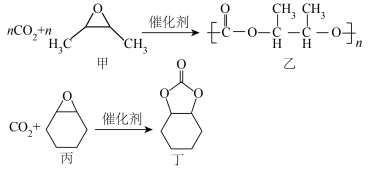
(1)一个基态氧原子的价层电子轨道表示式为
(2)乙中所含元素电负性由大到小的顺序为
(3)戊二酸、丙二酸二甲酯的沸点分别为303℃、181℃,它们沸点差别较大的原因是
(4)配离子
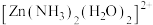 的空间结构只有1种,由此推知
的空间结构只有1种,由此推知 的空间结构是
的空间结构是(5)ZnO晶胞结构如图所示。已知:ZnO晶体的密度为
 ,
, 代表阿伏加德罗常数的值。氧和锌的最近距离为
代表阿伏加德罗常数的值。氧和锌的最近距离为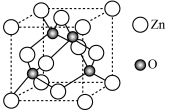
您最近一年使用:0次
2023-12-23更新
|
85次组卷
|
2卷引用:河北省保定市高碑店市崇德实验中学2023-2024学年高三上学期期末考试化学试题
名校
解题方法
8 . 短周期x、y、z、m、n五种主族元素,原子序数依次增大,x元素的某种原子可以在考古时用来测定文物年代。常温时,测得0.1mol/L y、m、n简单氢化物的水溶液pH分别为11、4、1。且z、m还可以与Na形成如图所以结构的化合物。以下有关说法错误的是
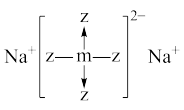
| A.原子半径:z<m<n |
| B.简单氢化物的沸点:x<y<z |
| C.电负性:z>y>x |
| D.x的最高价氧化物中各原子均满足8e-稳定结构 |
您最近一年使用:0次
2022-03-06更新
|
231次组卷
|
2卷引用:河北省邯郸市2021~2022学年高二上学期期末考试化学试题
9 . 前四周期原子序数依次增大的元素a、b、c、d中,a和b的价电子层中未成对电子均只有1个。并且a—和b+的电子数相差8;c和d与b位于同一周期,c和d的价电子层中的未成对电子数分别为4和2,且原子序数相差2。回答下列问题:
(1)a元素在元素周期表中的位置是___________ ,属于___________ 区。
(2)基态b原子中。电子占据最高能层的符号是___________ , 基态b+占据的最高能级共有___________ 个原子轨道。
(3)d元素基态原子的简化电子排布式为___________ 。
(4)a、b、c、d四种元素中,电负性最大的为___________ (填元素符号)。
(5)a、b、d三种元素的第一电离能由大到小的顺序为___________ (填元素符号)。
(6)Mn和c两种元素的部分电离能数据如表所示:
比较两元素的I2、 I3可知,气态Mn2+再失去一个电子比气态c2+再失去一个电子更难,原因是___________ 。
(1)a元素在元素周期表中的位置是
(2)基态b原子中。电子占据最高能层的符号是
(3)d元素基态原子的简化电子排布式为
(4)a、b、c、d四种元素中,电负性最大的为
(5)a、b、d三种元素的第一电离能由大到小的顺序为
(6)Mn和c两种元素的部分电离能数据如表所示:
| 元素 | 电离能/(kJ·mol-1) | ||
| I1 | I2 | I3 | |
| c元素 | 759 | 1561 | 2957 |
| Mn元素 | 717 | 1509 | 3248 |
比较两元素的I2、 I3可知,气态Mn2+再失去一个电子比气态c2+再失去一个电子更难,原因是
您最近一年使用:0次
10 . 重水是含有较多 和
和 的水,重水对工农业生成有很大危害,其中含有
的水,重水对工农业生成有很大危害,其中含有 和
和 的重水叫暂时硬水,含有
的重水叫暂时硬水,含有 、
、 、
、 和
和 等的重水叫永久硬水,回答下面问题:
等的重水叫永久硬水,回答下面问题:
(1)画出Ca原子的原子结构示意图___________ ,硫元素在元素周期表的位置___________ ,属于___________ 区。
(2)写出基态N原子的电子排布式___________ ,画出基态O原子的价电子排布图___________ 。基态N原子的第一电离能比O原子的要大的原因是___________ 。
(3)若将基态镁原子最高能级的电子排布图表示为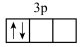 ,则它违背的电子排布规律是
,则它违背的电子排布规律是___________ 、___________ ,基态硫原子核外电子所处最高能级轨道的形状为___________ 。
(4)EDTA是硬水软化常用的化学试剂,与镁离子结合为
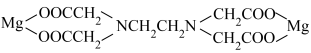
其中C、N、O、Mg四种元素的电负性由大到小的顺序是___________ ,原子半径最大的是___________ (填元素符号,下同),四种元素中基态原子核外单电子数最多的是___________ 。
(5)钙元素与铬元素、铜元素位于同一周期,写出铬、铜基态原子的价电子排布式___________ 、___________ 。
 和
和 的水,重水对工农业生成有很大危害,其中含有
的水,重水对工农业生成有很大危害,其中含有 和
和 的重水叫暂时硬水,含有
的重水叫暂时硬水,含有 、
、 、
、 和
和 等的重水叫永久硬水,回答下面问题:
等的重水叫永久硬水,回答下面问题:(1)画出Ca原子的原子结构示意图
(2)写出基态N原子的电子排布式
(3)若将基态镁原子最高能级的电子排布图表示为
 ,则它违背的电子排布规律是
,则它违背的电子排布规律是(4)EDTA是硬水软化常用的化学试剂,与镁离子结合为
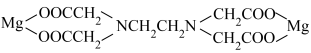
其中C、N、O、Mg四种元素的电负性由大到小的顺序是
(5)钙元素与铬元素、铜元素位于同一周期,写出铬、铜基态原子的价电子排布式
您最近一年使用:0次



