名校
解题方法
1 . 由于铁氮化合物具有非常优异的磁性能、机械性能和耐腐蚀性,受到研究人员的广泛关注。γˊ−Fe4N是一种性能优异的铁氮化合物,其可由氨气与羰基铁粉[Fe(CO)5]反应得到。
(1)Fe变为Fe2+时是失去___________ 轨道电子,Fe3+价层电子排布图为___________ 。
(2)氨气中N的杂化类型是___________ ,NH3中H−N−H的键角比NH4+中H−N−H的键角___________ (填“大”或“小”),理由是___________ 。
(3) 与CO中均存在化学键的类型有
与CO中均存在化学键的类型有___________ (填标号)。
A.离子键 B.氢键 C.配位键 D.共价键 E.金属键
(4)羰基铁粉[Fe(CO)5]中铁元素的配位数是___________ ,配位原子为___________ 。
(5)氨气与羰基铁粉的反应中涉及元素电负性由大到小的顺序为___________ 。
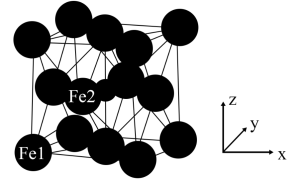
(6)γ−Fe4N的晶胞如图所示,设晶胞中Fe1点的原子坐标为(0,0,0),N点的原子坐标为( ,
, ,
, ),则Fe2点的原子坐标为
),则Fe2点的原子坐标为___________ 。已知该晶体的密度为dg/cm3,阿伏加德罗常数的值为NA,则晶胞参数a为___________ nm(用含d和NA的代数式表示)。
(1)Fe变为Fe2+时是失去
(2)氨气中N的杂化类型是
(3)
 与CO中均存在化学键的类型有
与CO中均存在化学键的类型有A.离子键 B.氢键 C.配位键 D.共价键 E.金属键
(4)羰基铁粉[Fe(CO)5]中铁元素的配位数是
(5)氨气与羰基铁粉的反应中涉及元素电负性由大到小的顺序为
(6)γ−Fe4N的晶胞如图所示,设晶胞中Fe1点的原子坐标为(0,0,0),N点的原子坐标为(
 ,
, ,
, ),则Fe2点的原子坐标为
),则Fe2点的原子坐标为
您最近一年使用:0次
2021-12-31更新
|
289次组卷
|
5卷引用:石家庄示范性高中2022届高三上学期调研考试化学试题
名校
解题方法
2 . 对 Na 、Mg 、Al 的有关性质的叙述不正确的是
| A.第一电离能:Na<Mg<Al |
| B.电负性:Na<Mg<Al |
| C.还原性:Na>Mg>Al |
| D.最高价氧化物的水化物碱性:NaOH>Mg(OH)2>Al(OH)3 |
您最近一年使用:0次
2022-11-02更新
|
141次组卷
|
2卷引用:河北省保定高碑店市崇德实验中学2022-2023学年高三上学期10月月考化学试题
名校
解题方法
3 . M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M的基态原子L层p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Y是一种重要的成盐元素,Z的基态原子4s和3d轨道均为半充满状态。回答下列问题:
(1)R的基态原子核外电子占据的最高能层符号为___________ ,占据最高能级的电子云轮廓图为___________ 形,核外电子运动状态共有___________ 种。
(2)X和Y相比较,电负性较大的是___________ (填元素符号),简单氢化物稳定性较强的是___________ (填化学式)。
(3)M、R形成的既含离子键又含非极性键的化合物的电子式为___________ 。
(4)Z的基态原子价层电子排布式为___________ ,与Z同周期且最外层电子数相同的元素有___________ 种。
(5)与X同周期且主族序数小1的元素的第一电离能___________ (填“>”或“<”)X元素的第一电离能,原因为___________ 。
(1)R的基态原子核外电子占据的最高能层符号为
(2)X和Y相比较,电负性较大的是
(3)M、R形成的既含离子键又含非极性键的化合物的电子式为
(4)Z的基态原子价层电子排布式为
(5)与X同周期且主族序数小1的元素的第一电离能
您最近一年使用:0次
解题方法
4 . 根据所学知识,回答下列问题。
(1)镍铬钢抗腐蚀性能强,基态铬原子(24Cr)的简化电子排布式为_______ ,其原子结构示意图为_______ ,其电子占据的最高能层符号为_______ 。
(2)“玉兔二号”月球车是通过砷化镓(GaAs)太阳能电池提供能量进行工作的。砷原子的电子占据最高能级的电子云轮廓图为_______ 形,其价电子的轨道表示式为_______ 。基态镓原子(31Ga)的价电子中成对电子数目与未成对电子数目之比为_____ ,核外有_____ 种空间运动状态不同的电子。
(3)X元素基态原子的M层为全充满状态,N层没有成对电子,只有一个未成对电子,则X元素的名称为_______ ,其在周期表中的位置是_______ 。X可以形成X+和X2+两种离子,其中较稳定的是_______ (用元素符号表示),原因是_______ 。
(4)在第三周期中,第一电离能位于铝元素与磷元素之间的元素有_______ 种 。
(5)已知下列元素的电负性数据,
Mg的电负性范围:_______ <x(Mg)<_______ 。
(1)镍铬钢抗腐蚀性能强,基态铬原子(24Cr)的简化电子排布式为
(2)“玉兔二号”月球车是通过砷化镓(GaAs)太阳能电池提供能量进行工作的。砷原子的电子占据最高能级的电子云轮廓图为
(3)X元素基态原子的M层为全充满状态,N层没有成对电子,只有一个未成对电子,则X元素的名称为
(4)在第三周期中,第一电离能位于铝元素与磷元素之间的元素有
(5)已知下列元素的电负性数据,
| 元素符号 | Li | Be | C | O | F | Na | Al | S | Cl |
| X | 0.98 | 1.57 | 2.55 | 3.44 | 3.98 | 0.93 | 1.60 | 2.55 | 3.1 |
您最近一年使用:0次
解题方法
5 . 铁及其化合物在国民生产、生活中用途广泛。
(1)向FeCl3溶液加入少量的KSCN溶液,生成红色的[Fe(SCN)(H2O)5]2+。N、C、H元素的第一电离能由大到小的顺序为___________ ,O、N、C、H四种元素电负性最大的是___________ (填元素符号) 。
(2)FeCl3 与K4[Fe(CN)6]溶液混合生成Fe4[Fe(CN)6]3沉淀。配体CN-中C原子的杂化方式为___________ ,CH2=CHCH2CN分子中σ键与π键的数目比n(σ)∶n(π)=___________ 。
(3)用邻二氮菲(phen,如图 )与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。
)与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。
①[Fe(phen)3]2+中,存在的化学键有___________ (填序号)。
a.配位键 b.离子键 c.π键 d.氢键
②用邻二氮菲测定Fe2+浓度时应控制pH为2~9的适宜范围,请解释原因___________ 。
(4)铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图所示。
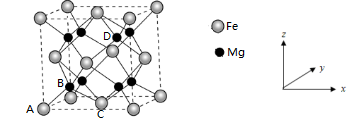
晶体中每个铁原子周围距离最近的镁原子有___________ 个,原子坐标参数可以表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0),B为( ),C为(
),C为(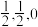 ),则D点坐标参数为
),则D点坐标参数为___________ 。
(1)向FeCl3溶液加入少量的KSCN溶液,生成红色的[Fe(SCN)(H2O)5]2+。N、C、H元素的第一电离能由大到小的顺序为
(2)FeCl3 与K4[Fe(CN)6]溶液混合生成Fe4[Fe(CN)6]3沉淀。配体CN-中C原子的杂化方式为
(3)用邻二氮菲(phen,如图
 )与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。
)与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。①[Fe(phen)3]2+中,存在的化学键有
a.配位键 b.离子键 c.π键 d.氢键
②用邻二氮菲测定Fe2+浓度时应控制pH为2~9的适宜范围,请解释原因
(4)铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图所示。

晶体中每个铁原子周围距离最近的镁原子有
 ),C为(
),C为(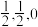 ),则D点坐标参数为
),则D点坐标参数为
您最近一年使用:0次
2021-01-29更新
|
300次组卷
|
2卷引用:河北省衡水市第十四中学2022-2023学年高二下学期第一次选择性考试化学试题
6 . 如图为元素周期表中短周期的部分,关于Y、Z、M的说法正确的是
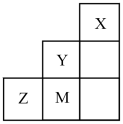

| A.电负性:Y>Z>M |
| B.离子半径:Z2->M->Y- |
| C.ZM2分子中各原子的最外层均满足8电子稳定结构 |
D.Z元素基态原子最外层电子排布图为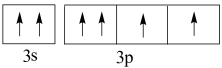 |
您最近一年使用:0次
解题方法
7 . 有机化合物基团中,吸电子(吸引电子云靠近)能力: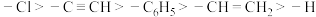 ;推电子(排斥电子云偏离)能力:
;推电子(排斥电子云偏离)能力: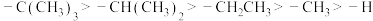 ,一般来说,体系越缺电子,酸性越强;体系越富电子,碱性越强,下列说法错误的是
,一般来说,体系越缺电子,酸性越强;体系越富电子,碱性越强,下列说法错误的是
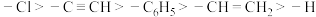 ;推电子(排斥电子云偏离)能力:
;推电子(排斥电子云偏离)能力: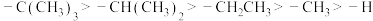 ,一般来说,体系越缺电子,酸性越强;体系越富电子,碱性越强,下列说法错误的是
,一般来说,体系越缺电子,酸性越强;体系越富电子,碱性越强,下列说法错误的是A.碳原子杂化轨道中 成分占比: 成分占比: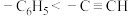 |
B.羟基氢的活性: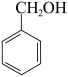 >CH(CH3)2OH >CH(CH3)2OH |
C.酸性: |
D.碱性: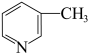 > >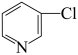 |
您最近一年使用:0次
8 . 物质的结构决定其性质。下列实例与解释不相符的是
| 选项 | 实例 | 解释 |
| A | 冠醚(18-冠-6)与K+可以形成超分子 | 冠醚(18-冠-6)的空穴与K+尺寸适配 |
| B | CF3COOH的酸性强于CH3COOH | F的电负性大,增加羧基中的羟基的极性 |
| C | 石墨与金刚石硬度差别大 | 石墨中碳碳键键能小于金刚石中碳碳键键能 |
| D | Fe3+比Fe2+更稳定 | Fe3+的价层电子的3d能级处于半充满稳定状态 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
9 . 光伏材料是指能将太阳能直接转换成电能的材料。光伏材料又称太阳能材料,只有半导体材料具有这种功能,可作太阳能电池材料的有单晶硅、多晶硅、非晶硅、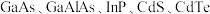 等。回答下面问题:
等。回答下面问题:
(1)元素 在周期表中的位置为
在周期表中的位置为_______ ,基态 原子的电子排布式为
原子的电子排布式为_______ 。
(2)基态P原子成单电子数是_______ ,位于元素周期表的_______ 区。
(3)元素 、C、O的电负性从大到小的顺序为
、C、O的电负性从大到小的顺序为_______ ,31号元素镓 与
与 处于同一主族,P、S、
处于同一主族,P、S、 的第一电离能从大到小的顺序为
的第一电离能从大到小的顺序为_______ 。
(4) 与
与 液态时常作反应溶剂,
液态时常作反应溶剂, 中P原子的杂化类型是
中P原子的杂化类型是_______ ,分子空间结构是_______ , 的空间结构为:
的空间结构为: ,
, 是
是_______ 分子(填“极性”或“非极性”)。
(5)足球烯( )的结构如图1所示:
)的结构如图1所示:
足球烯( )属于
)属于_______ (填晶体类型)晶体, 足球烯分子中σ键的个数为
足球烯分子中σ键的个数为_______ 。
(6)铷晶胞为体心立方堆积,如图2所示,晶胞参数为 ,设1号原子坐标参数为
,设1号原子坐标参数为 ,3号原子坐标参数为
,3号原子坐标参数为 ,铷的摩尔质量用
,铷的摩尔质量用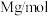 表示。
表示。_______ 。
②设 为阿伏加德罗常数的值,则该晶胞密度的表达式为
为阿伏加德罗常数的值,则该晶胞密度的表达式为_______  。(写出计算表达式)
。(写出计算表达式)
 等。回答下面问题:
等。回答下面问题:(1)元素
 在周期表中的位置为
在周期表中的位置为 原子的电子排布式为
原子的电子排布式为(2)基态P原子成单电子数是
(3)元素
 、C、O的电负性从大到小的顺序为
、C、O的电负性从大到小的顺序为 与
与 处于同一主族,P、S、
处于同一主族,P、S、 的第一电离能从大到小的顺序为
的第一电离能从大到小的顺序为(4)
 与
与 液态时常作反应溶剂,
液态时常作反应溶剂, 中P原子的杂化类型是
中P原子的杂化类型是 的空间结构为:
的空间结构为: ,
, 是
是(5)足球烯(
 )的结构如图1所示:
)的结构如图1所示:
足球烯(
 )属于
)属于 足球烯分子中σ键的个数为
足球烯分子中σ键的个数为(6)铷晶胞为体心立方堆积,如图2所示,晶胞参数为
 ,设1号原子坐标参数为
,设1号原子坐标参数为 ,3号原子坐标参数为
,3号原子坐标参数为 ,铷的摩尔质量用
,铷的摩尔质量用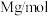 表示。
表示。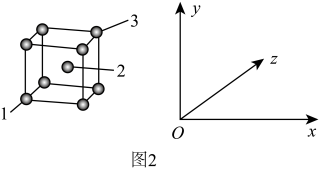
②设
 为阿伏加德罗常数的值,则该晶胞密度的表达式为
为阿伏加德罗常数的值,则该晶胞密度的表达式为 。(写出计算表达式)
。(写出计算表达式)
您最近一年使用:0次
2023-04-29更新
|
103次组卷
|
2卷引用:河北省邢台市巨鹿县等5地2022-2023学年高二下学期4月期中考试化学试题
名校
解题方法
10 . 物质结构决定物质性质。下列性质差异与结构因素匹配错误的是
| 选项 | 性质差异 | 结构因素 |
| A | 沸点:正丁烷(0.5℃)高于异丁烷(11.7℃) | 范德华力 |
| B | 熔点: (399℃,易升华)低于 (399℃,易升华)低于 (714℃) (714℃) | 离子键强弱 |
| C | 酸性: 强于 强于 | 羟基极性 |
| D | 溶解性: 易溶于水, 易溶于水, 难溶于水 难溶于水 | 分子间氢键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-05-22更新
|
188次组卷
|
2卷引用:2024届河北省保定市唐县第一中学高三下学期二模化学试题



