解题方法
1 . 水合肼 在储氢领域有广阔的应用前景,其水溶液呈弱碱性。
在储氢领域有广阔的应用前景,其水溶液呈弱碱性。
(1)肼分解制氢的主要反应为 ,肼的理论储氢密度
,肼的理论储氢密度 。测得肼实际分解时产生的气体中含
。测得肼实际分解时产生的气体中含 ,肼实际储氢密度小于理论值的原因是
,肼实际储氢密度小于理论值的原因是__________ (用化学方程式表示)。
(2)水合肼制氢过程中涉及肼在 催化剂表面分解,如题图1所示。已知催化剂中起作用的部分并不是整个催化剂表面,而是一些特定的位点。
催化剂表面分解,如题图1所示。已知催化剂中起作用的部分并不是整个催化剂表面,而是一些特定的位点。
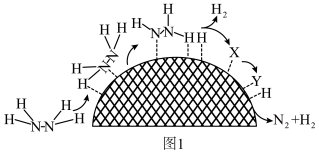
①X的结构简式为__________ 。
②催化剂表面存在 和
和 两种活性位点,两种活性位点分别带不同电性的电荷。肼中的氢原子吸附于
两种活性位点,两种活性位点分别带不同电性的电荷。肼中的氢原子吸附于__________ (填 或
或 )活性位点。已知:断开
)活性位点。已知:断开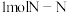 键需要吸收
键需要吸收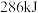 能量,断开
能量,断开 键需要吸收
键需要吸收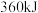 能量。肼在该催化剂表面反应断裂的化学键不是
能量。肼在该催化剂表面反应断裂的化学键不是 键,而是
键,而是 键,原因是
键,原因是__________ 。
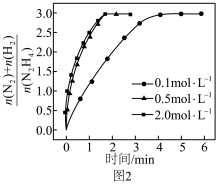
③催化剂存在下,不同浓度的 分解时,测得
分解时,测得 随时间的变化如题图2所示。当
随时间的变化如题图2所示。当 浓度从
浓度从 增加到
增加到 时,反应速率加快;从
时,反应速率加快;从 增加到
增加到 时,反应速率几乎不变,其原因是
时,反应速率几乎不变,其原因是__________ 。
 在储氢领域有广阔的应用前景,其水溶液呈弱碱性。
在储氢领域有广阔的应用前景,其水溶液呈弱碱性。(1)肼分解制氢的主要反应为
 ,肼的理论储氢密度
,肼的理论储氢密度 。测得肼实际分解时产生的气体中含
。测得肼实际分解时产生的气体中含 ,肼实际储氢密度小于理论值的原因是
,肼实际储氢密度小于理论值的原因是(2)水合肼制氢过程中涉及肼在
 催化剂表面分解,如题图1所示。已知催化剂中起作用的部分并不是整个催化剂表面,而是一些特定的位点。
催化剂表面分解,如题图1所示。已知催化剂中起作用的部分并不是整个催化剂表面,而是一些特定的位点。
①X的结构简式为
②催化剂表面存在
 和
和 两种活性位点,两种活性位点分别带不同电性的电荷。肼中的氢原子吸附于
两种活性位点,两种活性位点分别带不同电性的电荷。肼中的氢原子吸附于 或
或 )活性位点。已知:断开
)活性位点。已知:断开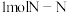 键需要吸收
键需要吸收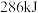 能量,断开
能量,断开 键需要吸收
键需要吸收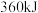 能量。肼在该催化剂表面反应断裂的化学键不是
能量。肼在该催化剂表面反应断裂的化学键不是 键,而是
键,而是 键,原因是
键,原因是③催化剂存在下,不同浓度的
 分解时,测得
分解时,测得 随时间的变化如题图2所示。当
随时间的变化如题图2所示。当 浓度从
浓度从 增加到
增加到 时,反应速率加快;从
时,反应速率加快;从 增加到
增加到 时,反应速率几乎不变,其原因是
时,反应速率几乎不变,其原因是
您最近一年使用:0次
名校
2 .  、
、 、
、 、
、 、
、 是周期表前36号元素中的四种常见元素,其原子序数依次增大。
是周期表前36号元素中的四种常见元素,其原子序数依次增大。 的一种核素在考古时常用来鉴定一些文物的年代:
的一种核素在考古时常用来鉴定一些文物的年代: 的氧化物是导致酸雨的主要物质之一、
的氧化物是导致酸雨的主要物质之一、 的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;
的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭; 的基态原子核外有6个原子轨道处于半充满状态;
的基态原子核外有6个原子轨道处于半充满状态; 能形成红色的
能形成红色的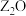 和黑色的
和黑色的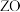 两种氧化物。
两种氧化物。
(1)基态 原子的核外电子有
原子的核外电子有___________ 种不同的运动状态,___________ 种不同能级的电子。
(2) 的空间构型是
的空间构型是___________ 。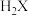 分子的价层电子对互斥模型名称为
分子的价层电子对互斥模型名称为___________ 。
(3)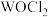 俗称光气,分子中
俗称光气,分子中 原子采取
原子采取 杂化成键,光气分子的结构式为
杂化成键,光气分子的结构式为___________ 。其分子中 键和
键和 键的个数比为
键的个数比为___________ 。
(4) 与
与 是同族元素,
是同族元素, 原子之间可以形成双键、三键,但
原子之间可以形成双键、三键,但 原子之间难以形成双键或三键。从原子结构角度分析,原因是
原子之间难以形成双键或三键。从原子结构角度分析,原因是___________ 。
(5)向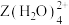 的溶液通入
的溶液通入 ,会生成
,会生成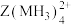 的原因是
的原因是___________ 。(从电负性的角度解释)
 、
、 、
、 、
、 、
、 是周期表前36号元素中的四种常见元素,其原子序数依次增大。
是周期表前36号元素中的四种常见元素,其原子序数依次增大。 的一种核素在考古时常用来鉴定一些文物的年代:
的一种核素在考古时常用来鉴定一些文物的年代: 的氧化物是导致酸雨的主要物质之一、
的氧化物是导致酸雨的主要物质之一、 的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;
的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭; 的基态原子核外有6个原子轨道处于半充满状态;
的基态原子核外有6个原子轨道处于半充满状态; 能形成红色的
能形成红色的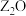 和黑色的
和黑色的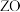 两种氧化物。
两种氧化物。(1)基态
 原子的核外电子有
原子的核外电子有(2)
 的空间构型是
的空间构型是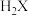 分子的价层电子对互斥模型名称为
分子的价层电子对互斥模型名称为(3)
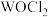 俗称光气,分子中
俗称光气,分子中 原子采取
原子采取 杂化成键,光气分子的结构式为
杂化成键,光气分子的结构式为 键和
键和 键的个数比为
键的个数比为(4)
 与
与 是同族元素,
是同族元素, 原子之间可以形成双键、三键,但
原子之间可以形成双键、三键,但 原子之间难以形成双键或三键。从原子结构角度分析,原因是
原子之间难以形成双键或三键。从原子结构角度分析,原因是(5)向
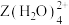 的溶液通入
的溶液通入 ,会生成
,会生成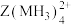 的原因是
的原因是
您最近一年使用:0次
名校
解题方法
3 . 铁的配合物在生产、生活中有重要应用,某种铁的配合物结构如图所示,下列说法正确的是
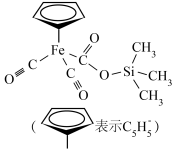

| A.基态硅原子最高能级轨道形状为球形 |
| B.该配合物中元素的电负性最大的是氧 |
| C.该配合物中碳原子的杂化方式有3种 |
| D.基态铁原子核外电子有26种空间运动状态 |
您最近一年使用:0次
2023-05-03更新
|
180次组卷
|
2卷引用:山东省青岛市西海岸新区2022-2023学年高一下学期期中考试化学试题
名校
解题方法
4 . 前四周期元素X、Y、Z、Q、W、R原子序数依次增大,Y、Z、Q位于同一周期,X与Z能构成4核18电子分子,化合物甲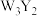 和乙
和乙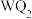 均为离子化合物,W的s电子数和p电子数相等,R是前四周期元素中未成对电子最多的元素,请回答下列有关问题。
均为离子化合物,W的s电子数和p电子数相等,R是前四周期元素中未成对电子最多的元素,请回答下列有关问题。
(1)R在元素周期表中的位置是_______ 。
(2)写出化合物甲的电子式_______ ,化合物甲与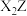 反应的化学方程式为
反应的化学方程式为_______ (用元素符号进行回答,下同) 。
(3)Y、Z、Q三种元素的第一电离能从大到小的顺序是_______ ;Z、Q两元素电负性大小顺序为_______ 。
(4)物质丙、丁、戊、己是由X、Y、Z、Q中的部分元素组成的二元化合物,丙、丁、戊三种分子中电子数相同,单质a和单质b是上述元素构成的单质,上述物质有如下图转化关系。
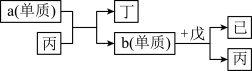
①丁与戊反应生成的化合物中存在的化学键类型是_______ 。
②b单质与戊反应的化学方程式为:_______ 。
(5)元素R的逐级电离能如下表:
R元素在化合物中常表现为+6价,试结合原子结构从电离能角度解释其原因_______ ;
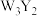 和乙
和乙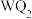 均为离子化合物,W的s电子数和p电子数相等,R是前四周期元素中未成对电子最多的元素,请回答下列有关问题。
均为离子化合物,W的s电子数和p电子数相等,R是前四周期元素中未成对电子最多的元素,请回答下列有关问题。(1)R在元素周期表中的位置是
(2)写出化合物甲的电子式
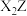 反应的化学方程式为
反应的化学方程式为(3)Y、Z、Q三种元素的第一电离能从大到小的顺序是
(4)物质丙、丁、戊、己是由X、Y、Z、Q中的部分元素组成的二元化合物,丙、丁、戊三种分子中电子数相同,单质a和单质b是上述元素构成的单质,上述物质有如下图转化关系。

①丁与戊反应生成的化合物中存在的化学键类型是
②b单质与戊反应的化学方程式为:
(5)元素R的逐级电离能如下表:
| 电离能 | I1 | I2 | I3 | I4 | I5 | I6 | I7 |
 | 652.9 | 1590.6 | 2987 | 4743 | 6702 | 8744.9 | 15455 |
您最近一年使用:0次
名校
5 . M、Q、R、X、Y、Z是前36号元素,它们的原子序数依次增大,其中M、R原子的3p轨道都有2个未成对电子,X、Y和Z原子的最外层都只有1个电子。回答下列问题:
(1)Y元素的基态原子价层电子排布式为_______ 。
(2)在周期表的五个分区中,Z在_______ 区,其正一价离子的电子排布式是_______ 。
(3)M、Q、R的电负性由小到大的顺序为_______ (用元素符号表示)
(4)氮化镓(GaN)是新型的半导体材料。基态Ga原子的价层电子排布图为_______ ;
(5)第四周期内层电子全排满,最外层只有两个电子的元素是_______ 它在周期表上的位置为_______ 。
(1)Y元素的基态原子价层电子排布式为
(2)在周期表的五个分区中,Z在
(3)M、Q、R的电负性由小到大的顺序为
(4)氮化镓(GaN)是新型的半导体材料。基态Ga原子的价层电子排布图为
(5)第四周期内层电子全排满,最外层只有两个电子的元素是
您最近一年使用:0次
名校
6 . 不同元素的原子在分子内吸引电子的能力大小可用一定数值 x 来表示,若 x 越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷的一方。
下面是某些短周期元素的 x 值:
(1)通过分析 x 值变化规律,确定Al、N的 x 值范围:________ < x (Al)<________
(2)推测 x 值与原子半径关系是________ ,根据短周期元素的 x 值变化特点,体现了元素性质的________ 变化规律。
(3)某有机化合物结构式为: ,其中SO键中你认为共用电子对偏向谁?
,其中SO键中你认为共用电子对偏向谁?________ (写原子名称)。
(4)经验规律告诉我们:当成键的两原子相应元素的 x 差值(Δ x )即 x >1.7时,一般为离子键;当Δ x <1.7时,一般为共价键。试推断AlF 3 中化学键类型是________ 。
(5)预测元素周期表中, x 值最小的元素的位置:_______ (放射性元素除外)。
下面是某些短周期元素的 x 值:
| 元素符号 | Li | Be | B | C | N | F |
| x 值 | 0.98 | 1.57 | 2.04 | 2.25 | 2.89 | 3.98 |
| 元素符号 | Na | Mg | Si | P | S | Cl |
| x 值 | 0.93 | 1.35 | 1.90 | 2.19 | 2.58 | 3.16 |
(2)推测 x 值与原子半径关系是
(3)某有机化合物结构式为:
 ,其中SO键中你认为共用电子对偏向谁?
,其中SO键中你认为共用电子对偏向谁?(4)经验规律告诉我们:当成键的两原子相应元素的 x 差值(Δ x )即 x >1.7时,一般为离子键;当Δ x <1.7时,一般为共价键。试推断AlF 3 中化学键类型是
(5)预测元素周期表中, x 值最小的元素的位置:
您最近一年使用:0次



