21-22高二上·山东济南·阶段练习
1 . C、N、O、Al、Si、Cu是常见的六种元素。
(1)Si位于元素周期表第_______ 周期第_______ 族,其基态原子的轨道表示式为_______ 。
(2)Cu的基态原子的电子排布式为_______ 。
(3)原子半径:Al_______ Si,电负性:N_______ O,第一电离能:C_______ N。(用“>”或“<”填空)
(4)Ge元素的最外层基态电子排布为4s24p2,Ge元素可能的性质或应用有_______。
(1)Si位于元素周期表第
(2)Cu的基态原子的电子排布式为
(3)原子半径:Al
(4)Ge元素的最外层基态电子排布为4s24p2,Ge元素可能的性质或应用有_______。
| A.是一种活泼的金属元素 | B.其电负性大于硅 |
| C.其单质可作为半导体材料 | D.其第一电离能小于硅 |
您最近一年使用:0次
解题方法
2 . 按要求填空:
(1)C、H、O三种元素的电负性由小到大的顺序为_______ 。
(2)对于基态Cr原子,下列叙述正确的是_______ (填字母)。
A.轨道处于半充满时体系总能量低,核外电子排布应为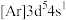
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(1)C、H、O三种元素的电负性由小到大的顺序为
(2)对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为
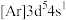
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
您最近一年使用:0次
2022-08-22更新
|
74次组卷
|
2卷引用:2.2.2元素第一电离能和电负性的周期性变化 课后
3 . 在下列横线上,填上适当的元素符号:
(1)在第三周期中,第一电离能最小的元素是_________ ,第一电离能最大的元素是______ 。
(2)在元素周期表中,电负性最大的元素是_______ ,电负性最小的元素是_________ (放射性元素除外)。
(3)最活泼的金属元素是_______ 。
(4)最活泼的非金属元素是______ 。
(5)第二、三、四周期元素中p轨道半充满的原子是_______ 。
(6)电负性相差最大的两种元素是________ (放射性元素除外)。
(1)在第三周期中,第一电离能最小的元素是
(2)在元素周期表中,电负性最大的元素是
(3)最活泼的金属元素是
(4)最活泼的非金属元素是
(5)第二、三、四周期元素中p轨道半充满的原子是
(6)电负性相差最大的两种元素是
您最近一年使用:0次
2020-04-09更新
|
172次组卷
|
5卷引用:1.3.2元素的电离能、电负性及其变化规律(课后)-鲁科版选择性必修2
1.3.2元素的电离能、电负性及其变化规律(课后)-鲁科版选择性必修2第3节 原子结构与元素性质——A学习区 夯实基础(鲁科版选修3)(已下线)1.3.2 元素的电负性及其变化规律-2020-2021学年高二化学课时同步练(鲁科2019选择性必修2)(已下线)1.2.2 原子结构与元素周期律(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)1.2.3 元素的电负性及其变化规律-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)
解题方法
4 . 不同元素的原子吸引电子的能力大小可用一定数值X表示,X值越大,其原子吸引电子的能力越强,在所形成的化合物中为带负电荷的一方。下表是某些元素的X值:
(1)通过分析X值的变化规律,确定 、
、 的X值范围:
的X值范围:______ 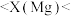
______ ;______ 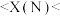
______ 。
(2)推测X值与原子半径的关系为______ 。
(3)某有机化合物的结构为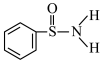 ,其中
,其中 键中,你认为共用电子对偏向
键中,你认为共用电子对偏向______ (填元素符号)。
(4)如果X值为电负性的数值,试推断 中化学键的类型为
中化学键的类型为______ 。
(5)预测元素周期表中X值最小的元素(放射性元素除外)是______ (填元素符号)。
| 元素符号 |  |  |  |  |  |  |
| X值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 |
| 元素符号 |  |  |  |  |  |  |
| X值 | 0.93 | 1.60 | 1.90 | 2.19 | 2.55 | 3.16 |
 、
、 的X值范围:
的X值范围: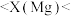
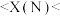
(2)推测X值与原子半径的关系为
(3)某有机化合物的结构为
 ,其中
,其中 键中,你认为共用电子对偏向
键中,你认为共用电子对偏向(4)如果X值为电负性的数值,试推断
 中化学键的类型为
中化学键的类型为(5)预测元素周期表中X值最小的元素(放射性元素除外)是
您最近一年使用:0次
2020-03-05更新
|
486次组卷
|
5卷引用:2.2.2元素第一电离能和电负性的周期性变化 课中
5 . Cu2+能与NH3、H2O、OH-、Cl-等形成配位数为4的配合物。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2-中的配位键__________ 。
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有______ (填序号)。
A.离子键 B.金属键
C.极性共价键 D.非极性共价键
(2)金属铜与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生反应:Cu+H2O2+4NH3 [Cu(NH3)4]2++2OH-。其原因是
[Cu(NH3)4]2++2OH-。其原因是_________________ 。
(3)Cu2+可以与乙二胺(H2N—CH2CH2—NH2)形成配离子:
 。
。
①H、O、N三种元素的电负性从大到小的顺序为___________ 。
②乙二胺分子中N原子成键时采取的杂化类型是__________ 。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2-中的配位键
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有
A.离子键 B.金属键
C.极性共价键 D.非极性共价键
(2)金属铜与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生反应:Cu+H2O2+4NH3
 [Cu(NH3)4]2++2OH-。其原因是
[Cu(NH3)4]2++2OH-。其原因是(3)Cu2+可以与乙二胺(H2N—CH2CH2—NH2)形成配离子:
 。
。①H、O、N三种元素的电负性从大到小的顺序为
②乙二胺分子中N原子成键时采取的杂化类型是
您最近一年使用:0次
2018-12-03更新
|
605次组卷
|
5卷引用:2.3离子键、配位键与金属键(课后)-鲁科版选择性必修2



