名校
1 . 下列有关说法中合理的是
A.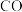 与 与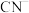 结构相似,含有的 结构相似,含有的 键与 键与 键个数比均为1∶2 键个数比均为1∶2 |
B.根据 理论可知 理论可知 、 、 、 、 分子内键角依次减小 分子内键角依次减小 |
| C.铜的电负性为1.9,氯的电负性为3.0,氯化铜为离子化合物,溶于水能完全电离 |
| D.元素周期表中第ⅠA族和第ⅦA族元素原子间不可能形成共价键 |
您最近一年使用:0次
2024-04-03更新
|
262次组卷
|
2卷引用:黑龙江省齐齐哈尔市讷河市第一中学2023-2024学年高二下学期开学考试化学试题
名校
解题方法
2 . 中国科学家首次在月球上发现新矿物,并将其命名为“嫦娥石 ”。Y(钇)是金属元素。下列说法
”。Y(钇)是金属元素。下列说法
A.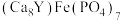 是一种磷酸盐 是一种磷酸盐 |
| B.电负性O>P,嫦娥石中P显正价,O显负价 |
| C.在元素周期表中,O、P、Fe均属于s区元素 |
| D.原子半径:O<P |
您最近一年使用:0次
2024-03-24更新
|
225次组卷
|
3卷引用:北京市第九中学2023-2024学年高二下学期2月开学考化学试题
3 . 已知有3种基态元素原子的核外电子排布式:① ②
② ③
③ ,下列说法错误的是
,下列说法错误的是
 ②
② ③
③ ,下列说法错误的是
,下列说法错误的是| A.①与②可组成空间结构为正四面体形的化合物 |
| B.电负性:②>①>③ |
| C.第一电离能:①>③>② |
| D.三种元素均位于p区 |
您最近一年使用:0次
名校
4 . 下列与分子性质有关的说法正确的是
| A.氟代丙二酸(HOOC—CF2—COOH)的酸性强于丙二酸(HOOC—CH2—COOH)是因为—CF2—的极性大于—CH2—的极性,导致氟代丙二酸羧基中—OH的极性更大更易电离出H+ |
B.邻硝基苯酚(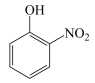 )的沸点高于对硝基苯酚( )的沸点高于对硝基苯酚(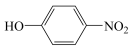 )是因为后者形成了分子间氢键 )是因为后者形成了分子间氢键 |
| C.C的电负性强于Si,所以CH4的熔沸点高于SiH4 |
| D.I2受热易升华,是因为分子内共价键键能较小所致 |
您最近一年使用:0次
名校
解题方法
5 . 我国“祝融号”火星车成功着陆火星,发现火星矿脉中含有四种短周期主族元素a、b、c、d,原子序数和原子半径变化关系如图所示。已知b的氢化物溶液可用于刻蚀玻璃,a、c的基态原子s轨道与p轨道的电子数均相等,c和d原子的最外层电子数之和为8。下列说法不正确的是
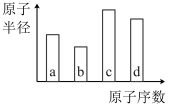
| A.电负性:b>a>d>c |
| B.简单氢化物沸点:a>b>d |
| C.同周期第一电离能小于d的元素有5种 |
| D.化合物da3和da2的中心原子的杂化方式均为sp2 |
您最近一年使用:0次
2023-10-08更新
|
367次组卷
|
3卷引用:四川省绵阳南山中学2023-2024学年高二下学期入学考试化学试题
名校
解题方法
6 . X、Y、Z、R、Q是元素周期表中原子序数依次增大的前四周期元素,X是宇宙中含量最多的元素;Y与Z同周期,Y基态原子有3个未成对电子,Z元素原子的价层电子排布为 ;R元素简单离子在同周期离子中半径最小;Q元素最高能层只有1个电子,其余能层均充满电子。下列说法中
;R元素简单离子在同周期离子中半径最小;Q元素最高能层只有1个电子,其余能层均充满电子。下列说法中不正确 的是
 ;R元素简单离子在同周期离子中半径最小;Q元素最高能层只有1个电子,其余能层均充满电子。下列说法中
;R元素简单离子在同周期离子中半径最小;Q元素最高能层只有1个电子,其余能层均充满电子。下列说法中A.简单气态氢化物的热稳定性: | B.第一电离能: |
| C.Q在周期表的ds区 | D.电负性: |
您最近一年使用:0次
2023-12-23更新
|
539次组卷
|
3卷引用:江西省宜春市丰城中学东校区(九中)2023-2024学年高二下学期开学考试化学试卷
名校
解题方法
7 . 某种镁盐具有良好的电化学性能,其阴离子结构如下图所示。 是核电荷数依次增大的短周期元素,
是核电荷数依次增大的短周期元素,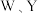 原子序数之和等于
原子序数之和等于 原子价电子数是Q原子价电子数的2倍。下列说法错误的是
原子价电子数是Q原子价电子数的2倍。下列说法错误的是
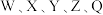 是核电荷数依次增大的短周期元素,
是核电荷数依次增大的短周期元素,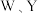 原子序数之和等于
原子序数之和等于 原子价电子数是Q原子价电子数的2倍。下列说法错误的是
原子价电子数是Q原子价电子数的2倍。下列说法错误的是
| A.Q和Z的基态原子核外未成对电子数相同 | B.电负性大小: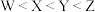 |
| C.Q的氯化物为离子晶体 | D.沸点: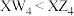 |
您最近一年使用:0次
2024-03-08更新
|
590次组卷
|
4卷引用:辽宁省铁岭市调兵山市第二高级中学2023-2024学年高二下学期开学考试化学试题
名校
解题方法
8 . X、Y、Z、W均为短周期主族元素,原子序数依次增大。X的P能级上有2个电子,Y是同一周期中原子半径最大的元素,Z单质易溶于CS2,W的单质是双原子分子,下列说法不正确的是
| A.X有多种同素异形体 | B.Y的氧化物对应的水化物具有两性 |
| C.电负性:X<Z<W | D.最简单氢化物的热稳定性:X<Z<W |
您最近一年使用:0次
2024-03-04更新
|
184次组卷
|
3卷引用:广东省梅州市大埔县虎山中学2023-2024学年高二下学期开学化学试题
名校
解题方法
9 . 下列说法不正确的是
| A.石墨片层中存在大π键,所以沿片层方向容易导电 |
| B.苯甲酸容易形成分子间氢键,形成二聚分子,所以熔沸点较高 |
| C.碳链可以连接很长,但硅链不可以连接很长,因为Si-Si键的键能小于C-C键的键能 |
| D.依据元素周期律,与相同浓度的稀硫酸反应,Pb比Sn反应剧烈 |
您最近一年使用:0次
2024-01-13更新
|
269次组卷
|
3卷引用:河南省信阳高级中学2023-2024学年高二下学期开学化学试题
河南省信阳高级中学2023-2024学年高二下学期开学化学试题山东省中学联盟2023-2024学年高三上学期12月全省大联考化学试题(已下线)化学(九省联考考后提升卷,甘肃卷)-2024年1月“九省联考”真题完全解读与考后提升
名校
10 . 下列说法错误的是
| A.水很稳定是因为水中含有大量氢键 |
| B.乳酸分子[CH3CH(OH)COOH]中含有一个手性碳原子 |
| C.碘易溶于四氯化碳、甲烷难溶于水,二者都可用相似相溶原理解释 |
| D.氟的电负性大于氯的电负性,导致三氟乙酸的酸性大于三氯乙酸的酸性 |
您最近一年使用:0次
2024-01-11更新
|
1163次组卷
|
3卷引用:广东省广州大学附属中学2023-2024学年高二下学期开学测化学试题



