名校
解题方法
1 . 螯合树脂吸附法处理废水具有吸附容量大、速度快以及选择性好等特点,已成为近年来的研究热点。螯合树脂M与Cu2+形成新的螯合物Q,从而达到去除Cu2+的效果,吸附机理如图所示。

资料:
①吸附原理
螯合树脂M中的—OH解离出H+,变成—COO-,而且树脂中含有N原子,在与Cu2+接触时,树脂中的—COO-、N原子与Cu2+形成配位键,形成新的螯合物Q,从而达到去除Cu2+的目的。
②在体系酸性较强情况下,氮原子与氢离子具有较强的配位能力。
(1)基态Cu的价层电子排布的轨道表示式是____ 。
(2)M中四种元素电负性由大到小的顺序为(用元素符号表示)____ 。
(3)M中N原子的杂化轨道类型为____ 。
(4)Q中存在配位键,其中提供空轨道的是____ 。
(5)在螯合树脂M处理含铜废水过程中,发现体系pH对Cu2+的吸附量(Qe)有影响,实验结果如图所示。
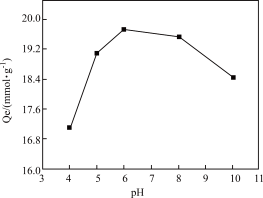
①吸附去除Cu2+的过程中需保持体系处于适宜的pH,其中pH约为____ 时吸附效果最好。
②从平衡移动角度解释,体系碱性过强时,吸附能力下降的原因____ 。
③从结构角度解释:体系酸性较强时,吸附能力下降的原因____ 。

资料:
①吸附原理
螯合树脂M中的—OH解离出H+,变成—COO-,而且树脂中含有N原子,在与Cu2+接触时,树脂中的—COO-、N原子与Cu2+形成配位键,形成新的螯合物Q,从而达到去除Cu2+的目的。
②在体系酸性较强情况下,氮原子与氢离子具有较强的配位能力。
(1)基态Cu的价层电子排布的轨道表示式是
(2)M中四种元素电负性由大到小的顺序为(用元素符号表示)
(3)M中N原子的杂化轨道类型为
(4)Q中存在配位键,其中提供空轨道的是
(5)在螯合树脂M处理含铜废水过程中,发现体系pH对Cu2+的吸附量(Qe)有影响,实验结果如图所示。

①吸附去除Cu2+的过程中需保持体系处于适宜的pH,其中pH约为
②从平衡移动角度解释,体系碱性过强时,吸附能力下降的原因
③从结构角度解释:体系酸性较强时,吸附能力下降的原因
您最近一年使用:0次
名校
2 . 中国有广阔的海岸线,建设发展海洋经济、海水的综合利用大有可为。
Ⅰ.目前世界上60%的镁是从海水中提取的,海水提镁的主要流程如下:__________ 。
(2)工业冶炼金属 的化学方程式为
的化学方程式为__________ 。
Ⅱ.空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其工艺流程如下图所示,试回答下列问题: ”,这样进行转化的目的是
”,这样进行转化的目的是__________ 。
(4)步骤Ⅱ通入热空气或水蒸气吹出 ,利用了溴的__________(填序号)。
,利用了溴的__________(填序号)。
(5)写出步骤Ⅱ中涉及的离子反应__________ 。
Ⅲ.最近,科学家开发了一种用二氧化碳淡化海水的技术,其循环图如下: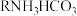 中H、C、N、O四种元素的电负性
中H、C、N、O四种元素的电负性由大到小 的顺序为__________ 。
Ⅰ.目前世界上60%的镁是从海水中提取的,海水提镁的主要流程如下:
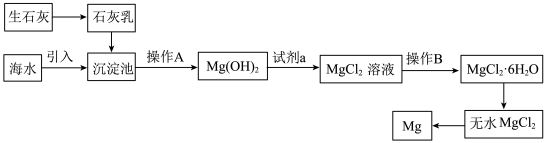
(2)工业冶炼金属
 的化学方程式为
的化学方程式为Ⅱ.空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其工艺流程如下图所示,试回答下列问题:
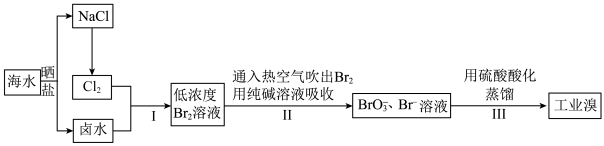
 ”,这样进行转化的目的是
”,这样进行转化的目的是(4)步骤Ⅱ通入热空气或水蒸气吹出
 ,利用了溴的__________(填序号)。
,利用了溴的__________(填序号)。| A.氧化性 | B.还原性 | C.挥发性 | D.腐蚀性 |
(5)写出步骤Ⅱ中涉及的离子反应
Ⅲ.最近,科学家开发了一种用二氧化碳淡化海水的技术,其循环图如下:

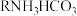 中H、C、N、O四种元素的电负性
中H、C、N、O四种元素的电负性
您最近一年使用:0次
名校
3 . R、X、Y、M为短周期主族元素,原子序数依次增大,M与Y元素不同周期且M原子的核外未成对电子数为1,Y为地壳中含量最高的元素,由R、X、Y、M组成的物质结构式如图所示。下列说法错误的是

A.元素电负性: |
B. 的所有原子最外层都满足8电子稳定结构 的所有原子最外层都满足8电子稳定结构 |
C.M所在周期主族元素中,简单离子半径最小的是 |
D.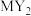 可以作为饮用水消毒剂,因此只有氧化性没有还原性 可以作为饮用水消毒剂,因此只有氧化性没有还原性 |
您最近一年使用:0次
2024-05-12更新
|
149次组卷
|
2卷引用:安徽师范大学附属中学2024届高三下学期5月测试化学试卷
解题方法
4 . 如图所示是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
回答下列问题:
(1)元素为24号元素,其基态原子的价层电子轨道表示式(或价层电子排布图)为___________ 。
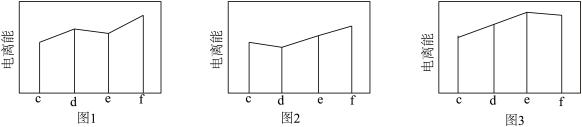
(2)图1、2、3分别表示c、d、e、f四种元素的逐级电离能I变化趋势(纵坐标的标度不同)。第二电离能的变化图是图___________ (填序号),判断的依据是___________ 。
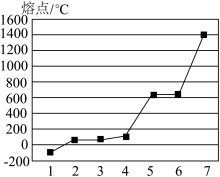
(3)第三周期7种主族元素按单质熔点高低的顺序排列如图所示,其中电负性最大的是___________ (填图中的序号)。
(4)键角:ce2___________ a2e(填“>”或“<”)。
(5)在l与p中,其单质的氧化性较强的是___________ (填元素符号),设计实验加以证明:___________
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | p | ||||||||||||||||
(1)元素为24号元素,其基态原子的价层电子轨道表示式(或价层电子排布图)为
(2)图1、2、3分别表示c、d、e、f四种元素的逐级电离能I变化趋势(纵坐标的标度不同)。第二电离能的变化图是图

(3)第三周期7种主族元素按单质熔点高低的顺序排列如图所示,其中电负性最大的是

(4)键角:ce2
(5)在l与p中,其单质的氧化性较强的是
您最近一年使用:0次
名校
5 . 乙醛与氢氰酸( ,弱酸)能发生加成反应,生成2-羟基丙腈,历程如下:
,弱酸)能发生加成反应,生成2-羟基丙腈,历程如下:不正确 的是
 ,弱酸)能发生加成反应,生成2-羟基丙腈,历程如下:
,弱酸)能发生加成反应,生成2-羟基丙腈,历程如下:
A.因氧原子的电负性较大,醛基中的碳原子带部分正电荷,与 作用 作用 |
B. 易挥发且有剧毒,是该反应不在酸性条件下进行的原因之一 易挥发且有剧毒,是该反应不在酸性条件下进行的原因之一 |
C.往丙酮与 反应体系中加入一滴 反应体系中加入一滴 溶液,反应速率明显加快,因此碱性越强,上述反应越容易进行 溶液,反应速率明显加快,因此碱性越强,上述反应越容易进行 |
D.与 加成的反应速率: 加成的反应速率: |
您最近一年使用:0次
2024-03-21更新
|
455次组卷
|
3卷引用:浙江省宁波市十校2024届高三二模联考化学试题
浙江省宁波市十校2024届高三二模联考化学试题湖北省沙市中学2024届高三下学期模拟预测化学试题(已下线)压轴题04 化学反应机理 历程 能垒图分析(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
6 . 下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。___________ 。
(2)元素h的基态原子电子排布式为___________ 。
(3)元素i在周期表中处于___________ 区。元素e的最高价氧化物对应水化物的浓溶液,与i的单质反应的离子方程式为___________ 。
(4)下列有关说法正确的是___________(填选项字母)。
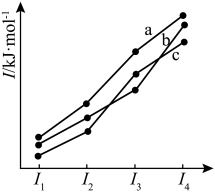
(5)如图三条曲线表示C、Si、P三种元素第一电离能(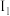 )至第四电离能(I4)的变化趋势。其中,曲线a表示的元素是
)至第四电离能(I4)的变化趋势。其中,曲线a表示的元素是___________ 。
(6)经研究,发现可能存在的第119号元素。有关第119号元素的预测正确的是___________。

(2)元素h的基态原子电子排布式为
(3)元素i在周期表中处于
(4)下列有关说法正确的是___________(填选项字母)。
A.第一电离能: | B.电负性: |
C.气态氢化物的稳定性: | D.含氧酸的酸性: |
(5)如图三条曲线表示C、Si、P三种元素第一电离能(
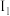 )至第四电离能(I4)的变化趋势。其中,曲线a表示的元素是
)至第四电离能(I4)的变化趋势。其中,曲线a表示的元素是
(6)经研究,发现可能存在的第119号元素。有关第119号元素的预测正确的是___________。
| A.在化合物中显+1价 | B.单质具有强氧化性 |
| C.最高价氧化物对应的水化物为弱碱 | D.单质能与冷水剧烈反应 |
您最近一年使用:0次
名校
解题方法
7 . 一般认为,含氧酸酸性强弱主要与两个因素有关:一是中心原子的电负性越大,酸性越强:一是中心原子所连接的“非羟基氧”数目越多,酸性越强。据此推断下列说法正确的是
A.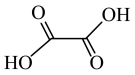 是一种二元强酸 是一种二元强酸 |
B. 的分子结构是 的分子结构是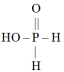 ,它是一种三元弱酸 ,它是一种三元弱酸 |
C. 、 、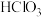 、 、 的酸性依次增强 的酸性依次增强 |
D.某元素X形成的 比 比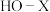 的酸性强,氧化性也强 的酸性强,氧化性也强 |
您最近一年使用:0次
名校
解题方法
8 . 下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 酸性: | 电负性: |
B | 碳酸氢钠用作面团膨松剂 | 碳酸氢钠可以与碱反应 |
C | 马口铁(镀锡铁)出现刮痕后浸泡在饱和食盐水中,一段时间后,滴入几滴 | 锡做原电池的负极 |
D | 将在空气中灼烧呈黑色的铜丝趁热插入盛有乙醇的试管中,铜丝会变红色 | 乙醇具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-24更新
|
324次组卷
|
4卷引用:广东省东莞中学、广州二中、惠州一中等六校联考2023-2024学年高三下学期(第六次)开学化学试题
名校
9 . C、Be、Cl、Fe等元素及其化合物有重要的应用。
(1)查表得知,Be的电负性是1.5,Cl的电负性是3.0,则BeCl2应为________ (填离子或共价)化合物;根据铍元素和铝元素在周期表中的位置,推测BeCl2应与_________ (填MgCl2或AlCl3)化学性质更相似。
(2)上述四种元素的原子中,未成对电子数最多的元素是_________________ 。
(3)①试根据原子核外电子排布所遵循的原理解释Fe2+具有较的强还原性,易被氧化为Fe3+的原因___________________ 。②当然Fe3+也有氧化性,在印刷行业中就用氯化铁溶液腐蚀铜板,写出离子方程式___________________ 。
(4)一定条件下,C元素可形成多种晶体。下图1是其中某种晶体的一个晶胞,该晶胞中含有________ 个C原子。
(5)下图2为金属铁某种晶体的晶胞结构,已知铁的摩尔质量是56g•mol-1,该晶体的密度为ag•cm-3,NA为阿伏加德罗常数的值,则该晶胞的体积为_________ cm3。

(1)查表得知,Be的电负性是1.5,Cl的电负性是3.0,则BeCl2应为
(2)上述四种元素的原子中,未成对电子数最多的元素是
(3)①试根据原子核外电子排布所遵循的原理解释Fe2+具有较的强还原性,易被氧化为Fe3+的原因
(4)一定条件下,C元素可形成多种晶体。下图1是其中某种晶体的一个晶胞,该晶胞中含有
(5)下图2为金属铁某种晶体的晶胞结构,已知铁的摩尔质量是56g•mol-1,该晶体的密度为ag•cm-3,NA为阿伏加德罗常数的值,则该晶胞的体积为

您最近一年使用:0次
2016-12-09更新
|
296次组卷
|
2卷引用:2015-2016学年福建省四地六校高二下学期第一次联考化学试卷
解题方法
10 . 一种阴离子的结构如图所示,X、Y、Z、W为原子序数依次增大的短周期元素,基态W原子中有3个未成对电子,下列说法正确的是
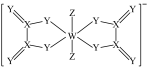
A.电负性: | B.简单氢化物的沸点: |
C.最高价氧化物对应水化物的酸性: | D.单质的氧化性: |
您最近一年使用:0次



 溶液,出现蓝色沉淀
溶液,出现蓝色沉淀

