1 . 中心原子采取sp杂化的分子是
| A.NH3 | B.BeCl2 | C.PCl3 | D.H2O |
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
2 . 短周期元素X、Y、Z的原子序数依次增大,X元素基态原子有2个未成对电子,Y元素基态原子的核外p电子数比s电子数少1个,Z的一种超原子Z 具有40个价层电子。下列说法错误的是
具有40个价层电子。下列说法错误的是
 具有40个价层电子。下列说法错误的是
具有40个价层电子。下列说法错误的是A.XO 的空间结构为平面三角形 的空间结构为平面三角形 |
| B.简单离子半径:Y<Z |
C.YO 的中心原子的杂化方式为sp3杂化 的中心原子的杂化方式为sp3杂化 |
| D.化合物ZY的结构与X的某种单质的结构相似 |
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
3 . 下列符号表征或说法正确的是
A. 电离: 电离: | B. 位于元素周期表p区 位于元素周期表p区 |
C. 空间结构:平面三角形 空间结构:平面三角形 | D. 电子式: 电子式: |
您最近一年使用:0次
解题方法
4 . 硫的化合物很多,如SO2、SO3、SO2Cl2、Na2SO3、三聚的(SO3)3等,三聚的(SO3)3的结构如图所示。下列说法正确的是

A.40 g(SO3)3分子中含有 6 mol 键 键 |
| B.SO2Cl2中S原子杂化方式为 sp3 |
C. 、 、 的价层电子对数不相同 的价层电子对数不相同 |
D.SO3、 均为平面三角形结构 均为平面三角形结构 |
您最近一年使用:0次
2023-07-29更新
|
127次组卷
|
4卷引用:安徽省阜阳市2022-2023学年高二下学期期末质量统测化学试题
安徽省阜阳市2022-2023学年高二下学期期末质量统测化学试题(已下线)题型01 分子的空间构型及杂化类型的判断-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(人教版2019)(已下线)专题01 物质的结构与性质-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(人教版2019)(已下线)综合01 物质结构与性质压轴80题-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(人教版2019)
5 . 下列说法不正确的是
| A.臭氧是空间结构为V形的极性分子,在水中的溶解度大于氧气 |
B. 和P4都为正四面体形, 和P4都为正四面体形, 中键角为 中键角为 ,P4中键角也为 ,P4中键角也为 |
| C.C2H4分子和N2H4分子中都含有5个σ键 |
| D.σ键以“头碰头”方式重叠,π键以“肩并肩”方式重叠 |
您最近一年使用:0次
解题方法
6 . 实验室制取乙炔的主要反应为CaC2+2H2O→C2H2↑+Ca(OH)2,下列说法错误的是
| A.C2H2分子的空间结构:直线形 | B.H2O的VSEPR模型:四面体形 |
C.CaC2的电子式: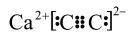 | D.基态C原子的价电子排布图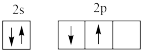 |
您最近一年使用:0次
解题方法
7 . 价电子对数与中心原子的杂化轨道类型
(1)价电子对数相同,中心原子的杂化轨道类型___________ ,价电子对分布的几何构型___________ 。即价电子对数=___________ 。
(2)CH4、NH3、H2O分子的价电子对数都是___________ ,中心原子的杂化轨道数目为___________ ,杂化类型为___________ 杂化,价电子对分布的几何构型为___________ 。
(1)价电子对数相同,中心原子的杂化轨道类型
(2)CH4、NH3、H2O分子的价电子对数都是
您最近一年使用:0次
解题方法
8 . ABm型分子的价电子对数的计算方法
对于ABm型分子(A是中心原子,B是配位原子),分子的价电子对数可以通过下式确定:
价电子对数目(n)=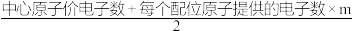
(1)中心原子的价电子数=___________ ;
(2)配位原子提供的价电子数:
卤素原子、氢原子按提供1个价电子数计算,O、S作为配位原子时按不提供价电子计算。如PCl5中n=___________ 。
(3)对于复杂离子,在计算价电子对数时,还应加上或减去离子所带的电荷数。如 中n=
中n=___________ , 中n=
中n=___________ 。
(4)若剩余1个电子,即出现奇数电子,也把这个单电子当作1对电子处理。如NO2中n=________ 。
对于ABm型分子(A是中心原子,B是配位原子),分子的价电子对数可以通过下式确定:
价电子对数目(n)=
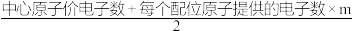
(1)中心原子的价电子数=
(2)配位原子提供的价电子数:
卤素原子、氢原子按提供1个价电子数计算,O、S作为配位原子时按不提供价电子计算。如PCl5中n=
(3)对于复杂离子,在计算价电子对数时,还应加上或减去离子所带的电荷数。如
 中n=
中n= 中n=
中n=(4)若剩余1个电子,即出现奇数电子,也把这个单电子当作1对电子处理。如NO2中n=
您最近一年使用:0次
解题方法
9 . 价层电子对互斥模型的基本要点
(1)价电子对:包括孤电子对和成键电子对,即价电子对数=_______ +_______ 。在价层电子对互斥模型中,成键电子对数等于成键数目,不用区别单键还是双键。
(2)价电子对的几何构型:
分子中的价电子对由于相互排斥作用,而趋向于尽可能___________ 以减小斥力,分子尽可能采取___________ 的空间构型。
价电子对数分别为2、3、4时,价电子对的几何分布分别为______ 、_______ 、_______ 。
(1)价电子对:包括孤电子对和成键电子对,即价电子对数=
(2)价电子对的几何构型:
分子中的价电子对由于相互排斥作用,而趋向于尽可能
价电子对数分别为2、3、4时,价电子对的几何分布分别为
您最近一年使用:0次
10 . 等电子原理
(1)等电子原理概念:
具有相同___________ 和相同___________ 的分子或离子具有相同的___________ 特征。符这一原理称为“等电子原理”。
(2)等电子原理的应用:
①判断一些简单分子或离子的立体结构:SiCl4、 、
、 互为等电子体,空间结构为
互为等电子体,空间结构为___________ 。
②判断分子的结构性质:CO和N2,它们的分子中价电子总数是___________ ,都形成1个σ键和2个π键,CO的结构式为___________ ,CO和N2键能都___________ ,性质也相似。
③等电子原理在制造新材料方面的应用:晶体硅、锗、磷化铝(AlP)、砷化镓(GaAs)互为等电子体,都是良好的___________ 材料。
(1)等电子原理概念:
具有相同
(2)等电子原理的应用:
①判断一些简单分子或离子的立体结构:SiCl4、
 、
、 互为等电子体,空间结构为
互为等电子体,空间结构为②判断分子的结构性质:CO和N2,它们的分子中价电子总数是
③等电子原理在制造新材料方面的应用:晶体硅、锗、磷化铝(AlP)、砷化镓(GaAs)互为等电子体,都是良好的
您最近一年使用:0次



