名校
解题方法
1 . 按要求填空:
(1)元素O与Se同主族,电负性O___________ Se(选填“>”、“<”、“=”),基态Se原子价层电子空间运动状态有___________ 种。
(2) 离子的VSEPR模型为
离子的VSEPR模型为___________ ,离子空间构型为___________ 。
(3)6-氨基青霉烷酸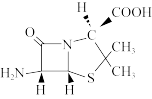 结构中S原子的杂化方式是
结构中S原子的杂化方式是___________ ,组成中C、N、O三种元素的第一电离能由大到小的顺序是___________ 。
(4)1mol环戊二烯(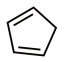 )中含有σ键的数目是
)中含有σ键的数目是___________ ,π键的数目为___________ 。
(5)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为___________ 。SiCl4可发生水解反应,机理如下:___________ (填标号)。
(6)已知H2O、NH3、CH4三种分子中,键角由大到小的顺序是___________ ,原因为___________ 。
(7)在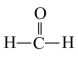 分子中,键角∠HCO
分子中,键角∠HCO___________ (填“>”“<”或“=”)∠HCH,理由是___________ 。
(1)元素O与Se同主族,电负性O
(2)
 离子的VSEPR模型为
离子的VSEPR模型为(3)6-氨基青霉烷酸
 结构中S原子的杂化方式是
结构中S原子的杂化方式是(4)1mol环戊二烯(
 )中含有σ键的数目是
)中含有σ键的数目是(5)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为

(6)已知H2O、NH3、CH4三种分子中,键角由大到小的顺序是
(7)在
 分子中,键角∠HCO
分子中,键角∠HCO
您最近一年使用:0次
名校
2 . 下列说法中正确的个数为
①Cu的第二电离能大于Zn的第二电离能
②H与Cl以1﹕1的关系结合为HCl是因为共价键具有方向性
③ 的VSEPR模型与空间结构一致
的VSEPR模型与空间结构一致
④在冰晶体中,每个H2O分子周围紧邻的分子有4个,是因为水分子之间存在氢键,氢键也具有方向性和饱和性
①Cu的第二电离能大于Zn的第二电离能
②H与Cl以1﹕1的关系结合为HCl是因为共价键具有方向性
③
 的VSEPR模型与空间结构一致
的VSEPR模型与空间结构一致④在冰晶体中,每个H2O分子周围紧邻的分子有4个,是因为水分子之间存在氢键,氢键也具有方向性和饱和性
| A.1 | B.2 | C.3 | D.4 |
您最近一年使用:0次
3 . 下列有关化学用语正确的是
A. 中的 中的 键电子云轮廓图: 键电子云轮廓图: |
B. 空间结构与VSEPR模型都是平面三角形 空间结构与VSEPR模型都是平面三角形 |
C. 分子的球棍模型: 分子的球棍模型: |
D.邻羟基苯甲醛分子内氢键示意图: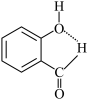 |
您最近一年使用:0次
名校
4 . 用价层电子对互斥模型可以判断许多分子或离子的空间结构,有时也能用来推测键角大小,下列判断正确的是
A. 中心原子的价层电子对数为3,是平面三角形结构 中心原子的价层电子对数为3,是平面三角形结构 |
B.键角大小顺序为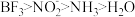 |
C. 是三角锥形的分子 是三角锥形的分子 |
D. 、 、 都是三角锥形的分子 都是三角锥形的分子 |
您最近一年使用:0次
2024-04-28更新
|
162次组卷
|
2卷引用:四川省内江市资中县第二中学2023-2024学年高二下学期3月月考化学试题
名校
5 . 下列分子或离子的空间立体构型与其中心原子VSEPR模型与一致的是
A. | B. | C. | D. |
您最近一年使用:0次
名校
解题方法
6 . 下列表达方式或说法正确的是
A. 、 、 、 、 、HCl四分子中孤电子对最多的是 、HCl四分子中孤电子对最多的是 |
B.氯化铵的电子式: |
| C.电负性和第一电离能的大小均可作为判断元素性质强弱的依据 |
| D.金属锌比铜活泼,因此Zn的第一电离能小于Cu |
您最近一年使用:0次
名校
解题方法
7 .  为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
①标准状况下,
 和
和 的混合气体中含有的π键数为
的混合气体中含有的π键数为
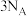
④6.2g白磷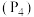 所含σ键的数目为
所含σ键的数目为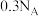
⑤0.25mol 中氙的价层电子对数为
中氙的价层电子对数为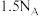
⑥46g 中
中 杂化的原子数为
杂化的原子数为
⑦1mol 分子中,S原子的价层电子对数目为
分子中,S原子的价层电子对数目为
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是①标准状况下,

 和
和 的混合气体中含有的π键数为
的混合气体中含有的π键数为
②32g  单质(
单质( 分子结构:
分子结构: )中,
)中, 数目为
数目为
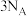
④6.2g白磷
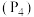 所含σ键的数目为
所含σ键的数目为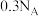
⑤0.25mol
 中氙的价层电子对数为
中氙的价层电子对数为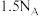
⑥46g
 中
中 杂化的原子数为
杂化的原子数为
⑦1mol
 分子中,S原子的价层电子对数目为
分子中,S原子的价层电子对数目为
| A.①③⑤⑦ | B.①②④⑤ | C.①④⑦ | D.①②③⑥ |
您最近一年使用:0次
名校
解题方法
8 . 下列描述中正确的是
A. 和 和 的中心原子均为 的中心原子均为 杂化 杂化 |
B. 的空间构型为平面三角形 的空间构型为平面三角形 |
C. 中有每个原子均满足最外层8电子稳定结构 中有每个原子均满足最外层8电子稳定结构 |
D. 分子的立体构型为V形 分子的立体构型为V形 |
您最近一年使用:0次
名校
解题方法
9 . 研究发现,铜基催化剂可以促进二氧化碳(CO2)转换成一氧化碳(CO)、甲醛(CH2O)或乙烯(CH2=CH2)及乙醇(CH3CH2OH)等多碳化合物,对于“碳达峰”和“碳中和”目标的顺利实现具有积极推动作用。
(1)Cu基态原子核外电子排布式为___________ ,该元素位于元素周期表第___________ 族,属于___________ 区。
(2)下列说法正确的是___________ (填序号)
a.H2O、CH4、CO2的沸点:H2O>CO2>CH4
b.CH4分子中含有极性键,是极性分子
c.CH2=CH2、CH2O分子中碳原子的杂化方式不同
d.根据价层电子互斥理论,CH2O,H2O,BF3,SO3分子中,H2O的中心原子价层电子对数不同于其他分子
(3)已知具有相同价电子数和相同原子数的分子或离子具有相同的结构,这一原理称为“等电子原理”。根据等电子原理,写出两个与CO2具有相同空间构型的分子或者离子___________ 。
(4)在海洋生物作用下形成CaCO3,亦是减缓大气中CO2增加的主要途径。CaCO3中的化学键除了σ键外,还存在___________ 和大π键,CO 大π键应表示为
大π键应表示为___________ 。(大π键可用符号Π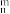 表示,其中n代表参与形成大π键的原子数,m代表参与形成大π键的电子数,如苯分子中的大π键表示为Π
表示,其中n代表参与形成大π键的原子数,m代表参与形成大π键的电子数,如苯分子中的大π键表示为Π )
)
(5)铜基催化剂铁表面上铁原子吸附离解的碳原子局部示意图如图所示(图中小黑球代表碳原子,灰球代表铜原子)。则催化剂表面上C/Cu原子数比为___________ 。

(6)已和CO2在高温高压下所形成的晶体的晶胞如图所示,CO2的晶胞参数(棱长)apm,其密度为bg•cm-3,则阿伏加德罗常数为___________ (列出计算式即可)。
(1)Cu基态原子核外电子排布式为
(2)下列说法正确的是
a.H2O、CH4、CO2的沸点:H2O>CO2>CH4
b.CH4分子中含有极性键,是极性分子
c.CH2=CH2、CH2O分子中碳原子的杂化方式不同
d.根据价层电子互斥理论,CH2O,H2O,BF3,SO3分子中,H2O的中心原子价层电子对数不同于其他分子
(3)已知具有相同价电子数和相同原子数的分子或离子具有相同的结构,这一原理称为“等电子原理”。根据等电子原理,写出两个与CO2具有相同空间构型的分子或者离子
(4)在海洋生物作用下形成CaCO3,亦是减缓大气中CO2增加的主要途径。CaCO3中的化学键除了σ键外,还存在
 大π键应表示为
大π键应表示为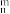 表示,其中n代表参与形成大π键的原子数,m代表参与形成大π键的电子数,如苯分子中的大π键表示为Π
表示,其中n代表参与形成大π键的原子数,m代表参与形成大π键的电子数,如苯分子中的大π键表示为Π )
)(5)铜基催化剂铁表面上铁原子吸附离解的碳原子局部示意图如图所示(图中小黑球代表碳原子,灰球代表铜原子)。则催化剂表面上C/Cu原子数比为

(6)已和CO2在高温高压下所形成的晶体的晶胞如图所示,CO2的晶胞参数(棱长)apm,其密度为bg•cm-3,则阿伏加德罗常数为

您最近一年使用:0次
名校
10 . 结合VSEPR理论和杂化轨道理论,判断下列分子的中心原子杂化方式、空间构型。
| 分子 | 中心原子,写元素符号 | 价层电子对数 | 杂化轨道数 | 轨道杂化方式 | 孤电子对数 | 分子的空间构型 |
 | C | 4 | 4 |  | 0 | 正四面体 |
 | ||||||
 | ||||||
 |
您最近一年使用:0次
2024-03-31更新
|
320次组卷
|
2卷引用:四川省成都高新实验中学2023-2024学年高二下学期3月月考化学试卷



