名校
1 . 下列说法正确的是
A.通过X射线衍射测定发现 中存在 中存在 , , 的空间结构为直线形 的空间结构为直线形 |
B. 和 和 两种阳离子的中心原子的价层电子对数相同 两种阳离子的中心原子的价层电子对数相同 |
C. 和 和 分子中C原子的杂化方式相同 分子中C原子的杂化方式相同 |
D. 、 、 、 、 、 、 的键角由大到小的顺序为 的键角由大到小的顺序为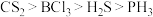 |
您最近一年使用:0次
名校
解题方法
2 . 按要求填空:
(1)元素O与Se同主族,电负性O___________ Se(选填“>”、“<”、“=”),基态Se原子价层电子空间运动状态有___________ 种。
(2) 离子的VSEPR模型为
离子的VSEPR模型为___________ ,离子空间构型为___________ 。
(3)6-氨基青霉烷酸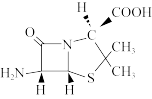 结构中S原子的杂化方式是
结构中S原子的杂化方式是___________ ,组成中C、N、O三种元素的第一电离能由大到小的顺序是___________ 。
(4)1mol环戊二烯(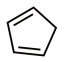 )中含有σ键的数目是
)中含有σ键的数目是___________ ,π键的数目为___________ 。
(5)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为___________ 。SiCl4可发生水解反应,机理如下:___________ (填标号)。
(6)已知H2O、NH3、CH4三种分子中,键角由大到小的顺序是___________ ,原因为___________ 。
(7)在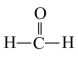 分子中,键角∠HCO
分子中,键角∠HCO___________ (填“>”“<”或“=”)∠HCH,理由是___________ 。
(1)元素O与Se同主族,电负性O
(2)
 离子的VSEPR模型为
离子的VSEPR模型为(3)6-氨基青霉烷酸
 结构中S原子的杂化方式是
结构中S原子的杂化方式是(4)1mol环戊二烯(
 )中含有σ键的数目是
)中含有σ键的数目是(5)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为

(6)已知H2O、NH3、CH4三种分子中,键角由大到小的顺序是
(7)在
 分子中,键角∠HCO
分子中,键角∠HCO
您最近一年使用:0次
3 . 下列有关化学用语正确的是
A. 中的 中的 键电子云轮廓图: 键电子云轮廓图: |
B. 空间结构与VSEPR模型都是平面三角形 空间结构与VSEPR模型都是平面三角形 |
C. 分子的球棍模型: 分子的球棍模型: |
D.邻羟基苯甲醛分子内氢键示意图: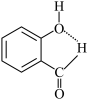 |
您最近一年使用:0次
名校
解题方法
4 . 下列表达方式或说法正确的是
A. 、 、 、 、 、HCl四分子中孤电子对最多的是 、HCl四分子中孤电子对最多的是 |
B.氯化铵的电子式: |
| C.电负性和第一电离能的大小均可作为判断元素性质强弱的依据 |
| D.金属锌比铜活泼,因此Zn的第一电离能小于Cu |
您最近一年使用:0次
名校
解题方法
5 .  为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
①标准状况下,
 和
和 的混合气体中含有的π键数为
的混合气体中含有的π键数为
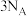
④6.2g白磷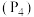 所含σ键的数目为
所含σ键的数目为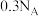
⑤0.25mol 中氙的价层电子对数为
中氙的价层电子对数为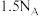
⑥46g 中
中 杂化的原子数为
杂化的原子数为
⑦1mol 分子中,S原子的价层电子对数目为
分子中,S原子的价层电子对数目为
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是①标准状况下,

 和
和 的混合气体中含有的π键数为
的混合气体中含有的π键数为
②32g  单质(
单质( 分子结构:
分子结构: )中,
)中, 数目为
数目为
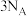
④6.2g白磷
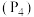 所含σ键的数目为
所含σ键的数目为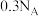
⑤0.25mol
 中氙的价层电子对数为
中氙的价层电子对数为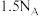
⑥46g
 中
中 杂化的原子数为
杂化的原子数为
⑦1mol
 分子中,S原子的价层电子对数目为
分子中,S原子的价层电子对数目为
| A.①③⑤⑦ | B.①②④⑤ | C.①④⑦ | D.①②③⑥ |
您最近一年使用:0次
名校
解题方法
6 . 铜是生活中一种非常重要的金属,黄铜矿(CuFeS2)是炼铜的最主要矿物,火法炼铜时涉及反应:2CuFeS2+O2=Cu2S+2FeS+SO2。
(1)O的轨道表示式为_______ ,其最高能级的原子轨道形状为_______ ,第一电离能:O_____ N(填“>”或“<”),Fe2+的价层电子排布式为______ 。
(2)SO2的VSEPR构型为_______ ,键角_______ H2O(填“>”或“<”);Cu元素位于周期表的________ 区,Cu和Zn的部分电离能数据如表所示,观察数据可知I2(Cu)>I2(Zn),对此,你的解释是______ 。
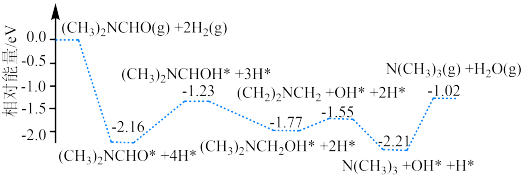
(3)我国科学家实现了铜催化剂将(CH3)2NCHO转化为N(CH3)3。计算机模拟单个分子在铜催化剂表面的反应历程如图所示:______ ;该反应在______ (填“高温”/“低温”/“任何温度”)下有自发性。
(1)O的轨道表示式为
(2)SO2的VSEPR构型为
| 元素 | Cu | Zn | |
| 电离能/(kJ•mol-1) | I1 | 746 | 906 |
| I2 | 1985 | 1733 | |
(3)我国科学家实现了铜催化剂将(CH3)2NCHO转化为N(CH3)3。计算机模拟单个分子在铜催化剂表面的反应历程如图所示:
您最近一年使用:0次
2024-03-10更新
|
127次组卷
|
2卷引用:四川省绵阳中学2023-2024学年高二下学期开学化学试题
名校
解题方法
7 . 下列化学用语表述正确的是
A.基态铬原子的价层电子排布式: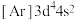 |
B.用电子云轮廓图描述2Py原子轨道的形状: 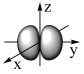 |
C.氨气分子的VSEPR模型: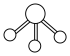 |
D.基态碳原子的核外电子轨道表示式为: 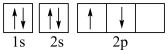 |
您最近一年使用:0次
2024-01-22更新
|
167次组卷
|
2卷引用:四川省德阳外国语学校2023-2024学年高二下学期入学考试化学试题
名校
解题方法
8 . 含碘的物质广泛应用于生活中。如(CH3NH3)PbI3作为典型的有机金属卤化物,一直是太阳能电池研究的宠儿;AgI可用于显影剂和人工增雨。
(1)基态碘原子的价电子排布式为___________ 。
(2)CH3NH 中所含元素电负性从大到小的顺序为
中所含元素电负性从大到小的顺序为___________ 。
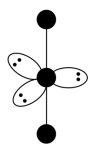
(3)I 的VSEPR模型如下图,中心I原子的杂化方式是
的VSEPR模型如下图,中心I原子的杂化方式是___________ (填“sp3”、“sp”、“sp3d”或“sp3d2”)。I 的空间构型为
的空间构型为___________ 。
(4)Ti的四卤化物熔点如下表所示。由此可推知,TiF4中的化学键类型是___________ TiCl4至TiI4熔点依次升高,原因是___________ 。
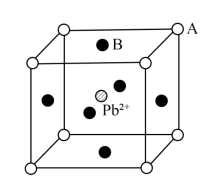
(5)(CH3NH3)PbI3晶体属于钙钛矿型结构(如图所示)。Pb2+周围距离最近且相等的I-数目有___________ 个;晶胞中A、B之间的距离为apm,(CH3NH3)PbI3式量为M,该物质的密度ρ=___________ g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
(6)在离子晶体中,当0.414<r(阳离子)∶r(阴离子)<0.732时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知r(Ag+)∶r(I-)=0.573,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。造成AgI晶体结构不同于NaCl晶体结构的原因不可能 是___________ (填标号)。
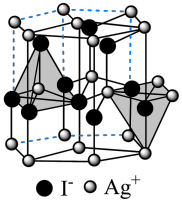
a.几何因素 b.电荷因素 c.键性因素
(1)基态碘原子的价电子排布式为
(2)CH3NH
 中所含元素电负性从大到小的顺序为
中所含元素电负性从大到小的顺序为(3)I
 的VSEPR模型如下图,中心I原子的杂化方式是
的VSEPR模型如下图,中心I原子的杂化方式是 的空间构型为
的空间构型为
(4)Ti的四卤化物熔点如下表所示。由此可推知,TiF4中的化学键类型是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -24.12 | 38.3 | 155 |
(5)(CH3NH3)PbI3晶体属于钙钛矿型结构(如图所示)。Pb2+周围距离最近且相等的I-数目有

(6)在离子晶体中,当0.414<r(阳离子)∶r(阴离子)<0.732时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知r(Ag+)∶r(I-)=0.573,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。造成AgI晶体结构不同于NaCl晶体结构的原因

a.几何因素 b.电荷因素 c.键性因素
您最近一年使用:0次
名校
解题方法
9 . 下列有关原子结构和元素性质的叙述中,正确的是
| A.邻羟基苯甲醛的熔点高于对羟基苯甲醛的熔点 |
| B.第四周期元素中,基态锰原子价电子层中未成对电子数最多 |
| C.钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能 |
D.价层电子对互斥理论中, 键电子对数不计入中心原子的价层电子对数 键电子对数不计入中心原子的价层电子对数 |
您最近一年使用:0次
2023-09-15更新
|
143次组卷
|
2卷引用:四川省南充高级中学2022-2023学年高二上学期1月期末考试化学试题
名校
解题方法
10 . 化合物T是一种用于合成药物的重要试剂,其结构简式如图所示。已知X、Y、Z、M、N为原子序数依次增大的前四周期主族元素,Z、M位于同一主族,X、Y、N的最外层电子数之和等于Z的最外层电子数。下列有关叙述错误的是
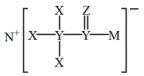
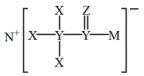
A.简单离子半径: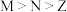 |
B.简单氢化物稳定性: |
C.化合物 与YZM均为直线形分子 与YZM均为直线形分子 |
| D.化合物T中所有原子均满足8电子相对稳定结构 |
您最近一年使用:0次



