铜是生活中一种非常重要的金属,黄铜矿(CuFeS2)是炼铜的最主要矿物,火法炼铜时涉及反应:2CuFeS2+O2=Cu2S+2FeS+SO2。
(1)O的轨道表示式为_______ ,其最高能级的原子轨道形状为_______ ,第一电离能:O_____ N(填“>”或“<”),Fe2+的价层电子排布式为______ 。
(2)SO2的VSEPR构型为_______ ,键角_______ H2O(填“>”或“<”);Cu元素位于周期表的________ 区,Cu和Zn的部分电离能数据如表所示,观察数据可知I2(Cu)>I2(Zn),对此,你的解释是______ 。
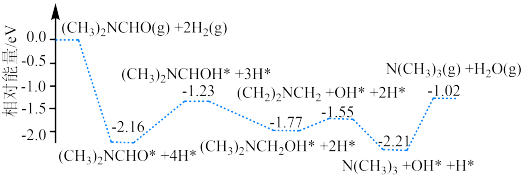
(3)我国科学家实现了铜催化剂将(CH3)2NCHO转化为N(CH3)3。计算机模拟单个分子在铜催化剂表面的反应历程如图所示:______ ;该反应在______ (填“高温”/“低温”/“任何温度”)下有自发性。
(1)O的轨道表示式为
(2)SO2的VSEPR构型为
| 元素 | Cu | Zn | |
| 电离能/(kJ•mol-1) | I1 | 746 | 906 |
| I2 | 1985 | 1733 | |
(3)我国科学家实现了铜催化剂将(CH3)2NCHO转化为N(CH3)3。计算机模拟单个分子在铜催化剂表面的反应历程如图所示:
更新时间:2024-03-10 18:43:57
|
相似题推荐
【推荐1】我国力争2030年前实现碳达峰,2060年前实现碳中和。 的综合利用是实现碳中和的措施之一。
的综合利用是实现碳中和的措施之一。
Ⅰ. 和
和 在金属催化剂表面可以合成
在金属催化剂表面可以合成 ,普遍反应路径有三种,其中一种反应路径经历
,普遍反应路径有三种,其中一种反应路径经历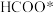 中间体。某小组研究了金属钴的不同晶面【
中间体。某小组研究了金属钴的不同晶面【 、
、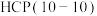 、
、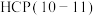 】对
】对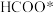 这种反应路径的催化效果,相关基元反应能量变化如下表(*指微粒吸附在催化剂表面):
这种反应路径的催化效果,相关基元反应能量变化如下表(*指微粒吸附在催化剂表面):
(1)写出在 晶面反应的控速步基元反应:
晶面反应的控速步基元反应:______ 。
(2)仅比较表格数据可知, 和
和 在该条件下合成
在该条件下合成 ,
,______ 晶面的催化效果最好。
Ⅱ. 和
和 一定条件下也可以合成甲醇,该过程存在副反应II。
一定条件下也可以合成甲醇,该过程存在副反应II。
反应Ⅰ:
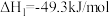
反应Ⅱ:

(3)上述反应中相关物质能量如图1所示。计算
______  。
。
(4)向VL密闭容器中通入
 、
、
 ,在催化剂作用下发生反应。相同时间内温度对
,在催化剂作用下发生反应。相同时间内温度对 转化率及
转化率及 和
和 产率的影响如图2所示。
产率的影响如图2所示。 的转化率随温度升高而增大的原因可能是
的转化率随温度升高而增大的原因可能是______ 。表示 产率随温度变化的曲线是
产率随温度变化的曲线是______ (填“a”或“b”)。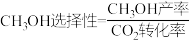 ),则0~tmin内
),则0~tmin内 的反应速率为
的反应速率为______ mol/(L·min),反应Ⅱ的平衡常数为______ (结果保留2位有效数字)。
Ⅲ.2021年我国科学家首先实现了从 到淀粉的全人工合成。其中的一个步骤是利用新型电化学催化装置(如图所示)将
到淀粉的全人工合成。其中的一个步骤是利用新型电化学催化装置(如图所示)将 转化为
转化为 。
。______ 。
 的综合利用是实现碳中和的措施之一。
的综合利用是实现碳中和的措施之一。Ⅰ.
 和
和 在金属催化剂表面可以合成
在金属催化剂表面可以合成 ,普遍反应路径有三种,其中一种反应路径经历
,普遍反应路径有三种,其中一种反应路径经历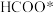 中间体。某小组研究了金属钴的不同晶面【
中间体。某小组研究了金属钴的不同晶面【 、
、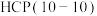 、
、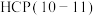 】对
】对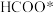 这种反应路径的催化效果,相关基元反应能量变化如下表(*指微粒吸附在催化剂表面):
这种反应路径的催化效果,相关基元反应能量变化如下表(*指微粒吸附在催化剂表面):| 基元反应步骤 |  | 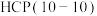 | 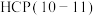 | |||
| 活化能(eV) | 反应热(eV) | 活化能(eV) | 反应热(eV) | 活化能(eV) | 反应热(eV) | |
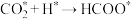 | 0.46 | -0.52 | 0.66 | -0.12 | 0.20 | -0.69 |
 | 1.27 | 0.73 | 0.23 | -0.16 | 1.36 | 0.78 |
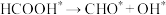 | 0.76 | -0.11 | 0.44 | -0.18 | 0.96 | -0.47 |
 | 0.53 | 0.15 | 0.42 | 0.14 | 0.54 | 0.15 |
 | 0.90 | 0.27 | 0.80 | 0.08 | 1.37 | 0.69 |
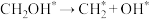 | 0.70 | -0.63 | 0.33 | -0.47 | 0.60 | -1.02 |
 晶面反应的控速步基元反应:
晶面反应的控速步基元反应:(2)仅比较表格数据可知,
 和
和 在该条件下合成
在该条件下合成 ,
,Ⅱ.
 和
和 一定条件下也可以合成甲醇,该过程存在副反应II。
一定条件下也可以合成甲醇,该过程存在副反应II。反应Ⅰ:

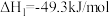
反应Ⅱ:


(3)上述反应中相关物质能量如图1所示。计算

 。
。(4)向VL密闭容器中通入

 、
、
 ,在催化剂作用下发生反应。相同时间内温度对
,在催化剂作用下发生反应。相同时间内温度对 转化率及
转化率及 和
和 产率的影响如图2所示。
产率的影响如图2所示。 的转化率随温度升高而增大的原因可能是
的转化率随温度升高而增大的原因可能是 产率随温度变化的曲线是
产率随温度变化的曲线是
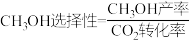 ),则0~tmin内
),则0~tmin内 的反应速率为
的反应速率为Ⅲ.2021年我国科学家首先实现了从
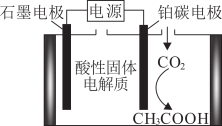
 到淀粉的全人工合成。其中的一个步骤是利用新型电化学催化装置(如图所示)将
到淀粉的全人工合成。其中的一个步骤是利用新型电化学催化装置(如图所示)将 转化为
转化为 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化。为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应C(s)+CO2(g)⇌2CO(g) ΔH,测得压强、温度对CO、CO2的平衡组成的影响如图所示:

(1)p1、p2、p3的大小关系是_______ ,欲提高C与CO2反应中CO2的平衡转化率,应采取的措施为___________________ 。图中a、b、c三点对应的平衡常数(用Ka、Kb和Kc表示)大小关系是____________________ ;
(2)900 ℃、1.013 MPa时,1 mol CO2与足量碳反应达平衡后容器的体积为V,CO2的转化率为__________ ,该反应的平衡常数K=________________ 。
(3)将(2)中平衡体系温度降至640 ℃,压强降至0.101 3 MPa,重新达到平衡后CO2的体积分数为50%。条件改变时,正反应和逆反应速率如何变化?_________________ ,二者之间有何关系?__________________ 。
(4)CO2催化加氢也可转化为CO,但同时会合成二甲醚,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=41.2 kJ·mol-1
反应Ⅱ:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ΔH=-122.5 kJ·mol-1
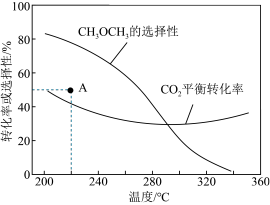
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图
其中:CH3OCH3的选择性=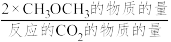 ×100%
×100%
①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是___________ ;
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有________________ 。
(5)水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
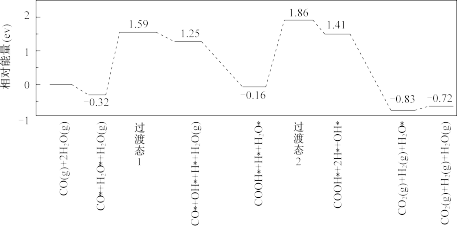
可知水煤气变换的ΔH_______ 0(填“大于”、“等于”或“小于”)。该历程中最大能垒(活化能)E正=_______ eV,写出该步骤的化学方程式____________________ 。

(1)p1、p2、p3的大小关系是
(2)900 ℃、1.013 MPa时,1 mol CO2与足量碳反应达平衡后容器的体积为V,CO2的转化率为
(3)将(2)中平衡体系温度降至640 ℃,压强降至0.101 3 MPa,重新达到平衡后CO2的体积分数为50%。条件改变时,正反应和逆反应速率如何变化?
(4)CO2催化加氢也可转化为CO,但同时会合成二甲醚,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=41.2 kJ·mol-1
反应Ⅱ:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ΔH=-122.5 kJ·mol-1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图

其中:CH3OCH3的选择性=
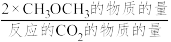 ×100%
×100%①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有
(5)水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。

可知水煤气变换的ΔH
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】H2O2是一种常见试剂,在实验室、工业生产上有广泛用途。H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如下图甲、乙两种实验装置。
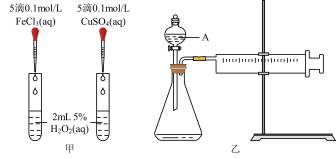
(1)若利用图甲装置,可通过观察___________ 现象,从而定性比较得出结论。
(2)有同学提出将0.1 FeCl3,改为
FeCl3,改为___________ 更为合理,其理由是___________ 。
(3)若利用乙实验可进行定量比较分析,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中还需要用到的实验仪器为___________ 。
(4)请简述如何用“微热法”检查装置乙的气密性良好:组装好实验装置,关闭分液漏斗活塞,___________ 。
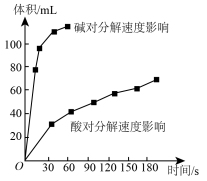
(5)如下图为某小组研究的酸、碱对H2O2分解的影响。该小组提出可以用BaO2固体与H2SO4溶液反应制H2O2,反应的化学方程式为___________ ,支持这一方案的理由是___________ 。
(6)使用催化剂Mn2+催化H2O2分解的反应中,Mn2+改变了___________ (填字母序号)
A.活化分子的浓度 B.反应限度 C.反应焓变
D.反应路径 E.反应活化能 F.活化分子百分数

(1)若利用图甲装置,可通过观察
(2)有同学提出将0.1
 FeCl3,改为
FeCl3,改为(3)若利用乙实验可进行定量比较分析,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中还需要用到的实验仪器为
(4)请简述如何用“微热法”检查装置乙的气密性良好:组装好实验装置,关闭分液漏斗活塞,
(5)如下图为某小组研究的酸、碱对H2O2分解的影响。该小组提出可以用BaO2固体与H2SO4溶液反应制H2O2,反应的化学方程式为

(6)使用催化剂Mn2+催化H2O2分解的反应中,Mn2+改变了
A.活化分子的浓度 B.反应限度 C.反应焓变
D.反应路径 E.反应活化能 F.活化分子百分数
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】已知X、Y、Z、R都是周期表中前四周期的元素,它们的核电荷数依次增大。X是空气中含量最高的元素,Z基态原子核外K、L、M三层电子数之比为1∶4∶2,R基态原子的3d原子轨道上的电子数是4s原子轨道上的4倍,Y基态原子的最外层电子数等于Z、R基态原子的最外层电子数之和。(答题时,X、Y、Z、R用所对应的元素符号表示)
(1)X、Y、Z的第一电离能由小到大的顺序为_______ ,写出 的空间构型:
的空间构型:_______ 。
(2) 的外围电子排布式为
的外围电子排布式为______ 。
(3)Z基态原子核外电子占据的原子轨道总数为________ ,有_____ 种运动状态不同的电子。
(4)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得到较高纯度的 。反应的化学方程式为
。反应的化学方程式为________ 。
(5)Y、Z形成的某晶体的晶胞结构如下图所示,则该化合物的化学式为______ 。

(1)X、Y、Z的第一电离能由小到大的顺序为
 的空间构型:
的空间构型:(2)
 的外围电子排布式为
的外围电子排布式为(3)Z基态原子核外电子占据的原子轨道总数为
(4)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得到较高纯度的
 。反应的化学方程式为
。反应的化学方程式为(5)Y、Z形成的某晶体的晶胞结构如下图所示,则该化合物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】化学电池在各行各业都得到了广泛应用,其发展对调整能源结构,实现低碳经济有着重要意义.通过下列反应可以制备某电池正极的活性物质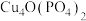 .
.
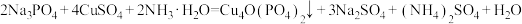
请回答下列问题:
(1)上述反应中涉及的N、O、P元素电负性由小到大的顺序是_____________ .
(2)基态 原子的价电子排布式为
原子的价电子排布式为_____________ .
(3)上述制备所得固体最后用乙醇洗涤的目的是____________ .
(4) 的立体构型为
的立体构型为__________ ,其中Р原子的杂化方式是____________ .
(5)在硫酸铜溶液中加入过量 溶液,生成配合物
溶液,生成配合物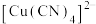 ,则
,则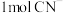 中含有的
中含有的 键数目为
键数目为______ , 中含有的
中含有的 键数目为
键数目为_____________ .
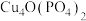 .
.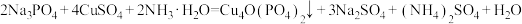
请回答下列问题:
(1)上述反应中涉及的N、O、P元素电负性由小到大的顺序是
(2)基态
 原子的价电子排布式为
原子的价电子排布式为(3)上述制备所得固体最后用乙醇洗涤的目的是
(4)
 的立体构型为
的立体构型为(5)在硫酸铜溶液中加入过量
 溶液,生成配合物
溶液,生成配合物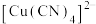 ,则
,则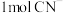 中含有的
中含有的 键数目为
键数目为 中含有的
中含有的 键数目为
键数目为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】已知 的3d轨道上有6个电子,试回答:
的3d轨道上有6个电子,试回答:
(1)M元素原子的核外电子排布式为_______ 。
(2)M元素在元素周期表中的位置为_______ 。
(3)M的基态原子共有_______ 种不同能级的电子,价层电子数为_______ 。
(4)某元素原子的基态电子排布式为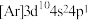 ,该元素处于元素周期表的第四周期第
,该元素处于元素周期表的第四周期第_______ 族。试推测该元素处于元素周期表的_______ 区,该元素原子的价电子排布图为_______ 。
(5)与M元素相对比,铬(Cr)元素的原子核外电子排布有其特点,请写出Cr基态原子核外电子排布式_______ 。
 的3d轨道上有6个电子,试回答:
的3d轨道上有6个电子,试回答:(1)M元素原子的核外电子排布式为
(2)M元素在元素周期表中的位置为
(3)M的基态原子共有
(4)某元素原子的基态电子排布式为
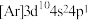 ,该元素处于元素周期表的第四周期第
,该元素处于元素周期表的第四周期第(5)与M元素相对比,铬(Cr)元素的原子核外电子排布有其特点,请写出Cr基态原子核外电子排布式
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】氮及其化合物与人类生产、生活息息相关.回答下列问题:
(1)基态N原子中电子在2p轨道上的排布遵循的原则是__________ ,前4周期元素中,基态原子核外电子排布成单电子数最多的元素的价层电子排布式为__________ 。
(2)C、N、O三种元素第一电离能从大到小的顺序是__________ 。
(3)N2F2分子中N原子的杂化方式是__________ ,l mol N2F2含有__________ molσ键.
(4)NF3的键角__________ NH3的键角(填“<”“>”或“=”),原因是__________ .
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.l mol NH4BF4__________ mol配位键.
(6)安全气囊的设计原理为6NaN3+FeIO3 Na2O+2Fe+9N2↑
Na2O+2Fe+9N2↑
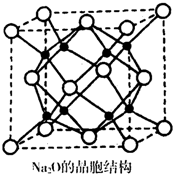
①等电子体的原理是:原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质.写出两种与N3-互为等电子体的分子或离子__________ .
②Na2O的晶胞结构如图所示,晶胞边长为566pm,晶胞中氧原子的配位数为__________ ,Na2O晶体的密度为__________ g•cm-3(只要求列算式,不必计算出结果)。
(1)基态N原子中电子在2p轨道上的排布遵循的原则是
(2)C、N、O三种元素第一电离能从大到小的顺序是
(3)N2F2分子中N原子的杂化方式是
(4)NF3的键角
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.l mol NH4BF4
(6)安全气囊的设计原理为6NaN3+FeIO3
 Na2O+2Fe+9N2↑
Na2O+2Fe+9N2↑①等电子体的原理是:原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质.写出两种与N3-互为等电子体的分子或离子
②Na2O的晶胞结构如图所示,晶胞边长为566pm,晶胞中氧原子的配位数为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】辽宁省钒钛磁铁矿储量巨大,以该区内发现的钒钛磁铁矿(主要成分为铁的氧化物、FeTiO3、TiO2、V2O5、SiO2、CaO、MgO、Al2O3等)为原料,经过以下流程获取粗铁和偏钒酸铵(NH4VO2)。查阅资料得知:偏钒酸铵为白色结晶性粉末,可溶于热水和稀氨水,微溶于冷水。

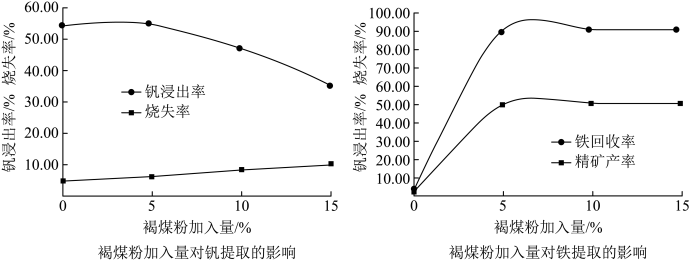
(1)褐煤粉加入量对钒、铁提取的影响如图,综合考虑,褐煤粉加入量最优为_____ ,原因是_____ 。
(2)回转窑内SiO2与碳酸钠反应的化学方程式为_____ ,CO 的键角∠OCO=
的键角∠OCO=_____ 。
(3)“水浸”时可以提高钒的浸出率的措施有_____ (填一种即可),加入硫酸铝溶液,SiO 转化为H2SiO3,Al3+则转化为一种两性氢氧化物,该反应的离子方程式为
转化为H2SiO3,Al3+则转化为一种两性氢氧化物,该反应的离子方程式为_____ 。
(4)第一电离能:N_____ (填“>”、“<”或“=”)O;基态钒原子核外电子的空间运动状态有_____ 种;“沉钒”后常用_____ (填标号)洗涤偏钒酸铵粗产品。
a.热水 b.稀氨水 c.冷水

(1)褐煤粉加入量对钒、铁提取的影响如图,综合考虑,褐煤粉加入量最优为

(2)回转窑内SiO2与碳酸钠反应的化学方程式为
 的键角∠OCO=
的键角∠OCO=(3)“水浸”时可以提高钒的浸出率的措施有
 转化为H2SiO3,Al3+则转化为一种两性氢氧化物,该反应的离子方程式为
转化为H2SiO3,Al3+则转化为一种两性氢氧化物,该反应的离子方程式为(4)第一电离能:N
a.热水 b.稀氨水 c.冷水
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】锂、铁、铬、卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题。
(1)Fe在元素周期表中的位置为_______ ,位于_______ 区,有_______ 个不同运动状态的价电子,最高能层中电子所占据的原子轨道呈_______ 形。
(2)C、N、O、F都是第二周期的典型非金属元素,下列说法不正确的是_______(填标号)。
(3)固态氟化氢中存在 形式,画出
形式,画出 的链状结构
的链状结构_______ 。
(4)下列Li原子轨道表示式表示的状态中,能量最低和最高的分别为_______ 、_______ (填字母)。
A.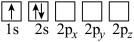 B.
B.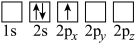
C. D.
D.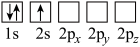
(5)①对于基态Cr原子,下列叙述正确的是_______ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B.4s电子能量较高,一定在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
② 、
、 以及分子
以及分子 的空间结构和相应的键角如下图所示。
的空间结构和相应的键角如下图所示。
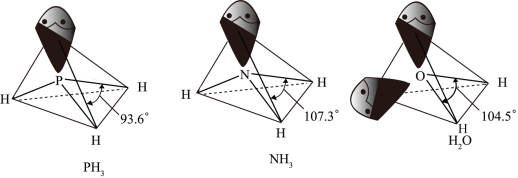
 中P的杂化类型是
中P的杂化类型是_______ , 的键角小于
的键角小于 的分析原因:
的分析原因:_______ 。
(1)Fe在元素周期表中的位置为
(2)C、N、O、F都是第二周期的典型非金属元素,下列说法不正确的是_______(填标号)。
| A.第一电离能:C<N<O<F |
| B.原子半径:C>N>O>F |
| C.最简单气态氢化物的热稳定性:N<O<F |
| D.元素的最高正价:C<N<O |
 形式,画出
形式,画出 的链状结构
的链状结构(4)下列Li原子轨道表示式表示的状态中,能量最低和最高的分别为
A.
 B.
B.
C.
 D.
D.
(5)①对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为

B.4s电子能量较高,一定在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
②
 、
、 以及分子
以及分子 的空间结构和相应的键角如下图所示。
的空间结构和相应的键角如下图所示。
 中P的杂化类型是
中P的杂化类型是 的键角小于
的键角小于 的分析原因:
的分析原因:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】A、B、C、D为原子序数依次增大的四种元素,A2﹣和B+具有相同的电子构型:C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是___________ (填元素符号),其中C原子的核外电子排布式为 ___________ 。
(2)单质A有两种同素异形体,其中沸点高的是___________ (填分子式),原因是 ___________ ;B的氢化物的电子式为 ___________ 。
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为___________ ,中心原子的杂化轨道类型为 ___________ 。
(4)化合物D2A的立体构型为___________ ,中心原子的价层电子对数为 ___________ 。
(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为
(4)化合物D2A的立体构型为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】我国在新材料领域有重大突破,研发的新材料含有B、C、N、 、
、 、
、 等元素。回答下列问题:
等元素。回答下列问题:
(1)基态 原子的价电子排布式为
原子的价电子排布式为_______ ,电子占据的最高能层的电子云轮廓图形状为_______ 。
(2)B、C、N三种元素中电负性最大的是_______ (填元素符号),C在形成化合物时,其键型以共价键为主,原因是_______ 。
(3) 中阴离子的空间构型是
中阴离子的空间构型是_______ ,写出与该阴离子互为等电子体的一种分子的化学式:_______ 。
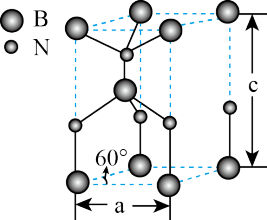
(4)某种含B和N两种元素的功能陶瓷,其原子在晶胞中所处的位置如图所示,该功能陶瓷的化学式为_______ 。若晶胞底边的边长为 ,高为
,高为 ,
, 为阿伏加德罗常数的值,则晶体密度为
为阿伏加德罗常数的值,则晶体密度为_______  (用含a、c的代数式表示)。
(用含a、c的代数式表示)。
 、
、 、
、 等元素。回答下列问题:
等元素。回答下列问题:(1)基态
 原子的价电子排布式为
原子的价电子排布式为(2)B、C、N三种元素中电负性最大的是
(3)
 中阴离子的空间构型是
中阴离子的空间构型是(4)某种含B和N两种元素的功能陶瓷,其原子在晶胞中所处的位置如图所示,该功能陶瓷的化学式为
 ,高为
,高为 ,
, 为阿伏加德罗常数的值,则晶体密度为
为阿伏加德罗常数的值,则晶体密度为 (用含a、c的代数式表示)。
(用含a、c的代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】硒(Se)被国内外医药界和营养学界尊称为“生命的火种”,享有“长寿元素”“抗癌之王”“心脏守护神”“天然解毒剂”等美誉。硒在电子工业中可用作光电管、太阳能电池,硒元素形成的多种化合物也有重要作用。
(1)硒和硫同为VIA族元素,基态硒原子的价层电子排布式为_______ 。
(2)单质硒的熔点为221℃,其晶体类型_______ 。
(3)与硒元素相邻的同周期元素有砷和溴,则这三种元素的第一电离能由小到大的顺序为_______ (用元素符号表示)。
(4)SeO2分子中Se原子的杂化轨道类型为_______ ; 的立体构型是
的立体构型是_______ ;写出一种与 互为等电子体的分子
互为等电子体的分子_______ (写化学式)。
(5)H2Se分子中含有的共价键类型为_______ ;H2Se水溶液比H2S水溶液的酸性强,原因是 _______ 。
(6)硒化锌是一种重要的半导体材料,其晶胞结构如图所示(白色球表示Se原子),该晶胞中硒原子的配位数为_______ ;若该晶胞的密度为 ,硒化锌的摩尔质量为
,硒化锌的摩尔质量为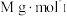 ,用NA表示阿伏加德罗常数的值,则晶胞参数a为
,用NA表示阿伏加德罗常数的值,则晶胞参数a为_______ pm。

(1)硒和硫同为VIA族元素,基态硒原子的价层电子排布式为
(2)单质硒的熔点为221℃,其晶体类型
(3)与硒元素相邻的同周期元素有砷和溴,则这三种元素的第一电离能由小到大的顺序为
(4)SeO2分子中Se原子的杂化轨道类型为
 的立体构型是
的立体构型是 互为等电子体的分子
互为等电子体的分子(5)H2Se分子中含有的共价键类型为
(6)硒化锌是一种重要的半导体材料,其晶胞结构如图所示(白色球表示Se原子),该晶胞中硒原子的配位数为
 ,硒化锌的摩尔质量为
,硒化锌的摩尔质量为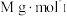 ,用NA表示阿伏加德罗常数的值,则晶胞参数a为
,用NA表示阿伏加德罗常数的值,则晶胞参数a为
您最近一年使用:0次



