名校
1 . 下列说法正确的是
A.通过X射线衍射测定发现 中存在 中存在 , , 的空间结构为直线形 的空间结构为直线形 |
B. 和 和 两种阳离子的中心原子的价层电子对数相同 两种阳离子的中心原子的价层电子对数相同 |
C. 和 和 分子中C原子的杂化方式相同 分子中C原子的杂化方式相同 |
D. 、 、 、 、 、 、 的键角由大到小的顺序为 的键角由大到小的顺序为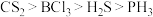 |
您最近一年使用:0次
名校
解题方法
2 . 下列正确的组合是
| 编号 | 化学式 | 价层电子对互斥模型 | 空间结构 |
| ① | CO2 | 直线形 | 直线形 |
| ② | HCHO | 平面三角形 | 三角锥形 |
| ③ | SO3 | 正四面体形 | 平面三角形 |
| ④ |  | 正四面体形 | 正四面体形 |
| A.①② | B.②③ | C.②④ | D.①④ |
您最近一年使用:0次
3 . 设 为阿伏伽德罗常数,则下列说法正确的是
为阿伏伽德罗常数,则下列说法正确的是
 为阿伏伽德罗常数,则下列说法正确的是
为阿伏伽德罗常数,则下列说法正确的是A.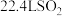 (标准状况)与足量的氧气充分反应,转移的电子数目为 (标准状况)与足量的氧气充分反应,转移的电子数目为 |
B.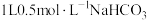 溶液中含有 溶液中含有 数目为 数目为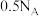 |
C.标准状况下, 含共用电子对数为 含共用电子对数为 |
D.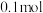 肼( 肼( )含有孤电子对数为 )含有孤电子对数为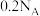 |
您最近一年使用:0次
4 . 利用钛铁矿(主要成分为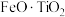 ,还含有少量
,还含有少量 、
、 、
、 等杂质)制备磷酸铁和锂离子电池正极材料(
等杂质)制备磷酸铁和锂离子电池正极材料( )的部分工业流程如图所示:
)的部分工业流程如图所示: (
(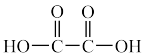 )、
)、 ,中C原子的杂化方式依次为
,中C原子的杂化方式依次为___________ 、___________ 。
(2) 、
、 的熔、沸点:
的熔、沸点: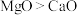 ,原因为
,原因为___________ 。
(3)已知 的配合物有多种,如
的配合物有多种,如 、
、 (
( )等。
)等。
① 的VSEPR模型名称为
的VSEPR模型名称为___________ 。
②从原子结构角度预测 具有较强的还原性,原因为
具有较强的还原性,原因为___________ 。
③配合物 (
( )与游离的
)与游离的 分子相比,配合物中的
分子相比,配合物中的 键角
键角___________ (填“>”“<”或“=”) 中的,原因是
中的,原因是___________ 。
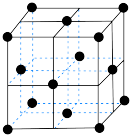
(4)在一定条件下铁形成的晶体的基本结构单元如图所示,设铁原子的半径为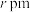 ,则
,则 原子的配位数为
原子的配位数为___________ ,该晶体的密度为___________ (列出计算式) 。
。
 ,还含有少量
,还含有少量 、
、 、
、 等杂质)制备磷酸铁和锂离子电池正极材料(
等杂质)制备磷酸铁和锂离子电池正极材料( )的部分工业流程如图所示:
)的部分工业流程如图所示: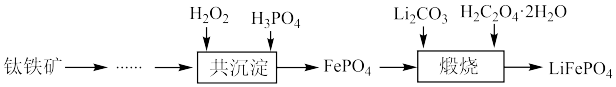
 (
(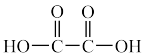 )、
)、 ,中C原子的杂化方式依次为
,中C原子的杂化方式依次为(2)
 、
、 的熔、沸点:
的熔、沸点: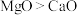 ,原因为
,原因为(3)已知
 的配合物有多种,如
的配合物有多种,如 、
、 (
( )等。
)等。①
 的VSEPR模型名称为
的VSEPR模型名称为②从原子结构角度预测
 具有较强的还原性,原因为
具有较强的还原性,原因为③配合物
 (
( )与游离的
)与游离的 分子相比,配合物中的
分子相比,配合物中的 键角
键角 中的,原因是
中的,原因是(4)在一定条件下铁形成的晶体的基本结构单元如图所示,设铁原子的半径为
 ,则
,则 原子的配位数为
原子的配位数为 。
。
您最近一年使用:0次
2024-05-24更新
|
105次组卷
|
4卷引用:四川省雅安市2023-2024学年高三下学期5月联考理综试题-高中化学
名校
解题方法
5 . 按要求填空:
(1)元素O与Se同主族,电负性O___________ Se(选填“>”、“<”、“=”),基态Se原子价层电子空间运动状态有___________ 种。
(2) 离子的VSEPR模型为
离子的VSEPR模型为___________ ,离子空间构型为___________ 。
(3)6-氨基青霉烷酸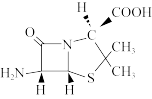 结构中S原子的杂化方式是
结构中S原子的杂化方式是___________ ,组成中C、N、O三种元素的第一电离能由大到小的顺序是___________ 。
(4)1mol环戊二烯(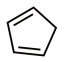 )中含有σ键的数目是
)中含有σ键的数目是___________ ,π键的数目为___________ 。
(5)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为___________ 。SiCl4可发生水解反应,机理如下:___________ (填标号)。
(6)已知H2O、NH3、CH4三种分子中,键角由大到小的顺序是___________ ,原因为___________ 。
(7)在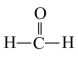 分子中,键角∠HCO
分子中,键角∠HCO___________ (填“>”“<”或“=”)∠HCH,理由是___________ 。
(1)元素O与Se同主族,电负性O
(2)
 离子的VSEPR模型为
离子的VSEPR模型为(3)6-氨基青霉烷酸
 结构中S原子的杂化方式是
结构中S原子的杂化方式是(4)1mol环戊二烯(
 )中含有σ键的数目是
)中含有σ键的数目是(5)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为

(6)已知H2O、NH3、CH4三种分子中,键角由大到小的顺序是
(7)在
 分子中,键角∠HCO
分子中,键角∠HCO
您最近一年使用:0次
名校
6 . 下列说法中正确的个数为
①Cu的第二电离能大于Zn的第二电离能
②H与Cl以1﹕1的关系结合为HCl是因为共价键具有方向性
③ 的VSEPR模型与空间结构一致
的VSEPR模型与空间结构一致
④在冰晶体中,每个H2O分子周围紧邻的分子有4个,是因为水分子之间存在氢键,氢键也具有方向性和饱和性
①Cu的第二电离能大于Zn的第二电离能
②H与Cl以1﹕1的关系结合为HCl是因为共价键具有方向性
③
 的VSEPR模型与空间结构一致
的VSEPR模型与空间结构一致④在冰晶体中,每个H2O分子周围紧邻的分子有4个,是因为水分子之间存在氢键,氢键也具有方向性和饱和性
| A.1 | B.2 | C.3 | D.4 |
您最近一年使用:0次
7 . 下列有关化学用语正确的是
A. 中的 中的 键电子云轮廓图: 键电子云轮廓图: |
B. 空间结构与VSEPR模型都是平面三角形 空间结构与VSEPR模型都是平面三角形 |
C. 分子的球棍模型: 分子的球棍模型: |
D.邻羟基苯甲醛分子内氢键示意图: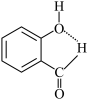 |
您最近一年使用:0次
名校
8 . 用价层电子对互斥模型可以判断许多分子或离子的空间结构,有时也能用来推测键角大小,下列判断正确的是
A. 中心原子的价层电子对数为3,是平面三角形结构 中心原子的价层电子对数为3,是平面三角形结构 |
B.键角大小顺序为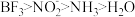 |
C. 是三角锥形的分子 是三角锥形的分子 |
D. 、 、 都是三角锥形的分子 都是三角锥形的分子 |
您最近一年使用:0次
2024-04-28更新
|
179次组卷
|
2卷引用:四川省内江市资中县第二中学2023-2024学年高二下学期3月月考化学试题
解题方法
9 . 偏磷酸钡Ba(PO3)2具有耐高温、透光性良好等性能,是制备磷酸盐光学玻璃的基础物质。利用湿法磷酸(主要成分为H3PO4,含有少量Mg2+、Fe3+、 、
、 等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示: 时:①
时:①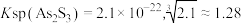 ;
;
②将NH3通入H3PO4溶液中,当pH=3.8~4.5时生成NH4H2PO4,pH=8.0~8.2时生成(NH4)2HPO4。
回答下列问题:
(1)“滤渣1”中含硫化合物的化学式为___________ 。
(2)“滤渣2”的主要成分有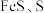 及
及 ,其中生成
,其中生成 的离子方程式为
的离子方程式为___________ ; 下,当
下,当 沉淀完全时,
沉淀完全时, 至少为
至少为___________  [当
[当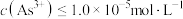 时认为沉淀完全]。
时认为沉淀完全]。
(3)“氨化”的目的之一是通入NH3调节溶液的pH,当溶液pH为4.3时H3PO4转化为___________ (填化学式)。
(4)“脱镁”的目的是生成MgF2沉淀除去Mg2+。若将流程中“氨化”与“脱镁”交换,Mg2+沉淀不完全,原因是___________ 。
(5)“结晶”后得到 晶体,“煅烧”时生成
晶体,“煅烧”时生成 和
和 等物质,其反应的化学方程式为
等物质,其反应的化学方程式为___________ ;比较 键角:
键角: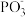
_________  (选填“
(选填“ ”“
”“ ”或“
”或“ ”),其原因是
”),其原因是___________ 。
 、
、 等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
 时:①
时:①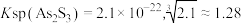 ;
;②将NH3通入H3PO4溶液中,当pH=3.8~4.5时生成NH4H2PO4,pH=8.0~8.2时生成(NH4)2HPO4。
回答下列问题:
(1)“滤渣1”中含硫化合物的化学式为
(2)“滤渣2”的主要成分有
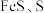 及
及 ,其中生成
,其中生成 的离子方程式为
的离子方程式为 下,当
下,当 沉淀完全时,
沉淀完全时, 至少为
至少为 [当
[当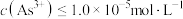 时认为沉淀完全]。
时认为沉淀完全]。(3)“氨化”的目的之一是通入NH3调节溶液的pH,当溶液pH为4.3时H3PO4转化为
(4)“脱镁”的目的是生成MgF2沉淀除去Mg2+。若将流程中“氨化”与“脱镁”交换,Mg2+沉淀不完全,原因是
(5)“结晶”后得到
 晶体,“煅烧”时生成
晶体,“煅烧”时生成 和
和 等物质,其反应的化学方程式为
等物质,其反应的化学方程式为 键角:
键角: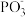
 (选填“
(选填“ ”“
”“ ”或“
”或“ ”),其原因是
”),其原因是
您最近一年使用:0次
2024-04-15更新
|
250次组卷
|
3卷引用:2024届四川省雅安市天全中学高三下学期模拟预测化学试题
名校
10 . 下列分子或离子的空间立体构型与其中心原子VSEPR模型与一致的是
A. | B. | C. | D. |
您最近一年使用:0次



