名校
解题方法
1 . 下列有关原子结构和元素性质的叙述中,正确的是
| A.邻羟基苯甲醛的熔点高于对羟基苯甲醛的熔点 |
| B.第四周期元素中,基态锰原子价电子层中未成对电子数最多 |
| C.钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能 |
D.价层电子对互斥理论中, 键电子对数不计入中心原子的价层电子对数 键电子对数不计入中心原子的价层电子对数 |
您最近一年使用:0次
2023-09-15更新
|
143次组卷
|
2卷引用:四川省南充高级中学2022-2023学年高二上学期1月期末考试化学试题
解题方法
2 . A、B、C、D、E是五种原子序数依次增大的前四周期元素。A、B、C是位于p区的同一周期的元素,C的价层电子排布式为 ,A与C原子核外的未成对电子数相等;
,A与C原子核外的未成对电子数相等; 与
与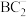 互为等电子体;E为过渡元素,其原子核外没有未成对电子。请回答下列问题:
互为等电子体;E为过渡元素,其原子核外没有未成对电子。请回答下列问题:
(1)E在周期表中的位置为___________ 。B元素原子的价层电子排布式是___________ 。
(2) 的立体构型为
的立体构型为___________ ,其中心原子杂化方式为___________ 。
(3)A、B、C的简单氢化物中,键角由大到小的顺序为___________ (用分子式表示)。
(4)A、C两种元素能形成化合物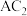 ,该分子为
,该分子为___________ 分子(填“极性”或“非极性”),根据电子云重叠方式的不同,分子中共价键的类型有___________ 。
 ,A与C原子核外的未成对电子数相等;
,A与C原子核外的未成对电子数相等; 与
与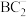 互为等电子体;E为过渡元素,其原子核外没有未成对电子。请回答下列问题:
互为等电子体;E为过渡元素,其原子核外没有未成对电子。请回答下列问题:(1)E在周期表中的位置为
(2)
 的立体构型为
的立体构型为(3)A、B、C的简单氢化物中,键角由大到小的顺序为
(4)A、C两种元素能形成化合物
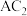 ,该分子为
,该分子为
您最近一年使用:0次
名校
解题方法
3 . 下表为周期表的一部分,其中的编号代表对应的元素。请回答下列问题:
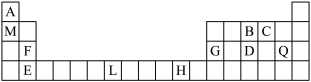
(1)表中属于ds区元素的是_______ (填元素符号)。BC 的
的 模型为
模型为_______ 。
(2)基态L原子的价电子排布图_______ ,同一周期且最外层电子数与L相同的元素有_______ 种。
(3)由A、B、C三元素形成的离子化合物中B原子的_______ 杂化轨道与A原子的_______ 轨道重叠形成_______ 键。
(4)上述元素中金属性最强的为_______ (填名称),其与C以原子个数比为1∶2形成化合物甲,则甲的电子式为_______ ,其中所含化学键类型为_______ 。
(5)工业上用电解法冶炼G的单质,阳极的电极反应式为_______ 。

(1)表中属于ds区元素的是
 的
的 模型为
模型为(2)基态L原子的价电子排布图
(3)由A、B、C三元素形成的离子化合物中B原子的
(4)上述元素中金属性最强的为
(5)工业上用电解法冶炼G的单质,阳极的电极反应式为
您最近一年使用:0次
2023-04-08更新
|
157次组卷
|
2卷引用:四川省宜宾市第四中学校2023-2024学年高二上学期1月期末考试化学试题
名校
解题方法
4 . 将少量硫酸铜溶液滴入氨基乙酸钠溶液(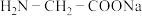 )中即可得到结构如图所示的产物。下列叙述错误的是
)中即可得到结构如图所示的产物。下列叙述错误的是
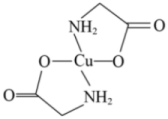
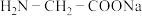 )中即可得到结构如图所示的产物。下列叙述错误的是
)中即可得到结构如图所示的产物。下列叙述错误的是
A.氨基乙酸钠中的氮原子采取 杂化 杂化 |
B.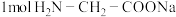 中含有 中含有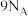 个 个 键 键 |
C.产物中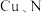 原子VSEPR模型均为四面体形结构 原子VSEPR模型均为四面体形结构 |
| D.该反应产物为配合物,只有内界而无外界 |
您最近一年使用:0次
名校
解题方法
5 . 下列有关物质结构与性质的说法正确的是
A.基态碳原子价电子排布图: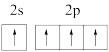 |
B. 的空间结构:平面三角形 的空间结构:平面三角形 |
| C.C60高温高压下可转变为结构类似金刚石的碳玻璃,该碳玻璃中碳原子为sp2杂化 |
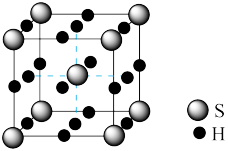
| D.硫单质和氢气低温高压下可形成一种新型超导材料,其晶胞如图,该晶体属分子晶体 |
您最近一年使用:0次
2022-11-26更新
|
634次组卷
|
6卷引用:四川省绵阳市高中2022-2023学年高二上学期期末摸底考试化学试题
名校
解题方法
6 . 科学家近期合成了一种配合物,该物质可以在温和条件下活化H2,将N3-转化为NH ,反应过程如图所示。下列说法错误的是
,反应过程如图所示。下列说法错误的是

 ,反应过程如图所示。下列说法错误的是
,反应过程如图所示。下列说法错误的是
| A.产物中N原子的杂化轨道类型为sp3 |
| B.NH2-的VSEPR模型为四面体形 |
| C.电负性大小:N>C>Fe |
D.键角:NH >NH3 >NH3 |
您最近一年使用:0次
2022-11-18更新
|
1464次组卷
|
8卷引用:四川省南充高级中学2022-2023学年高二上学期1月期末考试化学试题
名校
7 . 乙酰丙酮是“种有酯气味的无色透明液体,常用作溶剂、有机合成中间体、金属络合剂等。它有两种主要互变异构体A、B,与Be2+、Mg2+、Cu2+、Zn2+等形成配合物C。回答下列有关问题:

(1)基态Cu2+离子的价电子排布式为_______ ,Be和Mg第一电离能较大的是_______ 原子。
(2)A中C原子杂化轨道类型有_______ ;按VSEPR预测B中∠HCC约为_______ 、_______ (填角度)。B在碱性条件下断裂极性最大的键,是_______ 键。 具有分子内氢键的是_______ (填“A”或“B”)。
(3)C中σ键与π键数目之比为_______ 。
(4)乙酰丙酮易溶于醇、氯仿、丙酮等多数有机溶剂,理由是_______ 。
(5)金属铜的某些参数如下:
根据上述数据,计算Cu的原子半径为_______ pm (列出计算表达式,设NA是阿伏加德罗常数的值)。

(1)基态Cu2+离子的价电子排布式为
(2)A中C原子杂化轨道类型有
(3)C中σ键与π键数目之比为
(4)乙酰丙酮易溶于醇、氯仿、丙酮等多数有机溶剂,理由是
(5)金属铜的某些参数如下:
| 金属 | 堆积类型 | 密度/g·cm-3 | 相对原子质量 |
| Cu | 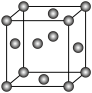 | ρ | 64 |
您最近一年使用:0次
2022-05-12更新
|
1446次组卷
|
7卷引用:四川省叙永第一中学校2023-2024学年高三上学期1月期末理综试题-高中化学
四川省叙永第一中学校2023-2024学年高三上学期1月期末理综试题-高中化学四川省南充市2022届高三适应性考试(三诊)理综化学试题四川省南充市嘉陵第一中学2022-2023学年高二下学期6月月考化学试题四川省眉山市彭山区第一中学2023-2024学年高三上学期11月月考理综试题(已下线)2022年全国甲卷高考真题变式题(非选择题)(已下线)2022年全国乙卷高考变式题(非选择题)(已下线)考前特训 [综合大题分类规范练]
名校
解题方法
8 . 下列分子的VSEPR模型与其空间立体构型一致的是
A. | B. | C. | D. |
您最近一年使用:0次
2022-01-19更新
|
875次组卷
|
4卷引用:四川省乐山市2021-2022学年高二上学期期末教学质量检测化学试题
四川省乐山市2021-2022学年高二上学期期末教学质量检测化学试题(已下线)第2.2.1讲 分子结构的测定和多样性 价层电子对互斥模型-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)浙江省杭州市西湖高级中学2021-2022学年高二下学期期中考试化学试题 广东茂名市电白区2022-2023学年高二下学期期中(选择性)考试化学试题
解题方法
9 . 已知周期表前四周期的元素a、b、c、d、e、f原子序数依次增大。a的核外电子总数与其周期数相同,c原子的最外层电子数是内层电子数的3倍,b、c左右相邻,c与d同族,e元素正三价离子的3d能级为半充满,f原子的次外层全充满,最外层只有一个电子。请回答下列问题:
(1)元素e的原子核外共有______ 种不同运动状态的电子,有_____ 种不同能级的电子。
(2)实验室中制备ba3的化学方程式为____ ,产生的ba3与a2d比较,键角更大的是____ ,原因是_____ 。
(3)f晶胞为面心立方最密堆积,其空间利用率为________ ,由d、e、f组成的物质晶胞结构如图。

①该物质的化学式为___________ 。
②以该物质为原料炼f过程中,会产生d的低价氧化物,该d的低价氧化物分子空间构型为___________ ,与其互为等电子体的阴离子有___________ 。
(4)由a、b、c、d四种元素可组成两种酸式盐M和N,请写出M和N之间反应的离子方程式___________ 。
(1)元素e的原子核外共有
(2)实验室中制备ba3的化学方程式为
(3)f晶胞为面心立方最密堆积,其空间利用率为

①该物质的化学式为
②以该物质为原料炼f过程中,会产生d的低价氧化物,该d的低价氧化物分子空间构型为
(4)由a、b、c、d四种元素可组成两种酸式盐M和N,请写出M和N之间反应的离子方程式
您最近一年使用:0次
解题方法
10 . 回答下列问题:
(1) 分子中所有原子均满足8电子构型,
分子中所有原子均满足8电子构型, 分子中
分子中 键和
键和 键的个数比为
键的个数比为_______ ,中心原子的杂化方式为_______ 。
(2) 的分子结构如图所示,其中
的分子结构如图所示,其中 原子的杂化方式为
原子的杂化方式为_______ 。
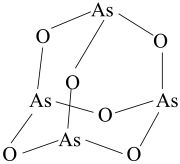
(3) 中,
中, 原子的杂化方式为
原子的杂化方式为_______ ;列举与 立体构型相同的一种离子和一种分子
立体构型相同的一种离子和一种分子_______ 、_______ (填化学式)。
(4)用价层电子对互斥理论推断 分子中,
分子中, 价层电子对数为
价层电子对数为_______ , 的VSEPR模型名称是
的VSEPR模型名称是_______ ;属于_______ 分子(填“极性”或“非极性”)分子中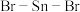 的键角
的键角_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(1)
 分子中所有原子均满足8电子构型,
分子中所有原子均满足8电子构型, 分子中
分子中 键和
键和 键的个数比为
键的个数比为(2)
 的分子结构如图所示,其中
的分子结构如图所示,其中 原子的杂化方式为
原子的杂化方式为
(3)
 中,
中, 原子的杂化方式为
原子的杂化方式为 立体构型相同的一种离子和一种分子
立体构型相同的一种离子和一种分子(4)用价层电子对互斥理论推断
 分子中,
分子中, 价层电子对数为
价层电子对数为 的VSEPR模型名称是
的VSEPR模型名称是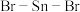 的键角
的键角 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
您最近一年使用:0次



