名校
解题方法
1 . 锰(Mn)、钴(Co)、镍(Ni)等过渡金属元素化合物的应用研究是前沿科学之一,回答下列问题:
(1)Mn的价电子排布式为___________ 。金属锰可导电、导热,有金属光泽和延展性,这些性质都可以用“___________ 理论”解释。
(2)已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合下列___________ (填序号),每个Mn原子周围紧邻的原子数为___________ 。
A.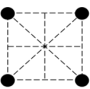 B.
B.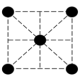 C.
C.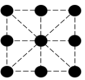 D.
D.
(3)[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO(CH3)2。DMSO中硫原子的杂化轨道类型为___________ ,SO(CH3)2中键角∠C—S—O___________ CH3COCH3中键角∠C—C—O(填“大于”“小于”或“等于”),ClO 的空间构型是
的空间构型是___________ ,元素S、Cl、O的电负性由大到小的顺序为___________ 。
(4)镍和苯基硼酸在催化剂作用下可以合成丙烯醇(CH2=CH—CH2OH),其相对分子质量等于丙醛(CH3CH2CHO),但两者沸点相差较大,原因是___________ 。
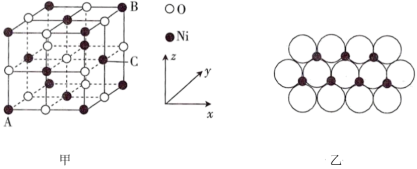
(5)NiO的晶胞结构如图甲所示,其中离子坐标参数A为(0,0,0),B为(1,1,1),则C的离子坐标参数为___________ 。一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为apm,设阿伏加德罗常数值为NA,每平方米面积上具有该晶体的质量为___________ g(用含a、NA的代数式表示)。
(1)Mn的价电子排布式为
(2)已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合下列
A.
 B.
B. C.
C. D.
D.
(3)[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO(CH3)2。DMSO中硫原子的杂化轨道类型为
 的空间构型是
的空间构型是(4)镍和苯基硼酸在催化剂作用下可以合成丙烯醇(CH2=CH—CH2OH),其相对分子质量等于丙醛(CH3CH2CHO),但两者沸点相差较大,原因是
(5)NiO的晶胞结构如图甲所示,其中离子坐标参数A为(0,0,0),B为(1,1,1),则C的离子坐标参数为

您最近一年使用:0次
2021-12-23更新
|
1199次组卷
|
9卷引用:四川省成都市成都外国语学校2022届高三下学期第二次诊断性考试理科综合化学试题
四川省成都市成都外国语学校2022届高三下学期第二次诊断性考试理科综合化学试题四川省南充高级中学2023-2024学年高三下学期第二次模拟考试化学四川省南充高级中学2024届高三第二次模拟考试理综-化学试题广东省“六校联盟”2021-2022学年高三上学期第三次联考化学试题(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)回归教材重难点11 物质结构与性质-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)黑龙江省哈尔滨师范大学附属中学2022-2023学年高三上学期10月月考化学试题黑龙江省绥化市绥棱县第一中学2022-2023学年高三上学期10月月考化学试题
名校
解题方法
2 . 短周期元素X、Y、Z、W的原子序数依次增大,元素X与Z可形成三角锥形的 分子,W与Y可形成平面三角形的
分子,W与Y可形成平面三角形的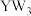 分子,X2遇W2即发生爆炸。下列说法中错误的是
分子,X2遇W2即发生爆炸。下列说法中错误的是
 分子,W与Y可形成平面三角形的
分子,W与Y可形成平面三角形的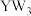 分子,X2遇W2即发生爆炸。下列说法中错误的是
分子,X2遇W2即发生爆炸。下列说法中错误的是A. 分子中Z原子的杂化方式为 分子中Z原子的杂化方式为 |
B.最高价氧化物的水化物的酸性 |
| C.Z的第一电离能在4种元素中最大 |
D. 分子与 分子与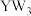 分子间可形成配位键 分子间可形成配位键 |
您最近一年使用:0次
2021-05-16更新
|
366次组卷
|
4卷引用:四川省成都市石室天府中学2020-2021学年高二下学期5月月考化学试题
名校
解题方法
3 . 氮原子可以形成σ键、π键、大π键和配位键,成键的多样性使其形成了多种具有独特组成的物质。回答下列问题:
(1)基态氮原子价电子排布式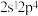 ,该排布方式违背了
,该排布方式违背了______ 。
(2)肼( )分子中孤电子对与σ键的数目之比为
)分子中孤电子对与σ键的数目之比为______ 。
(3)硝酸的结构可表示为 ,硝酸与水分子可形成一水合二硝酸结晶水合物(
,硝酸与水分子可形成一水合二硝酸结晶水合物(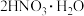 ),水分子以三个氢键与两个硝酸分子结合,请写出一水合二硝酸的结构式
),水分子以三个氢键与两个硝酸分子结合,请写出一水合二硝酸的结构式______ (氢键用“…”表示)。
(4)正硝酸钠( )为白色晶体,是一种重要的化工原料,其中
)为白色晶体,是一种重要的化工原料,其中 离子的空间构型为
离子的空间构型为______ ,写出一种与其互为等电子体的分子______ (填化学式)。
(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示。化学式为______ 。若两个最近的 原子间的距离为
原子间的距离为 ,则该晶体的密度是
,则该晶体的密度是______  (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 )。
)。

(6)如果上述晶胞将 原子放在顶点,则
原子放在顶点,则 原子会在晶胞中出现的位置是
原子会在晶胞中出现的位置是____ 。
(1)基态氮原子价电子排布式
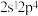 ,该排布方式违背了
,该排布方式违背了(2)肼(
 )分子中孤电子对与σ键的数目之比为
)分子中孤电子对与σ键的数目之比为(3)硝酸的结构可表示为
 ,硝酸与水分子可形成一水合二硝酸结晶水合物(
,硝酸与水分子可形成一水合二硝酸结晶水合物(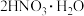 ),水分子以三个氢键与两个硝酸分子结合,请写出一水合二硝酸的结构式
),水分子以三个氢键与两个硝酸分子结合,请写出一水合二硝酸的结构式(4)正硝酸钠(
 )为白色晶体,是一种重要的化工原料,其中
)为白色晶体,是一种重要的化工原料,其中 离子的空间构型为
离子的空间构型为(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示。化学式为
 原子间的距离为
原子间的距离为 ,则该晶体的密度是
,则该晶体的密度是 (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 )。
)。
(6)如果上述晶胞将
 原子放在顶点,则
原子放在顶点,则 原子会在晶胞中出现的位置是
原子会在晶胞中出现的位置是
您最近一年使用:0次
2021-02-06更新
|
192次组卷
|
3卷引用:四川省内江市2020-2021学年高二上学期期末考试化学试题



