解题方法
1 . 2019年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家,其研究的是两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂(LiFePO4)为正极的电池。请回答下列问题:
(1)Mn位于元素周期表的_______ 区(填“s”或“p”或“d”或“ds”或“f”),基态钴原子的未成对电子数为_______ ,1mol [CoCl (NH3)5] Cl2 中含σ键数目为_______ NA。
(2)PH3是_______ 分子(填“极性”或“非极性”),其在水中的溶解性比NH3小,原因是_______ 。
(3)硫酸镍溶于氨水形成 蓝色溶液。
蓝色溶液。
① 中阴离子的立体构型是
中阴离子的立体构型是_______ 。
②向硫酸铜溶液逐滴加入氨水,会先生成难溶物而后溶解也能形成深蓝色溶液,写出难溶物溶于氨水的离子方程式:_______ 。
③单质铜及镍都是由_______ 键形成的晶体;元素铜与镍的第二电离能分别为: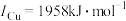 ,
, ,
,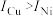 的原因是
的原因是_______ 。
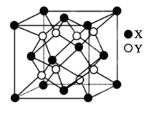
(4)硫化锂Li2S(摩尔质量Mg∙mol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag·cm-3,则距离最近的两个S2-的距离是_______ nm。(用含a、M、NA的计算式表示)
(1)Mn位于元素周期表的
(2)PH3是
(3)硫酸镍溶于氨水形成
 蓝色溶液。
蓝色溶液。①
 中阴离子的立体构型是
中阴离子的立体构型是②向硫酸铜溶液逐滴加入氨水,会先生成难溶物而后溶解也能形成深蓝色溶液,写出难溶物溶于氨水的离子方程式:
③单质铜及镍都是由
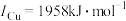 ,
, ,
,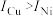 的原因是
的原因是(4)硫化锂Li2S(摩尔质量Mg∙mol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag·cm-3,则距离最近的两个S2-的距离是

您最近一年使用:0次
2 . 研究物质的微观结构,有助于理解物质变化规律和本质。
(1)氨气的水溶液中存在多种氢键,任意表示出其中一种:_______ 。
(2)CO与N2分子结构相似,下表是二者的键能数据( )。
)。
①1个CO分子中含有的π键数目是个_______ 个。
②结合数据比较活泼性:CO_______ N2(填“>”或“<”)。
(3)利用 可以合成化工原料
可以合成化工原料 、配合物
、配合物 等。
等。
① 分子结构式为:
分子结构式为: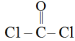 ,该分子空间结构为
,该分子空间结构为_______ 。
② 常温下呈液态,熔点为—20.5℃,沸点为103℃,易溶于非极性溶剂。据此可以判断
常温下呈液态,熔点为—20.5℃,沸点为103℃,易溶于非极性溶剂。据此可以判断 晶体属于
晶体属于___ 晶体。
③ 在一定条件下发生分解反应:
在一定条件下发生分解反应: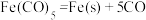 ,反应过程中,断裂的化学键只有配位键,形成的化学键是
,反应过程中,断裂的化学键只有配位键,形成的化学键是___ 。
(4)羧酸的酸性可用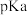 的大小衡量
的大小衡量 ,
,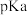 越小,酸性越强,相同温度下的三种酸:①乙酸(CH3COOH)②氯乙酸(CH2ClCOOH)③三氟乙酸(CF3COOH)的
越小,酸性越强,相同温度下的三种酸:①乙酸(CH3COOH)②氯乙酸(CH2ClCOOH)③三氟乙酸(CF3COOH)的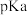 由小到大的顺序
由小到大的顺序___ (填序号)。
(5)过硫酸(分子式:H2S2O8;结构式: )为无色晶体,易溶于水,在热水中易水解。下列说法正确的是
)为无色晶体,易溶于水,在热水中易水解。下列说法正确的是___ (填序号)。
a.过硫酸属于共价化合物
b.过硫酸分子中含有与过氧化氢分子中相同的化学键
c.过硫酸分子可看作2个硫酸分子脱去1个水分子
(1)氨气的水溶液中存在多种氢键,任意表示出其中一种:
(2)CO与N2分子结构相似,下表是二者的键能数据(
 )。
)。| 分子 | C-O | C=O | C≡O | 分子 | N-N | N=N | N≡N |
| CO | 351 | 745 | 1071 | N2 | 193 | 418 | 946 |
②结合数据比较活泼性:CO
(3)利用
 可以合成化工原料
可以合成化工原料 、配合物
、配合物 等。
等。①
 分子结构式为:
分子结构式为: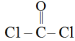 ,该分子空间结构为
,该分子空间结构为②
 常温下呈液态,熔点为—20.5℃,沸点为103℃,易溶于非极性溶剂。据此可以判断
常温下呈液态,熔点为—20.5℃,沸点为103℃,易溶于非极性溶剂。据此可以判断 晶体属于
晶体属于③
 在一定条件下发生分解反应:
在一定条件下发生分解反应: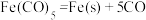 ,反应过程中,断裂的化学键只有配位键,形成的化学键是
,反应过程中,断裂的化学键只有配位键,形成的化学键是(4)羧酸的酸性可用
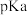 的大小衡量
的大小衡量 ,
,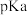 越小,酸性越强,相同温度下的三种酸:①乙酸(CH3COOH)②氯乙酸(CH2ClCOOH)③三氟乙酸(CF3COOH)的
越小,酸性越强,相同温度下的三种酸:①乙酸(CH3COOH)②氯乙酸(CH2ClCOOH)③三氟乙酸(CF3COOH)的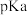 由小到大的顺序
由小到大的顺序(5)过硫酸(分子式:H2S2O8;结构式:
 )为无色晶体,易溶于水,在热水中易水解。下列说法正确的是
)为无色晶体,易溶于水,在热水中易水解。下列说法正确的是a.过硫酸属于共价化合物
b.过硫酸分子中含有与过氧化氢分子中相同的化学键
c.过硫酸分子可看作2个硫酸分子脱去1个水分子
您最近一年使用:0次
解题方法
3 . 我国科研人员在钠离子电池研究中又取得新突破。钠离子电池与锂离子电池工作原理相同、制造工艺相似,而且具有资源丰富、成本低廉、安全性能好等特点。一种钠离子电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解质溶液为的碳酸丙烯酯溶液。
回答下列问题:
(1)基态Na原子的电子排布式为__ ,最高能层电子云轮廓图形状为___ 。
(2)Te与S同主族,与 同周期,Te属于元素周期表中
同周期,Te属于元素周期表中__ 区元素,其基态原子的价电子排布图(即轨道表示式)为___ 。
(3)碳酸丙烯酯的结构简式为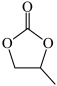 ,则其中π键和σ键的数目之比为
,则其中π键和σ键的数目之比为___ ,碳原子的杂化轨道类型为____ 。
(4)C元素的最高价氧化物的电子式为___ ,CO32-的VSEPR模型名称是___ ,ClO4-的立体构型是__ 。
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是__ ,该配离子包含的作用力为___ (填选项字母)。
A.极性键 B.金属键 C.氢键 D.配位键
(6)由原料制备负极材料的反应过程中,是否有电子转移___ (填“是”或者“否”)。
回答下列问题:
(1)基态Na原子的电子排布式为
(2)Te与S同主族,与
 同周期,Te属于元素周期表中
同周期,Te属于元素周期表中(3)碳酸丙烯酯的结构简式为
 ,则其中π键和σ键的数目之比为
,则其中π键和σ键的数目之比为(4)C元素的最高价氧化物的电子式为
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是
A.极性键 B.金属键 C.氢键 D.配位键
(6)由原料制备负极材料的反应过程中,是否有电子转移
您最近一年使用:0次
2020-05-19更新
|
144次组卷
|
2卷引用:天津市红桥区2020届高三下学期居家学习线上检测第一次模拟化学试题



