名校
解题方法
1 . 常温下,二氧化氯(ClO2)是一种黄绿色气体,具有强氧化性,其中心原子Cl为sp2杂化已被联合国卫生组织(WTO)列为Al级高效安全消毒剂,其中心原子Cl为sp2杂化。已知,工业上制备二氧化氯的方法之一是用甲醇在酸性条件下与氯酸钠反应,其反应的化学方程式:CH3OH+6NaClO3+3H2SO4=CO2↑+6ClO2↑+3Na2SO4+5H2O,则下列说法错误的是
| A.CO2是非极性分子 | B.键角: < < |
| C.CH3OH在反应中发生氧化反应 | D.ClO2分子空间构型为V形 |
您最近一年使用:0次
名校
解题方法
2 . 硫酸是重要的化工原料。稀硫酸具有酸的通性;浓硫酸具有吸水性、脱水性和强氧化性,能氧化大多数金属单质和部分非金属单质。金属冶炼时产生的含SO2废气经回收处理、催化氧化、吸收后可制得硫酸。2SO2(g)+O2(g) 2SO3(g)
2SO3(g)  =-196.6 kJ·mol-1。工业制硫酸尾气中的SO2可用氨水吸收,吸收液经处理后释放出的SO2又可循环利用。下列有关SO2、SO3、SO
=-196.6 kJ·mol-1。工业制硫酸尾气中的SO2可用氨水吸收,吸收液经处理后释放出的SO2又可循环利用。下列有关SO2、SO3、SO 、H2SO4的说法正确的是
、H2SO4的说法正确的是
 2SO3(g)
2SO3(g)  =-196.6 kJ·mol-1。工业制硫酸尾气中的SO2可用氨水吸收,吸收液经处理后释放出的SO2又可循环利用。下列有关SO2、SO3、SO
=-196.6 kJ·mol-1。工业制硫酸尾气中的SO2可用氨水吸收,吸收液经处理后释放出的SO2又可循环利用。下列有关SO2、SO3、SO 、H2SO4的说法正确的是
、H2SO4的说法正确的是| A.SO2转化为SO3时没有破坏共价键 |
| B.SO3的空间构型为三角锥形 |
C.SO 与SO3中的键角相等 与SO3中的键角相等 |
D.硫酸的结构为: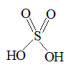 ,可以推测H2SO4分子间能形成氢键 ,可以推测H2SO4分子间能形成氢键 |
您最近一年使用:0次
2024-02-24更新
|
253次组卷
|
2卷引用:江苏省南京市六校联合体2023-2024学年高二下学期四月联考化学试卷
名校
3 . 氨是一种重要的化工原料,主要用于化肥工业,也广泛用于硝酸、纯碱、制药等工业。下列说法正确的是
A. 的空间构型为平面三角形 的空间构型为平面三角形 | B. 的水溶液不能导电 的水溶液不能导电 |
C. 与 与 能形成分子间氢键 能形成分子间氢键 | D.氨催化氧化制硝酸是利用了 的氧化性 的氧化性 |
您最近一年使用:0次
名校
解题方法
4 .  能吸收有害紫外线,保护人类赖以生存的空间。
能吸收有害紫外线,保护人类赖以生存的空间。 的分子结构如图,呈V形,两个键的夹角为116.5°,三个原子以一个O原子为中心,与另外两个O原子分别构成一个共价键;中间O原子提供两个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键——三个O原子均等地享有这些电子。
的分子结构如图,呈V形,两个键的夹角为116.5°,三个原子以一个O原子为中心,与另外两个O原子分别构成一个共价键;中间O原子提供两个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键——三个O原子均等地享有这些电子。 ,新生状态的“O”具有极强氧化性,请回答:
,新生状态的“O”具有极强氧化性,请回答:

(1)下列分子与 分子的结构最相似的是___________。
分子的结构最相似的是___________。
(2)分子中某原子有一对或几对没有跟其他原子共用的价电子叫孤对电子,那么 分子有
分子有___________ 对孤对电子。
(3) 中“特殊的化学键”是
中“特殊的化学键”是___________ 键(填“ ”或“
”或“ ”)。中心原子的杂化方式为
”)。中心原子的杂化方式为___________ 。
(4)配平反应___________ :_______PbS+_______ _______
_______ _______
_______
 能吸收有害紫外线,保护人类赖以生存的空间。
能吸收有害紫外线,保护人类赖以生存的空间。 的分子结构如图,呈V形,两个键的夹角为116.5°,三个原子以一个O原子为中心,与另外两个O原子分别构成一个共价键;中间O原子提供两个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键——三个O原子均等地享有这些电子。
的分子结构如图,呈V形,两个键的夹角为116.5°,三个原子以一个O原子为中心,与另外两个O原子分别构成一个共价键;中间O原子提供两个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键——三个O原子均等地享有这些电子。 ,新生状态的“O”具有极强氧化性,请回答:
,新生状态的“O”具有极强氧化性,请回答:
(1)下列分子与
 分子的结构最相似的是___________。
分子的结构最相似的是___________。A. | B. | C. | D. |
 分子有
分子有(3)
 中“特殊的化学键”是
中“特殊的化学键”是 ”或“
”或“ ”)。中心原子的杂化方式为
”)。中心原子的杂化方式为(4)配平反应
 _______
_______ _______
_______
您最近一年使用:0次
名校
解题方法
5 . 下列对分子性质的解释中,不正确的是( )
| A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 |
| B.NF3和BF3的杂化方式不同,前者是sp2后者是sp3 |
| C.HCHO、CH3—、SO3的分子空间构型相同 |
D.由图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子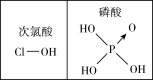 |
您最近一年使用:0次
6 . M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为______ ,晶体中原子间通过_____ 作用形成面心立方密堆积,其中M原子的配位数为______ 。
(2)元素Y基态原子的核外电子排布式为________ ,其同周期元素中,第一电离能最大的是______ (写元素符号)。元素Y的含氧酸中,酸性最强的是________ (写化学式),该酸根离子的立体构型为________ 。
(3)M与Y形成的一种化合物的立方晶胞如图所示。
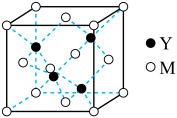
①该化合物的化学式为_______ ,已知晶胞参数a=0.542 nm,此晶体的密度为_______ g·cm–3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是________ 。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为_______ 。
(1)单质M的晶体类型为
(2)元素Y基态原子的核外电子排布式为
(3)M与Y形成的一种化合物的立方晶胞如图所示。

①该化合物的化学式为
②该化合物难溶于水但易溶于氨水,其原因是
您最近一年使用:0次
2016-12-09更新
|
1235次组卷
|
8卷引用:辽宁省辽阳市集美学校2017-2018学年高二3月月考化学试题



