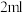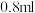名校
1 . 某小组探究含Cr元素的化合物间的转化,进行如下实验。
资料:
i.含Cr元素的常见粒子: (橙色)、
(橙色)、 (黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、
(黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、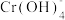 (亮绿色)。
(亮绿色)。
ii.H2O2在碱性环境中比在酸性环境中分解速率快。
iii.在碱性环境中,O2不能氧化+3价铬元素。
实验操作及现象如表:
(1)已知 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:
(黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:_____ 。
(2)I中,溶液由橙色变为绿色的总反应的离子方程式是_____ 。
(3)Ⅱ中,继续滴入NaOH溶液后,又有气泡生成的原因是_____ 。
(4)Ⅱ中,继续滴入NaOH溶液后,预测有Cr(OH)3沉淀生成,但实验时未观察到。
提出假设:在碱性环境中,+3价铬元素被H2O2氧化。
①甲同学设计实验证明假设成立:
取少量I中的绿色溶液,在滴入NaOH溶液前增加一步操作:______ 。然后滴入NaOH溶液,有蓝灰色沉淀生成,继续滴入NaOH溶液,沉淀溶解,溶液变为______ 色。
②乙同学进一步研究碱性环境对+3价铬元素的还原性或H2O2的氧化性的影响,设计如图实验。
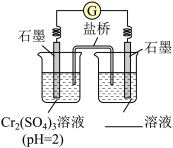
右侧烧杯的溶液中,氧化剂是_____ 。
开始时灵敏电流计指针不偏转,分别继续进行如下实验。
i.向左侧烧杯中滴入NaOH溶液,出现蓝灰色沉淀,继续缓慢滴入NaOH溶液,灵敏电流计指针向右偏转(电子从左向右运动),此时左侧的电极反应式为_____ 。
ii.向右侧烧杯中滴入NaOH溶液,有微小气泡生成,灵敏电流计指针向左偏转,左侧无明显变化。此时原电池中的总反应的化学方程式为_____ 。
(5)由上述实验, 与H2O2、
与H2O2、 与H2O2的氧化性强弱(填“>”或“<”):
与H2O2的氧化性强弱(填“>”或“<”):
酸性条件下,
_____ H2O2;碱性条件下, 
_____ H2O2。
资料:
i.含Cr元素的常见粒子:
 (橙色)、
(橙色)、 (黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、
(黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、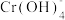 (亮绿色)。
(亮绿色)。ii.H2O2在碱性环境中比在酸性环境中分解速率快。
iii.在碱性环境中,O2不能氧化+3价铬元素。
实验操作及现象如表:
| 装置 | 步骤 | 操作 | 现象 |
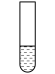 2mL0.0125mol•L-1K2Cr2O7溶液 | I | 先滴入稀硫酸至pH≈2,再滴入5滴5%H2O2溶液,振荡 | 溶液橙色加深。滴入H2O2溶液后迅速变为蓝紫色,有气泡生成。稍后,无明显气泡时,溶液由蓝紫色完全变为绿色 |
| Ⅱ | 继续缓慢滴入10滴2mol•L-1NaOH溶液,边滴,边振荡 | 又有气泡生成,溶液最终变为黄色 |
 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:
(黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:(2)I中,溶液由橙色变为绿色的总反应的离子方程式是
(3)Ⅱ中,继续滴入NaOH溶液后,又有气泡生成的原因是
(4)Ⅱ中,继续滴入NaOH溶液后,预测有Cr(OH)3沉淀生成,但实验时未观察到。
提出假设:在碱性环境中,+3价铬元素被H2O2氧化。
①甲同学设计实验证明假设成立:
取少量I中的绿色溶液,在滴入NaOH溶液前增加一步操作:
②乙同学进一步研究碱性环境对+3价铬元素的还原性或H2O2的氧化性的影响,设计如图实验。

右侧烧杯的溶液中,氧化剂是
开始时灵敏电流计指针不偏转,分别继续进行如下实验。
i.向左侧烧杯中滴入NaOH溶液,出现蓝灰色沉淀,继续缓慢滴入NaOH溶液,灵敏电流计指针向右偏转(电子从左向右运动),此时左侧的电极反应式为
ii.向右侧烧杯中滴入NaOH溶液,有微小气泡生成,灵敏电流计指针向左偏转,左侧无明显变化。此时原电池中的总反应的化学方程式为
(5)由上述实验,
 与H2O2、
与H2O2、 与H2O2的氧化性强弱(填“>”或“<”):
与H2O2的氧化性强弱(填“>”或“<”):酸性条件下,


您最近一年使用:0次
2023-01-07更新
|
410次组卷
|
4卷引用:北京市顺义牛栏山第一中学2022-2023学年高二下学期3月月考化学试题
名校
解题方法
2 . 化学消毒剂能够有效阻断病毒的传播与扩散。本题中,将探讨2种常见的消毒剂:
Ⅰ.二氧化氯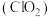 是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于
是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于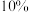 就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
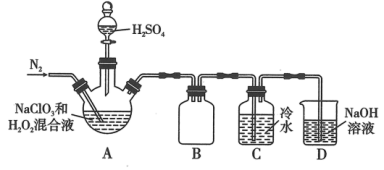
(1)某小组按照文献中制备 的方法设计了如图所示的实验装置用于制备
的方法设计了如图所示的实验装置用于制备 。
。_______ 。
②装置A中,装 溶液的仪器名称为
溶液的仪器名称为_______ 。
(2)测定装置 中
中 溶液的浓度:取
溶液的浓度:取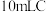 中溶液于锥形瓶中,加入足量的
中溶液于锥形瓶中,加入足量的 溶液和
溶液和 酸化(
酸化( ),然后加入
),然后加入_______ 作指示剂,用 的
的 标准液滴定锥形瓶中的溶液(
标准液滴定锥形瓶中的溶液(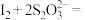 2I-+S4O
2I-+S4O ),当看到
),当看到_______ 现象时,测得标准液消耗的体积为 ,通过计算可知
,通过计算可知 中
中 溶液的浓度为
溶液的浓度为_______  。
。
Ⅱ.84消毒液在生活中有广泛的应用,其主要成分是 和
和 。
。
资料: 的电离常数
的电离常数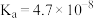 ;
; 的电离常数
的电离常数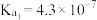 ,
,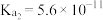 ;
; 的氧化性和杀菌消毒效果强于
的氧化性和杀菌消毒效果强于 。
。
(3)84消毒液溶液呈_______ (填“酸性”或“碱性”)。
(4)84消毒液可由氯气与 溶液反应制得。为了防止消毒液在存储过程中失效,通常要在84消毒液中残余一定量的
溶液反应制得。为了防止消毒液在存储过程中失效,通常要在84消毒液中残余一定量的 ,请运用平衡移动原理解释
,请运用平衡移动原理解释 的作用
的作用_______ 。
(5)待消杀物品喷洒上84消毒液后,露置于空气中10~30分钟可增强消毒效果,该过程中发生反应的离子方程式为_______ 。
Ⅰ.二氧化氯
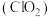 是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于
是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于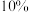 就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:(1)某小组按照文献中制备
 的方法设计了如图所示的实验装置用于制备
的方法设计了如图所示的实验装置用于制备 。
。
②装置A中,装
 溶液的仪器名称为
溶液的仪器名称为(2)测定装置
 中
中 溶液的浓度:取
溶液的浓度:取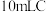 中溶液于锥形瓶中,加入足量的
中溶液于锥形瓶中,加入足量的 溶液和
溶液和 酸化(
酸化( ),然后加入
),然后加入 的
的 标准液滴定锥形瓶中的溶液(
标准液滴定锥形瓶中的溶液(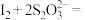 2I-+S4O
2I-+S4O ),当看到
),当看到 ,通过计算可知
,通过计算可知 中
中 溶液的浓度为
溶液的浓度为 。
。Ⅱ.84消毒液在生活中有广泛的应用,其主要成分是
 和
和 。
。资料:
 的电离常数
的电离常数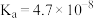 ;
; 的电离常数
的电离常数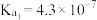 ,
,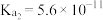 ;
; 的氧化性和杀菌消毒效果强于
的氧化性和杀菌消毒效果强于 。
。(3)84消毒液溶液呈
(4)84消毒液可由氯气与
 溶液反应制得。为了防止消毒液在存储过程中失效,通常要在84消毒液中残余一定量的
溶液反应制得。为了防止消毒液在存储过程中失效,通常要在84消毒液中残余一定量的 ,请运用平衡移动原理解释
,请运用平衡移动原理解释 的作用
的作用(5)待消杀物品喷洒上84消毒液后,露置于空气中10~30分钟可增强消毒效果,该过程中发生反应的离子方程式为
您最近一年使用:0次
2024-02-04更新
|
62次组卷
|
2卷引用:江苏省无锡市锡东高级中学2023-2024学年高二下学期5月月考化学试题
名校
3 . 某兴趣小组为探究浓硫酸与铜的反应,设计了如下装置。_______ 。
(2)为验证品红被 漂白的产物不稳定,简述操作步骤及现象
漂白的产物不稳定,简述操作步骤及现象_______ 。
(3)浸NaOH溶液的棉团作用是_______ 。
(4)为进一步探究 的还原性,将过量的
的还原性,将过量的 通入到200mL1.0mol/L的
通入到200mL1.0mol/L的 和过量
和过量 混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。
混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。 产生的原因进行探究(不考虑溶液中
产生的原因进行探究(不考虑溶液中 的影响)
的影响)
①查阅资料 不同浓度的 被还原的产物不同且产物不单一、不同pH时,
被还原的产物不同且产物不单一、不同pH时, 的氧化性不同。1.0mol/L的
的氧化性不同。1.0mol/L的 的
的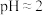 。
。
②提出猜想 猜想1: 被
被 氧化
氧化
猜想2: 在酸性条件下被
在酸性条件下被 氧化
氧化
猜想3:_______
③设计实验、验证猜想
限选实验试剂:0.01mol/LHCl、0.02mol/LHCl、3.0mol/LHNO3、6.0mol/LHNO3、3.0mol/LNaNO3、6.0mol/LNaNO3、0.1mol/LKSCN、 和
和 固体
固体
④交流讨论 小组同学认为,综合上述两个实验不足以证明猜想3成立。
⑤优化实验 若要证明猜想3成立,还要进行实验3。
实验3:_______ (只需提供设计思路,不需要写出具体操作步骤)。

(2)为验证品红被
 漂白的产物不稳定,简述操作步骤及现象
漂白的产物不稳定,简述操作步骤及现象(3)浸NaOH溶液的棉团作用是
(4)为进一步探究
 的还原性,将过量的
的还原性,将过量的 通入到200mL1.0mol/L的
通入到200mL1.0mol/L的 和过量
和过量 混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。
混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。
 产生的原因进行探究(不考虑溶液中
产生的原因进行探究(不考虑溶液中 的影响)
的影响)①查阅资料 不同浓度的
 被还原的产物不同且产物不单一、不同pH时,
被还原的产物不同且产物不单一、不同pH时, 的氧化性不同。1.0mol/L的
的氧化性不同。1.0mol/L的 的
的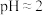 。
。②提出猜想 猜想1:
 被
被 氧化
氧化猜想2:
 在酸性条件下被
在酸性条件下被 氧化
氧化猜想3:
③设计实验、验证猜想
限选实验试剂:0.01mol/LHCl、0.02mol/LHCl、3.0mol/LHNO3、6.0mol/LHNO3、3.0mol/LNaNO3、6.0mol/LNaNO3、0.1mol/LKSCN、
 和
和 固体
固体| 实验步骤 | 实验现象和结论 |
| 实验1:取少量反应后的上层清液于试管中,滴入少量 | 出现 与 与 发生的离子方程式为 发生的离子方程式为 |
实验2:往图中的装置中加入100mL 固体,再通入过量 固体,再通入过量 。 。 | 出现白色沉淀,说明猜想2成立。 |
⑤优化实验 若要证明猜想3成立,还要进行实验3。
实验3:
您最近一年使用:0次
2022-04-29更新
|
1052次组卷
|
7卷引用:四川省泸州市古蔺县金兰高级中学校2022-2023学年高二下学期第一次月考化学试题
四川省泸州市古蔺县金兰高级中学校2022-2023学年高二下学期第一次月考化学试题2024届四川省攀枝花市第十五中学校高三上学期12月第7次半月考理科综合试题-高中化学广东省粤港澳大湾区普通高中2022届高三第二次模拟考试化学试题(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)湖南省郴州市永兴县第一中学2021-2022学年高三下学期期中考试化学试题热点1实验方案设计(已下线)化学-2023年高考押题预测卷03(广东卷)(含考试版、全解全析、参考答案、答题卡)
名校
解题方法
4 . 为探究FeCl3溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
(1)用pH计测得某FeCl3溶液的pH=0.70,加入下列试剂,能使该FeCl3溶液pH升高的是_______ 。
a.水 b. FeCl3固体 c.浓盐酸 d. NaHCO3固体
蒸发FeCl3溶液并灼烧最终得到的固体产物是_______ 。
(2)利用上述FeCl3溶液探究其与镁粉的反应原理。实验操作及现象如下表:
①用离子方程式解释现象b:_______ 。
②取少量反应后的溶液,滴入2滴_______ (写化学式)溶液,出现蓝色沉淀即可证明有Fe2+生成。写出生成Fe2+的离子方程式:_______ 。
(3)镁和FeCl3溶液反应后溶液中 浓度的测定
浓度的测定
i.将反应瓶中的溶液过滤并调节溶液的pH在6.5~10.5;
ii.取20.00mL滤液加水稀释至100ml
iii.另取稀释后滤液20.00ml,加入K2CrO4溶液作指示剂,用c AgNO3标准溶液滴定滤液中的
AgNO3标准溶液滴定滤液中的 至终点,重复操作3次,平均消耗AgNO3溶液VmL。已知Ag+与
至终点,重复操作3次,平均消耗AgNO3溶液VmL。已知Ag+与 生成砖红色沉淀指示滴定终点。
生成砖红色沉淀指示滴定终点。
①滴定时,盛装AgNO3标准溶液的滴定管应选用_______ (填玻璃仪器名称)。
②计算原滤液中 浓度为
浓度为_______ (用代数式表示)。
(4)探究FeCl3溶液与Na2SO3溶液发生氧化还原反应
查阅资料可知,Na2SO3具有还原性,FeCl3具有氧化性,可以设计成原电池。用下图装置(a、b均为石墨电极)进行实验。闭合开关后灵敏电流计指针偏转,电极a附近溶液颜色变浅
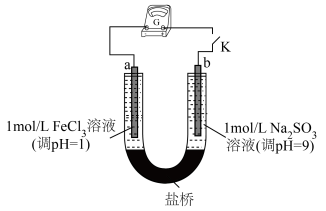
写出正极的电极反应式_______ 。一段时间后负极区pH_______ 9(填“<”、“=”、“>”)。
(1)用pH计测得某FeCl3溶液的pH=0.70,加入下列试剂,能使该FeCl3溶液pH升高的是
a.水 b. FeCl3固体 c.浓盐酸 d. NaHCO3固体
蒸发FeCl3溶液并灼烧最终得到的固体产物是
(2)利用上述FeCl3溶液探究其与镁粉的反应原理。实验操作及现象如下表:
| 操作 | 现象 |
| 先向反应瓶中注入50mL上述FeCl3溶液,再加入镁粉,搅拌。 | a.出现红褐色沉淀 b.有大量气泡 c.镁粉逐渐溶解、溶液变为浅绿色 |
②取少量反应后的溶液,滴入2滴
(3)镁和FeCl3溶液反应后溶液中
 浓度的测定
浓度的测定i.将反应瓶中的溶液过滤并调节溶液的pH在6.5~10.5;
ii.取20.00mL滤液加水稀释至100ml
iii.另取稀释后滤液20.00ml,加入K2CrO4溶液作指示剂,用c
 AgNO3标准溶液滴定滤液中的
AgNO3标准溶液滴定滤液中的 至终点,重复操作3次,平均消耗AgNO3溶液VmL。已知Ag+与
至终点,重复操作3次,平均消耗AgNO3溶液VmL。已知Ag+与 生成砖红色沉淀指示滴定终点。
生成砖红色沉淀指示滴定终点。①滴定时,盛装AgNO3标准溶液的滴定管应选用
②计算原滤液中
 浓度为
浓度为(4)探究FeCl3溶液与Na2SO3溶液发生氧化还原反应
查阅资料可知,Na2SO3具有还原性,FeCl3具有氧化性,可以设计成原电池。用下图装置(a、b均为石墨电极)进行实验。闭合开关后灵敏电流计指针偏转,电极a附近溶液颜色变浅

写出正极的电极反应式
您最近一年使用:0次
5 . 某研究小组利用如图装置(夹持装置略)制备氯气,并探究不同条件下氯气与二价锰化合物的反应。
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、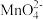 (绿色)、
(绿色)、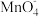 (紫色)
(紫色)
ii.浓碱条件下,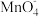 可被OH-还原为
可被OH-还原为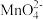
iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱
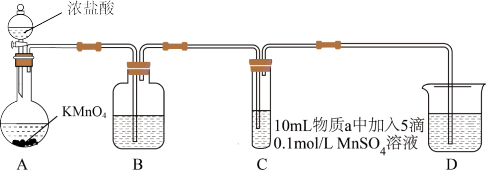
(1)盛装浓盐酸的仪器名称是____ ,为减缓生成Cl2的速率,可以采用的方法是____ 。
(2)B中试剂是____ 。
(3)D的作用是____ ,可选用的试剂____ (填标号)。
a.NaCl b.FeCl2 c.Na2SO3 d.NaOH e.H2SO4
(4)通入Cl2后,I中产生棕黑色沉淀的化学方程式为_____ 。
(5)对比实验I、II通入Cl2后的实验现象,可以得出的结论是:二价锰化合物的还原性____ 。
(6)根据资料ii,III中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将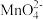 氧化为
氧化为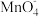
①用离子方程式表示可能导致溶液碱性减弱的原因____ ,但通过实验测定溶液的碱性变化很小。
②取III中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_____ ,溶液绿色缓慢加深,原因是MnO2被_____ (填“化学式”)氧化,可证明III的悬浊液中氧化剂过量。
③取III中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深的原因是____ 。
④从反应速率的角度,分析实验III未得到绿色溶液的可能原因____ 。
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、
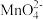 (绿色)、
(绿色)、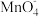 (紫色)
(紫色)ii.浓碱条件下,
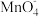 可被OH-还原为
可被OH-还原为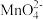
iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱

| 序号 | 物质a | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| I | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| II | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| III | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(2)B中试剂是
(3)D的作用是
a.NaCl b.FeCl2 c.Na2SO3 d.NaOH e.H2SO4
(4)通入Cl2后,I中产生棕黑色沉淀的化学方程式为
(5)对比实验I、II通入Cl2后的实验现象,可以得出的结论是:二价锰化合物的还原性
(6)根据资料ii,III中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将
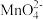 氧化为
氧化为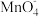
①用离子方程式表示可能导致溶液碱性减弱的原因
②取III中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③取III中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深的原因是
④从反应速率的角度,分析实验III未得到绿色溶液的可能原因
您最近一年使用:0次
名校
解题方法
6 . 实验小组探究 溶液与
溶液与 溶液的反应:
溶液的反应:
【资料】① 是强电解质,具有强氧化性。
是强电解质,具有强氧化性。 易被还原为
易被还原为 ;
;
② 可与
可与 发生反应:
发生反应:
③在溶液中 淀粉复合物必须有足够的浓度才能显示明显的蓝色
淀粉复合物必须有足够的浓度才能显示明显的蓝色
Ⅰ.实验小组设计了下列实验验证了 溶液与
溶液与 溶液的反应:
溶液的反应:
(1)实验1-1的目的是_______ 。
(2)请用离子方程式表示实验1-2中的化学反应_______ 。
Ⅱ.实验小组发现, 溶液中若含有
溶液中若含有 ,溶液并不会立刻变蓝,而会等待一段时间后再变蓝。为了解释这一现象,甲同学对此提出两种猜想:
,溶液并不会立刻变蓝,而会等待一段时间后再变蓝。为了解释这一现象,甲同学对此提出两种猜想:
猜想1:其他条件相同时, 与
与 反应速率_______
反应速率_______ 与
与 的反应速率,使溶液中
的反应速率,使溶液中 浓度降低,化学反应速率变慢。(填“
浓度降低,化学反应速率变慢。(填“ ”或“
”或“ ”)
”)
猜想2:其他条件相同时,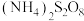 与
与 不反应。
不反应。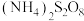 与
与 反应速率_______
反应速率_______ 与
与 的反应速率(填“
的反应速率(填“ ”或“
”或“ ”)。
”)。
(3)请补全猜想1:_______ 与猜想2:_______ 。
(4)根据资料2可知 的还原性
的还原性_______ (填“强于”或“弱于”) ,甲同学认为,该事实可以用来作为
,甲同学认为,该事实可以用来作为_______ (填“猜想1”或“猜想2”)的依据。
Ⅲ.为了进一步研究 的作用,小组同学分别向两支试管中依次加入下列试剂,并记录变他时间,如下表所示。
的作用,小组同学分别向两支试管中依次加入下列试剂,并记录变他时间,如下表所示。
(5)请补全表格中①_______ 与②_______
(6)乙同学根据现有数据证明Ⅱ中猜想1不成立,理由是_______ 。
Ⅳ.查阅文献表明Ⅱ中猜想2成立:
(7)下列说法正确的是_______(填字母)。
(8)结合实验2-2的数据,计算 内的
内的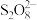 消耗的速率
消耗的速率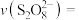
_______ 
 溶液与
溶液与 溶液的反应:
溶液的反应:【资料】①
 是强电解质,具有强氧化性。
是强电解质,具有强氧化性。 易被还原为
易被还原为 ;
;②
 可与
可与 发生反应:
发生反应:
③在溶液中
 淀粉复合物必须有足够的浓度才能显示明显的蓝色
淀粉复合物必须有足够的浓度才能显示明显的蓝色Ⅰ.实验小组设计了下列实验验证了
 溶液与
溶液与 溶液的反应:
溶液的反应:编号 | 1-1 | 1-2 |
实验操作 |
|
|
现象 | 无明显现象 | 溶液立即变蓝 |
(2)请用离子方程式表示实验1-2中的化学反应
Ⅱ.实验小组发现,
 溶液中若含有
溶液中若含有 ,溶液并不会立刻变蓝,而会等待一段时间后再变蓝。为了解释这一现象,甲同学对此提出两种猜想:
,溶液并不会立刻变蓝,而会等待一段时间后再变蓝。为了解释这一现象,甲同学对此提出两种猜想:猜想1:其他条件相同时,
 与
与 反应速率_______
反应速率_______ 与
与 的反应速率,使溶液中
的反应速率,使溶液中 浓度降低,化学反应速率变慢。(填“
浓度降低,化学反应速率变慢。(填“ ”或“
”或“ ”)
”)猜想2:其他条件相同时,
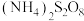 与
与 不反应。
不反应。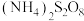 与
与 反应速率_______
反应速率_______ 与
与 的反应速率(填“
的反应速率(填“ ”或“
”或“ ”)。
”)。(3)请补全猜想1:
(4)根据资料2可知
 的还原性
的还原性 ,甲同学认为,该事实可以用来作为
,甲同学认为,该事实可以用来作为Ⅲ.为了进一步研究
 的作用,小组同学分别向两支试管中依次加入下列试剂,并记录变他时间,如下表所示。
的作用,小组同学分别向两支试管中依次加入下列试剂,并记录变他时间,如下表所示。编号 |
|
| 淀粉 溶液 |
| ① | 变色时间 |
2-1 |
|
| 2滴 |
| ② | 立即 |
2-2 |
|
| 2滴 |
|
|
|
(6)乙同学根据现有数据证明Ⅱ中猜想1不成立,理由是
Ⅳ.查阅文献表明Ⅱ中猜想2成立:
(7)下列说法正确的是_______(填字母)。
A.增加溶液中 浓度, 浓度, 的初始反应速率会增加 的初始反应速率会增加 |
B.增加溶液中 浓度,溶液变蓝时间可能增加 浓度,溶液变蓝时间可能增加 |
C.增加溶液中 浓度,溶液可能无法变蓝 浓度,溶液可能无法变蓝 |
| D.升高溶液温度,溶液开始变蓝时间可能增加 |
 内的
内的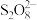 消耗的速率
消耗的速率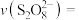

您最近一年使用:0次
名校
解题方法
7 . 某小组探究含 元素的化合物间的转化,进行如下实验。
元素的化合物间的转化,进行如下实验。
资料:
i.含 元素的常见粒子:
元素的常见粒子: (橙色)、
(橙色)、 (黄色)、
(黄色)、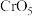 (溶于水,蓝紫色,不稳定)、
(溶于水,蓝紫色,不稳定)、 (绿色)、
(绿色)、 (蓝灰色,难溶于水,可溶于强酸、强碱)、
(蓝灰色,难溶于水,可溶于强酸、强碱)、 溶于强碱形成
溶于强碱形成 (亮绿色)。
(亮绿色)。
ii. 在碱性环境中比在酸性环境中分解速率快。
在碱性环境中比在酸性环境中分解速率快。
iii.在碱性环境中, 不能氧化
不能氧化 价格元素。
价格元素。
实验操作及现象如下:
(1)已知 (橙色)
(橙色)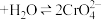 (黄色)
(黄色)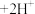 能说明该反应达平衡状态的是
能说明该反应达平衡状态的是_____ (填字母)。
A. 和
和 的浓度相同 B.
的浓度相同 B.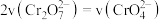 C.溶液的颜色不变
C.溶液的颜色不变
(2)已知 (橙色)
(橙色)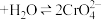 (黄色)
(黄色)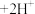 。请用化学平衡移动原理解释Ⅰ中滴入稀硫酸后溶液橙色加深的原因:
。请用化学平衡移动原理解释Ⅰ中滴入稀硫酸后溶液橙色加深的原因:_____ 。
(3)Ⅰ中,溶液由橙色变为绿色的总反应的离子方程式是_____ 。
(4)Ⅱ中,继续滴入 溶液后,又有气泡生成的原因是
溶液后,又有气泡生成的原因是_____ 。
(5)Ⅱ中,继续滴入 溶液后,预测有
溶液后,预测有 沉淀生成,但实验时未观察到。提出假设:在碱性环境中,
沉淀生成,但实验时未观察到。提出假设:在碱性环境中, 价铬元素被
价铬元素被 氧化。
氧化。
①甲同学设计实验证明假设成立:
取少量Ⅰ中的绿色溶液,在滴入 溶液前增加一步操作:
溶液前增加一步操作:_____ 。然后滴入 溶液,有蓝灰色沉淀生成,继续滴入
溶液,有蓝灰色沉淀生成,继续滴入 溶液,沉淀溶解,溶液变为
溶液,沉淀溶解,溶液变为_____ 色。
②乙同学通过原电池原理进一步研究碱性环境对 价铬元素的还原性或
价铬元素的还原性或 的氧化性的彩响,经过实验研究得出以下结论:酸性条件下,
的氧化性的彩响,经过实验研究得出以下结论:酸性条件下,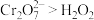 ;碱性条件下,
;碱性条件下,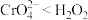
(6)此外,生产中常用 测定含
测定含 废水中
废水中 元素的含量。量取废水
元素的含量。量取废水 ,硫酸酸化后加入过量
,硫酸酸化后加入过量 溶液,发生反应:
溶液,发生反应: 。加入少量淀粉作为指示剂,用
。加入少量淀粉作为指示剂,用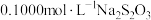 标准溶液滴定至终点,发生反应:
标准溶液滴定至终点,发生反应: 。平行滴定3次,平均消耗标准
。平行滴定3次,平均消耗标准 溶液
溶液 。则废水中
。则废水中 元素的含量为
元素的含量为_____  。
。
 元素的化合物间的转化,进行如下实验。
元素的化合物间的转化,进行如下实验。资料:
i.含
 元素的常见粒子:
元素的常见粒子: (橙色)、
(橙色)、 (黄色)、
(黄色)、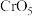 (溶于水,蓝紫色,不稳定)、
(溶于水,蓝紫色,不稳定)、 (绿色)、
(绿色)、 (蓝灰色,难溶于水,可溶于强酸、强碱)、
(蓝灰色,难溶于水,可溶于强酸、强碱)、 溶于强碱形成
溶于强碱形成 (亮绿色)。
(亮绿色)。ii.
 在碱性环境中比在酸性环境中分解速率快。
在碱性环境中比在酸性环境中分解速率快。iii.在碱性环境中,
 不能氧化
不能氧化 价格元素。
价格元素。实验操作及现象如下:
| 装置 | 步骤 | 操作 | 现象 |
2mL0.0125 K2Cr2O7溶液 | Ⅰ | 先滴入稀疏酸至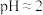 ,再滴入5滴 ,再滴入5滴 溶液,振荡 溶液,振荡 | 溶液橙色加深。滴入 溶液后迅速变为蓝紫色,有气泡生成。稍后,无明显气泡时,溶液由蓝紫色完全变为绿色 溶液后迅速变为蓝紫色,有气泡生成。稍后,无明显气泡时,溶液由蓝紫色完全变为绿色 |
| Ⅱ | 继续缓慢滴入10滴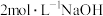 溶液,边滴,边振荡 溶液,边滴,边振荡 | 又有气泡生成,溶液最终变为黄色 |
(1)已知
 (橙色)
(橙色)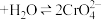 (黄色)
(黄色)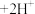 能说明该反应达平衡状态的是
能说明该反应达平衡状态的是A.
 和
和 的浓度相同 B.
的浓度相同 B.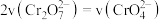 C.溶液的颜色不变
C.溶液的颜色不变(2)已知
 (橙色)
(橙色)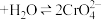 (黄色)
(黄色)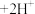 。请用化学平衡移动原理解释Ⅰ中滴入稀硫酸后溶液橙色加深的原因:
。请用化学平衡移动原理解释Ⅰ中滴入稀硫酸后溶液橙色加深的原因:(3)Ⅰ中,溶液由橙色变为绿色的总反应的离子方程式是
(4)Ⅱ中,继续滴入
 溶液后,又有气泡生成的原因是
溶液后,又有气泡生成的原因是(5)Ⅱ中,继续滴入
 溶液后,预测有
溶液后,预测有 沉淀生成,但实验时未观察到。提出假设:在碱性环境中,
沉淀生成,但实验时未观察到。提出假设:在碱性环境中, 价铬元素被
价铬元素被 氧化。
氧化。①甲同学设计实验证明假设成立:
取少量Ⅰ中的绿色溶液,在滴入
 溶液前增加一步操作:
溶液前增加一步操作: 溶液,有蓝灰色沉淀生成,继续滴入
溶液,有蓝灰色沉淀生成,继续滴入 溶液,沉淀溶解,溶液变为
溶液,沉淀溶解,溶液变为②乙同学通过原电池原理进一步研究碱性环境对
 价铬元素的还原性或
价铬元素的还原性或 的氧化性的彩响,经过实验研究得出以下结论:酸性条件下,
的氧化性的彩响,经过实验研究得出以下结论:酸性条件下,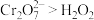 ;碱性条件下,
;碱性条件下,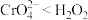
(6)此外,生产中常用
 测定含
测定含 废水中
废水中 元素的含量。量取废水
元素的含量。量取废水 ,硫酸酸化后加入过量
,硫酸酸化后加入过量 溶液,发生反应:
溶液,发生反应: 。加入少量淀粉作为指示剂,用
。加入少量淀粉作为指示剂,用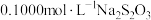 标准溶液滴定至终点,发生反应:
标准溶液滴定至终点,发生反应: 。平行滴定3次,平均消耗标准
。平行滴定3次,平均消耗标准 溶液
溶液 。则废水中
。则废水中 元素的含量为
元素的含量为 。
。
您最近一年使用:0次
8 . 研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验
已知:资料1: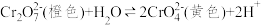
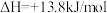 ;
;
资料2:+6价铬盐在一定条件下可被还原为 ,
, 在水溶液中为绿色。
在水溶液中为绿色。
(1)iii和i对比,推测iii的现象是____ 。
(2)ii和i对比,ii中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是 增大影响的结果;乙认为橙色加深一定是
增大影响的结果;乙认为橙色加深一定是 增大对平衡的影响。你认为是否需要再设计实验证明?
增大对平衡的影响。你认为是否需要再设计实验证明?____ (填“是”或“否”),理由是______ 。
(3)对比实验iv与v,可知:在______ 条件下,+6价 被还原为
被还原为______ ,其对应的离子方程式为________ 。
(4)为进一步确定铬(VI)盐溶液的氧化性与酸碱性的关系,某同学进行实验如下:
I.进行实验a和b:
用离子方程式解释a中现象:_______ 。
II.继续进行实验c:
为了说明产生上述现象的原因,补充实验d:向 蒸馏水中滴加
蒸馏水中滴加 的
的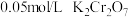 橙色溶液3滴,溶液变成浅橙色。
橙色溶液3滴,溶液变成浅橙色。
①补充实验d的目的是______ 。
②用化学平衡移动原理解释c中现象:_____ 。
③根据实验a~c,可推测: 溶液和铬(VI)盐溶液的反应与溶液酸碱性有关。
溶液和铬(VI)盐溶液的反应与溶液酸碱性有关。
a.碱性条件下, 溶液和铬(VI)盐溶液不发生氧化还原反应;
溶液和铬(VI)盐溶液不发生氧化还原反应;
b.______ 。
④向实验c所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测。该现象是_____ 。
| 系列 实验I | 装置 | 滴管中的试剂 | 试管中的试剂 | 操作 | 现象 |
| i |
|  水 水 | 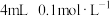  溶液 溶液 | 振荡 | 溶液颜色略微变浅 |
| ii | 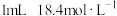 浓硫酸 浓硫酸 | 振荡 | 溶液橙色明显变深 | ||
| iii |  溶液 溶液 | 振荡 | ___________ | ||
| iv | 3滴浓 溶液 溶液 | iii中溶液 | 振荡 | 无明显现象 | |
| v | 过量稀硫酸 | iv中溶液 | 边滴边振荡 | 溶液颜色由黄色逐渐变橙色,最后呈绿色 |
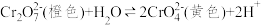
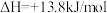 ;
;资料2:+6价铬盐在一定条件下可被还原为
 ,
, 在水溶液中为绿色。
在水溶液中为绿色。(1)iii和i对比,推测iii的现象是
(2)ii和i对比,ii中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是
 增大影响的结果;乙认为橙色加深一定是
增大影响的结果;乙认为橙色加深一定是 增大对平衡的影响。你认为是否需要再设计实验证明?
增大对平衡的影响。你认为是否需要再设计实验证明?(3)对比实验iv与v,可知:在
 被还原为
被还原为(4)为进一步确定铬(VI)盐溶液的氧化性与酸碱性的关系,某同学进行实验如下:
I.进行实验a和b:
| 序号 | 操作 | 现象 |
| a | 向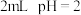 的 的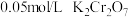 的橙色溶液中滴加饱和 的橙色溶液中滴加饱和 溶液( 溶液( 约为9)3滴 约为9)3滴 | 溶液变绿色 |
| b | 向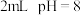 的 的 的 的 黄色溶液中滴加饱和 黄色溶液中滴加饱和 溶液3滴 溶液3滴 | 溶液没有明显变化 |
II.继续进行实验c:
| 序号 | 操作 | 现象 |
| c | 向 饱和 饱和 溶液中滴加 溶液中滴加 的 的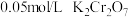 的橙色溶液3滴 的橙色溶液3滴 | 溶液变黄色 |
 蒸馏水中滴加
蒸馏水中滴加 的
的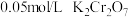 橙色溶液3滴,溶液变成浅橙色。
橙色溶液3滴,溶液变成浅橙色。①补充实验d的目的是
②用化学平衡移动原理解释c中现象:
③根据实验a~c,可推测:
 溶液和铬(VI)盐溶液的反应与溶液酸碱性有关。
溶液和铬(VI)盐溶液的反应与溶液酸碱性有关。a.碱性条件下,
 溶液和铬(VI)盐溶液不发生氧化还原反应;
溶液和铬(VI)盐溶液不发生氧化还原反应;b.
④向实验c所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测。该现象是
您最近一年使用:0次
名校
解题方法
9 . 水溶液广泛存在于生命体及其赖以生存的环境中,研究水溶液的性质及反应有重要意义。室温下,相关酸的电离平衡常数如下表所示:
回答下列问题。
(1) 的电离方程式是
的电离方程式是________________________ 。
(2)pH相同的 溶液和
溶液和 溶液,溶液的浓度
溶液,溶液的浓度
______ 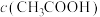 (填“<”“=”或“>”)。
(填“<”“=”或“>”)。
(3)室温下,用标准NaOH溶液滴定未知浓度的 溶液。
溶液。
①溶液中的
______ (填“增大”“减小”“不变”或“无法判断”)。
② 溶液显
溶液显______ (填“酸性”、“碱性”或“中性”),用离子方程式表示其原因:____________ 。
③当滴加NaOH溶液至溶液中的 ,此时溶液中的pH
,此时溶液中的pH______ 7(填“<”“=”或“>”),判断的依据__________________ 。
(4)84消毒液在生活中有广泛的应用,其主要成份是NaCl和NaClO。
资料:HClO的氧化性和杀菌消毒效果强于 。
。
①待消杀物品喷洒上84消毒液后,露置于空气中10~30分钟可增强消毒效果,该过程中发生反应的离子方程式为__________________ ,请结合电离平衡常数解释消毒效果增强的原因____________ 。
②为了防止消毒液在存储过程中失效,通常要在制备过程中使NaOH过量,请用平衡移动原理解释NaOH的作用__________________ 。
| 酸 |  |  | HClO |  |
电离平衡常数 |  | 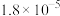 |  | 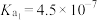  |
(1)
 的电离方程式是
的电离方程式是(2)pH相同的
 溶液和
溶液和 溶液,溶液的浓度
溶液,溶液的浓度
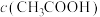 (填“<”“=”或“>”)。
(填“<”“=”或“>”)。(3)室温下,用标准NaOH溶液滴定未知浓度的
 溶液。
溶液。①溶液中的

②
 溶液显
溶液显③当滴加NaOH溶液至溶液中的
 ,此时溶液中的pH
,此时溶液中的pH(4)84消毒液在生活中有广泛的应用,其主要成份是NaCl和NaClO。
资料:HClO的氧化性和杀菌消毒效果强于
 。
。①待消杀物品喷洒上84消毒液后,露置于空气中10~30分钟可增强消毒效果,该过程中发生反应的离子方程式为
②为了防止消毒液在存储过程中失效,通常要在制备过程中使NaOH过量,请用平衡移动原理解释NaOH的作用
您最近一年使用:0次
名校
解题方法
10 . 某兴趣小组同学探究 溶液与草酸(
溶液与草酸( )溶液反应速率的影响因素。配制
)溶液反应速率的影响因素。配制 mol⋅L
mol⋅L
 溶液、0.40mol·L
溶液、0.40mol·L 草酸溶液。将
草酸溶液。将 溶液与草酸溶液按如下比例混合。
溶液与草酸溶液按如下比例混合。
【设计实验】
(1)表格中
_____ ,实验①和②的目的是_____ 。
(2)甲认为上述实验应控制pH相同,可加入的试剂是_____ (填序号)。
a.盐酸 b.硫酸 c.草酸
【实施实验】
小组同学将溶液pH调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:ⅰ。紫色溶液变为青色溶液,ⅱ。青色溶液逐渐褪至无色溶液。
资料:(a) 在溶液中无色,在草酸中不能形成配合物;
在溶液中无色,在草酸中不能形成配合物;
(b) 无色,有强氧化性,发生反应
无色,有强氧化性,发生反应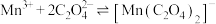 (青绿色)后氧化性减弱;
(青绿色)后氧化性减弱;
(c) 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。
(3)乙同学从氧化还原角度推测阶段ⅰ中可能产生了 。你认为该观点是否合理,并说明理由:
。你认为该观点是否合理,并说明理由:_____ 。
【继续探究】
进一步实验证明溶液中含有 ,反应过程中
,反应过程中 和
和 浓度随时间的变化如下图。
浓度随时间的变化如下图。

(4)第ⅰ阶段中检测到有 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为_____ 。
(5)实验②在第ⅱ阶段的反应速率较大,可能的原因是_____ 。
(6)为了验证上述(5)中说法,设计如下实验:在第ⅱ阶段将 调节至0.2mol/L,现象是
调节至0.2mol/L,现象是_____ ,由此现象可证明上述猜想合理。
【结论与反思】
(7)上述实验涉及的反应中,草酸的作用是_____ 。
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
 溶液与草酸(
溶液与草酸( )溶液反应速率的影响因素。配制
)溶液反应速率的影响因素。配制 mol⋅L
mol⋅L
 溶液、0.40mol·L
溶液、0.40mol·L 草酸溶液。将
草酸溶液。将 溶液与草酸溶液按如下比例混合。
溶液与草酸溶液按如下比例混合。【设计实验】
| 序号 |  /mL /mL | V(草酸)/mL |  /mL /mL | 反应温度/℃ |
| ① | 2.0 | 2.0 | 0 | 20 |
| ② | 2.0 | 1.0 | x | 20 |

(2)甲认为上述实验应控制pH相同,可加入的试剂是
a.盐酸 b.硫酸 c.草酸
【实施实验】
小组同学将溶液pH调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:ⅰ。紫色溶液变为青色溶液,ⅱ。青色溶液逐渐褪至无色溶液。
资料:(a)
 在溶液中无色,在草酸中不能形成配合物;
在溶液中无色,在草酸中不能形成配合物;(b)
 无色,有强氧化性,发生反应
无色,有强氧化性,发生反应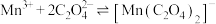 (青绿色)后氧化性减弱;
(青绿色)后氧化性减弱;(c)
 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。(3)乙同学从氧化还原角度推测阶段ⅰ中可能产生了
 。你认为该观点是否合理,并说明理由:
。你认为该观点是否合理,并说明理由:【继续探究】
进一步实验证明溶液中含有
 ,反应过程中
,反应过程中 和
和 浓度随时间的变化如下图。
浓度随时间的变化如下图。
(4)第ⅰ阶段中检测到有
 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为(5)实验②在第ⅱ阶段的反应速率较大,可能的原因是
(6)为了验证上述(5)中说法,设计如下实验:在第ⅱ阶段将
 调节至0.2mol/L,现象是
调节至0.2mol/L,现象是【结论与反思】
(7)上述实验涉及的反应中,草酸的作用是
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
您最近一年使用:0次