解题方法
1 . 资料显示: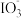 在酸性溶液中能氧化I-,反应为
在酸性溶液中能氧化I-,反应为 +5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
+5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
(1)甲同学对这一现象做出如下假设:t秒前生成了I2,但由于存在Na2SO3,I2被消耗,该反应的离子方程式为________ , 的还原性
的还原性________ I-(填“>”“=”或“<”)。
(2)为验证他的猜想,甲同学向反应后的蓝色溶液中加入________ ,蓝色迅速消失,随后再次变蓝。
(3)甲同学设计了如下实验,进一步研究Na2SO3溶液和KIO3溶液反应的过程。
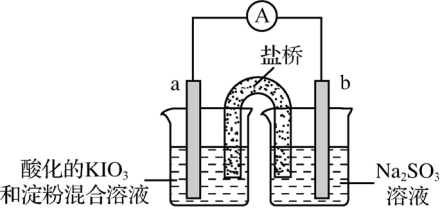
①甲同学在b电极附近的溶液中检测出了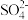
②刚开始放电时,a电极附近溶液未变蓝;取出a电极附近溶液于试管中,溶液变蓝。 在a极放电的产物是
在a极放电的产物是________ 。
③放电一段时间后,a电极附近溶液短暂出现蓝色,随即消失,重复多次后,蓝色不再褪去。电流表显示电路中时而出现电流,时而归零,最终电流消失。电流表短暂归零的原因是________ 。
④下列说法正确的是________ 。
a. a电极附近蓝色不再褪去时, 尚未完全氧化
尚未完全氧化
b. a电极附近短暂出现蓝色,随即消失的原因可能是因为I2被 还原
还原
c. 电流消失后,向b电极附近加入过量Na2SO3溶液,重新产生电流,a电极附近蓝色褪去
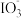 在酸性溶液中能氧化I-,反应为
在酸性溶液中能氧化I-,反应为 +5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
+5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。(1)甲同学对这一现象做出如下假设:t秒前生成了I2,但由于存在Na2SO3,I2被消耗,该反应的离子方程式为
 的还原性
的还原性(2)为验证他的猜想,甲同学向反应后的蓝色溶液中加入
(3)甲同学设计了如下实验,进一步研究Na2SO3溶液和KIO3溶液反应的过程。

①甲同学在b电极附近的溶液中检测出了
②刚开始放电时,a电极附近溶液未变蓝;取出a电极附近溶液于试管中,溶液变蓝。
 在a极放电的产物是
在a极放电的产物是③放电一段时间后,a电极附近溶液短暂出现蓝色,随即消失,重复多次后,蓝色不再褪去。电流表显示电路中时而出现电流,时而归零,最终电流消失。电流表短暂归零的原因是
④下列说法正确的是
a. a电极附近蓝色不再褪去时,
 尚未完全氧化
尚未完全氧化b. a电极附近短暂出现蓝色,随即消失的原因可能是因为I2被
 还原
还原c. 电流消失后,向b电极附近加入过量Na2SO3溶液,重新产生电流,a电极附近蓝色褪去
您最近一年使用:0次
2022高二·上海·专题练习
2 . 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
(1)催化剂能加快化学反应速率的原因是______________________________________ 。
(2)实验①和②的目的是__________________________________ 。
实验时由于没有观察到明显现象而无法得出结论,资料显示,通常条件下H2O2较稳定,不易分解,为了达到实验目的,你对原实验方案的改进是_______________________ 。
(3)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。
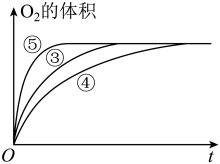
分析上图能够得出的实验结论是______________________ 。
| 实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(2)实验①和②的目的是
实验时由于没有观察到明显现象而无法得出结论,资料显示,通常条件下H2O2较稳定,不易分解,为了达到实验目的,你对原实验方案的改进是
(3)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。

分析上图能够得出的实验结论是
您最近一年使用:0次
名校
3 . 氧化剂 在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。某实验小组以
在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。某实验小组以 分解为例,探究浓度、催化剂、温度对反应速率的影响。在常温下按照下表所示的方案完成实验。
分解为例,探究浓度、催化剂、温度对反应速率的影响。在常温下按照下表所示的方案完成实验。
(1)实验①和②的目的是___________ 。同学甲在进行实验①和②时并没有观察到明显现象。资料显示,通常条件下过氧化氢稳定,不易分解。为了达到实验目的,可采取的改进方法是___________ (写出一种即可)。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如甲图所示。分析该图能得出的结论是___________ ,___________ ;
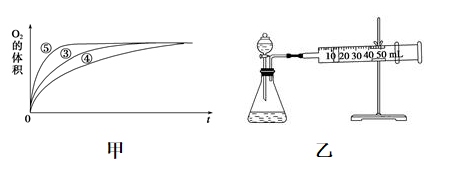
(3)同学乙设计了乙图所示的实验装置对过氧化氢的分解速率进行定量分析,以生成20 气体为准,其他影响实验的因素均已忽略。实验中需要测量的数据是
气体为准,其他影响实验的因素均已忽略。实验中需要测量的数据是___________ 。
(4)向某体积固定的密闭容器中加入0.6 A、0.2
A、0.2 C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
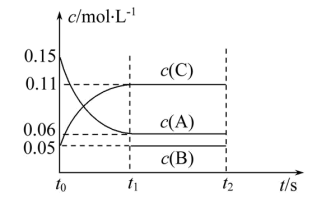
①写出反应的化学方程式:___________ ;
②若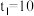 ,则
,则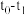 内反应速率
内反应速率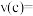
___________ ,A的转化率为___________ ;
③B的起始的物质的量是___________ ;平衡时体系内的压强为初始状态的___________ 倍。
 在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。某实验小组以
在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。某实验小组以 分解为例,探究浓度、催化剂、温度对反应速率的影响。在常温下按照下表所示的方案完成实验。
分解为例,探究浓度、催化剂、温度对反应速率的影响。在常温下按照下表所示的方案完成实验。| 实验编号 | 温度(℃) | 反应物 | 催化剂 |
| ① | 20 | 25 3% 3% 溶液 溶液 | 无 |
| ② | 20 | 25 5% 5% 溶液 溶液 | 无 |
| ③ | 20 | 25 5% 5% 溶液 溶液 | 0.1g |
| ④ | 20 | 25 5% 5% 溶液 溶液 | 1~2滴1  溶液 溶液 |
| ⑤ | 30 | 25 5% 5% 溶液 溶液 | 0.1g |
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如甲图所示。分析该图能得出的结论是

(3)同学乙设计了乙图所示的实验装置对过氧化氢的分解速率进行定量分析,以生成20
 气体为准,其他影响实验的因素均已忽略。实验中需要测量的数据是
气体为准,其他影响实验的因素均已忽略。实验中需要测量的数据是(4)向某体积固定的密闭容器中加入0.6
 A、0.2
A、0.2 C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
①写出反应的化学方程式:
②若
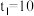 ,则
,则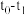 内反应速率
内反应速率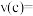
③B的起始的物质的量是
您最近一年使用:0次
2021-07-01更新
|
3452次组卷
|
8卷引用:第06讲 影响化学反应速率的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)
(已下线)第06讲 影响化学反应速率的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)(已下线)2.1.2 影响化学反应速率的因素-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)2.1.2 影响化学反应速率的因素-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)海南省华中师范大学海南附属中学2021-2022学年高二上学期第一次月考化学试题(已下线)6.1.2 化学反应速率(第2课时 影响化学反应速率的因素)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)(已下线)第13讲 第二章《化学反应速率与化学平衡》单元测试(培优提升)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)江西省永修县第一中学2023-2024学年高二上学期开学考试化学试题江西省抚州市2020-2021学年高一下学期期末考试化学试题
名校
解题方法
4 . 为检验淀粉水解的情况,进行如下图所示的实验,试管甲和丙均用60~80 ℃的水浴加热5~6 min,试管乙不加热。待试管甲、丙中的溶液冷却后再进行后续实验。
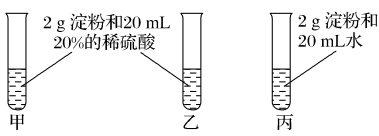
实验1:取少量甲中溶液,加入新制氢氧化铜,加热,没有红色沉淀出现。
实验2:取少量乙中溶液,滴加几滴碘水,溶液变为蓝色,但取少量甲中溶液做此实验时,溶液不变蓝色。
实验3:取少量丙中溶液加入NaOH溶液调节至碱性,再滴加碘水,溶液颜色无明显变化。
(1)写出淀粉水解的化学方程式:___________ 。
(2)设计甲和乙是为了探究___________ 对淀粉水解的影响,设计甲和丙是为了探究___________ 对淀粉水解的影响。
(3)实验1失败的原因是___________ 。
(4)实验3中溶液的颜色无明显变化的原因是___________ 。
(5)下列结论合理的是___________(填字母)。

实验1:取少量甲中溶液,加入新制氢氧化铜,加热,没有红色沉淀出现。
实验2:取少量乙中溶液,滴加几滴碘水,溶液变为蓝色,但取少量甲中溶液做此实验时,溶液不变蓝色。
实验3:取少量丙中溶液加入NaOH溶液调节至碱性,再滴加碘水,溶液颜色无明显变化。
(1)写出淀粉水解的化学方程式:
(2)设计甲和乙是为了探究
(3)实验1失败的原因是
(4)实验3中溶液的颜色无明显变化的原因是
(5)下列结论合理的是___________(填字母)。
| A.淀粉水解需要在催化剂和一定温度下进行 |
| B.欲检验淀粉是否完全水解,最好在冷却后的水解液中直接加碘 |
| C.欲检验淀粉的水解产物具有还原性,应先在水解液中加入氢氧化钠中和稀硫酸至溶液呈碱性,再加入新制氢氧化铜并加热 |
| D.若用唾液代替稀硫酸,则实验1可能出现预期的现象 |
您最近一年使用:0次
2021-11-30更新
|
712次组卷
|
15卷引用:2018年5月29日 淀粉水解程度的判断及水解产物的检验——《每日一题》2017-2018学年高二化学人教选修5
(已下线)2018年5月29日 淀粉水解程度的判断及水解产物的检验——《每日一题》2017-2018学年高二化学人教选修5(已下线)2019年5月14日 《每日一题》人教选修5—— 淀粉水解程度的判断及水解产物的检验江西省高安中学2017-2018学年高二1月月考化学试题广东省蕉岭县蕉岭中学2018-2019学年高二下学期第三次月考化学试题(已下线)2019年10月30日 《每日一题》2020年高考一轮复习-淀粉水解程度的判断及水解产物的检验高二选择性必修3(人教版2019)第四章 生物大分子 第一节 糖类(已下线)专题09 常见有机物及其应用——备战2021年高考化学纠错笔记(已下线)4.1 糖类(C级检测练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修3)(已下线)4.2 糖类(C级检测练)-2020-2021学年高二化学章节分层检测ABC(人教版选修5)福建省莆田市2020-2021学年高二下学期第二次月考化学(B卷) 试题河北省石家庄市藁城新冀明中学2020-2021学年高二下学期5月月考化学试题(已下线)专题08 常见有机物及其应用-备战2022年高考化学学霸纠错(全国通用)专题6 生命活动的物质基础——糖类、油脂、蛋白质 第一单元 糖类和油脂 第1课时 糖类6.1.1糖类 课后2015届北京市海淀区高三4月模拟练习化学试卷
10-11高二上·江西上饶·期中
名校
5 . 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O,学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
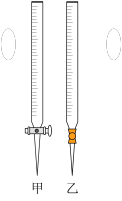
(1)滴定时,将酸性KMnO4标准液装在如图中的________ (填“甲”或“乙”)滴定管中。
(2)本实验滴定达到终点的标志是___________________ 。
(3)通过上述数据,求得x=________ 。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会________ (填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________ 。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
(1)滴定时,将酸性KMnO4标准液装在如图中的

(2)本实验滴定达到终点的标志是
(3)通过上述数据,求得x=
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会
您最近一年使用:0次
2019-11-19更新
|
764次组卷
|
30卷引用:2019年1月2日 《每日一题》人教选修4-酸碱中和滴定
(已下线)2019年1月2日 《每日一题》人教选修4-酸碱中和滴定(已下线)2019年12月27日 《每日一题》人教版(选修4)——酸碱中和滴定(已下线)高中化学《新教材变化解读与考法剖析》第三章 水溶液中的离子反应与平衡(人教版2019选择性必修1)(已下线)2010年江西省德兴市四校联考高二上学期期中考试化学试卷(已下线)2011-2012学年山东省济宁市曲阜一中高二上学期期末模拟化学试卷(已下线)2011-2012学年福建省罗源一中高二上学期期末考试化学试卷2014-2015浙江省杭州市西湖中学高二12月月考化学试卷2014-2015学年浙江省江山实验中学高二4月教学质量检测化学试卷2015-2016学年山西省太原五中高二上12月月考化学试卷12015-2016学年山西省太原五中高二上12月月考化学试卷22015-2016学年福建省长泰县第一中学高二上学期期末化学试卷2015-2016学年河南省南阳一中高二下期末模拟化学试卷广西桂林市第十八中学2016-2017学年高二下学期期中考试化学试题湖北省荆门市2016-2017学年高二下学期期末质量检测化学试题河南省豫北重点中学2017-2018学年高二12月联考化学试题【全国百强校】贵州省思南中学2018-2019学年高二上学期第二次月考化学试题陕西省黄陵中学2018-2019学年高二(普通班)上学期期末考试化学试题步步为赢 高二化学暑假作业:作业十 水溶液中的离子平衡浙江省宁波市北仑中学2019-2020学年高二上学期期中考试化学(2-10班)试题江苏省宿豫中学2019-2020学年度高二下学期调研测试(奥赛班)化学试题广西桂林市第十八中学2019-2020学年高二下学期开学考试化学试题四川省成都市第七中学2019-2020学年高二下学期零诊模拟考试化学人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 易错疑难集训(二)辽宁省沈阳市第八十三中学2021-2022学年高二上学期期初考试化学试题江西省抚州市南城县第二中学2021-2022年高二上学期第二次月考化学试题云南省玉溪市通海县第一中学2021-2022学年高二上学期期末考试化学试题河北省保定市博野中学2021-2022学年高二上学期期中考试化学试题河南省温县第一高级中学2022-2023学年高二上学期第二次月考化学试题河南省鹤壁市高中2022-2023学年高二上学期10月居家测试化学(宏奥班)试题河南省南阳市第一中学校2023-2024学年高二上学期12月月考化学试题
2022高二·全国·专题练习
6 . 关于葡萄糖的叙述中正确的是
| A.它是果糖的同系物 |
| B.葡萄糖在人体内发生还原反应,释放能量 |
| C.葡萄糖既有还原性又有氧化性 |
| D.葡萄糖水解为乙醇和二氧化碳 |
您最近一年使用:0次
2022高二·全国·专题练习
7 . 已知
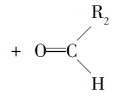
(1)该反应的生成物中含有的官能团的名称是_______ ,在一定条件下能发生_______ (填序号)。
①银镜反应 ②酯化反应 ③还原反应
(2)某氯代烃A的分子式为C6H11Cl,它可以发生如下转化:
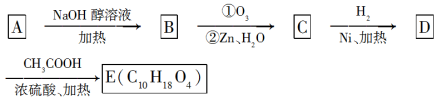
结构分析表明E分子中含有两个甲基且没有支链。
试回答:
①有关C的说法正确的是_______ 。
a.分子式为C6H10O2
b.C属于醛类,且1 mol C与足量新制的Cu(OH)2反应可得4 mol Cu2O
c.C具有氧化性,也具有还原性
d.由D催化氧化可以得到C
②写出C与足量银氨溶液反应的化学方程式:_______ 。
③写出下列转化关系的化学方程式,并指出反应类型。
A→B:_______ ,_______ ;
D→E:_______ ,_______ 。


(1)该反应的生成物中含有的官能团的名称是
①银镜反应 ②酯化反应 ③还原反应
(2)某氯代烃A的分子式为C6H11Cl,它可以发生如下转化:

结构分析表明E分子中含有两个甲基且没有支链。
试回答:
①有关C的说法正确的是
a.分子式为C6H10O2
b.C属于醛类,且1 mol C与足量新制的Cu(OH)2反应可得4 mol Cu2O
c.C具有氧化性,也具有还原性
d.由D催化氧化可以得到C
②写出C与足量银氨溶液反应的化学方程式:
③写出下列转化关系的化学方程式,并指出反应类型。
A→B:
D→E:
您最近一年使用:0次
名校
8 . 下列有关说法正确的是
①生产熔喷布口罩的原料聚丙烯是纯净物,在“新冠战疫”中发挥了重要作用
②明矾溶于水可水解生成Al(OH)3胶体,因此可用明矾对自来水进行杀菌消毒
③分解、电解、潮解、裂解都是化学变化
④胶体与其他分散系的本质区别是分散质粒子直径的大小
⑤淀粉、蛋白质、纤维素、油脂都是高分子化合物,氨水、王水、双氧水都是混合物
⑥元素处在最高价态时只有强氧化性,最低价态时只有强还原性
⑦CO2、NH3的水溶液能导电,所以CO2、NH3均是电解质
①生产熔喷布口罩的原料聚丙烯是纯净物,在“新冠战疫”中发挥了重要作用
②明矾溶于水可水解生成Al(OH)3胶体,因此可用明矾对自来水进行杀菌消毒
③分解、电解、潮解、裂解都是化学变化
④胶体与其他分散系的本质区别是分散质粒子直径的大小
⑤淀粉、蛋白质、纤维素、油脂都是高分子化合物,氨水、王水、双氧水都是混合物
⑥元素处在最高价态时只有强氧化性,最低价态时只有强还原性
⑦CO2、NH3的水溶液能导电,所以CO2、NH3均是电解质
| A.1个 | B.2个 | C.3个 | D.4个 |
您最近一年使用:0次
2021-08-07更新
|
1490次组卷
|
9卷引用:第四单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修3)
(已下线)第四单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修3)(已下线)专题03 化学基本概念-2022年高考化学二轮复习重点专题常考点突破练(已下线)【知识图鉴】单元讲练测选择性必修3第4单元03巩固练福建省莆田二中、泉州一中、南安一中三校2020-2021学年高三下学期联考化学试题辽宁省调兵山市第二高级中学2021-2022学年高三上学期第一次考试化学试题湖北省仙桃市沔城高级中学2021-2022学年高三上学期10月月考化学试题辽宁省东北育才学校高中部高三2021-2022下学期开学初第六次模拟考试化学试题湖南省隆回县第二中学2021-2022学年高三上学期第四次月考化学试题广东省湛江市第二十一中学2021—2022学年高三上学期11月月考化学试题
名校
解题方法
9 . 生产、生活中产生的废水、废气是环境污染的重要源头。在环境治理方面人们可利用I2O5和Na2SO3等化工产品实现对废水和废气的治理。
(1)利用I2O5的氧化性处理废气H2S,得到S、I2两种单质,发生反应的化学方程式为________ 。
(2)利用I2O5也可消除CO的污染,其反应原理为I2O5(s)+5CO(g) 5CO2(g)+I2(s) ΔH 。 已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
5CO2(g)+I2(s) ΔH 。 已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
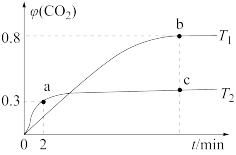
①温度为T2时,0~2 min 内,CO2的平均反应速率υ(CO2)=________ 。
②b点时CO的转化率为__________ ,化学反应的平衡常数K=_______ (填表达式)。
③反应:I2O5(s)+5CO(g) 5CO2(g)+I2(s)的ΔH
5CO2(g)+I2(s)的ΔH______ 0(填“>”“<”或“=”)。
④上述反应在T1下达到平衡时,再向容器中充入物质的量均为2 mol的CO和CO2气体,则化学平衡________ (填“向左”“向右”或“不”)移动。
⑤下列现象,可以表示上述反应达到平衡状态的是________ (填字母)。
A.容器内的压强不再变化
B.单位时间内消耗CO和生成CO2的物质的量之比为1∶1
C.混合气的密度不再变化
D.混合气的平均相对分子质量不再变化
(3)Na2SO3具有还原性,其水溶液可以吸收Cl2(g),减少环境污染。
已知反应:①Na2SO3(aq)+Cl2(g)+H2O(l) =Na2SO4(aq)+2HCl(aq) ΔH1=a kJ·mol−1
②Cl2(g)+H2O(l) =HCl(aq)+HClO(aq) ΔH2=b kJ·mol−1
试写出Na2SO3(aq)与HClO(aq)反应的热化学方程式:___________ 。
(1)利用I2O5的氧化性处理废气H2S,得到S、I2两种单质,发生反应的化学方程式为
(2)利用I2O5也可消除CO的污染,其反应原理为I2O5(s)+5CO(g)
 5CO2(g)+I2(s) ΔH 。 已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
5CO2(g)+I2(s) ΔH 。 已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
①温度为T2时,0~2 min 内,CO2的平均反应速率υ(CO2)=
②b点时CO的转化率为
③反应:I2O5(s)+5CO(g)
 5CO2(g)+I2(s)的ΔH
5CO2(g)+I2(s)的ΔH④上述反应在T1下达到平衡时,再向容器中充入物质的量均为2 mol的CO和CO2气体,则化学平衡
⑤下列现象,可以表示上述反应达到平衡状态的是
A.容器内的压强不再变化
B.单位时间内消耗CO和生成CO2的物质的量之比为1∶1
C.混合气的密度不再变化
D.混合气的平均相对分子质量不再变化
(3)Na2SO3具有还原性,其水溶液可以吸收Cl2(g),减少环境污染。
已知反应:①Na2SO3(aq)+Cl2(g)+H2O(l) =Na2SO4(aq)+2HCl(aq) ΔH1=a kJ·mol−1
②Cl2(g)+H2O(l) =HCl(aq)+HClO(aq) ΔH2=b kJ·mol−1
试写出Na2SO3(aq)与HClO(aq)反应的热化学方程式:
您最近一年使用:0次
2020-11-25更新
|
165次组卷
|
6卷引用:2018年9月29日《每日一题》人教选修4-周末培优
2019高二下·全国·专题练习
10 . 甲、乙、丙、丁4种分子中均含有18个电子,分子中都含有2种或3种元素,甲气体溶于水后,长时间放置于空气中有固体析出。下列推断合理的是
| A.将甲气体通入烧碱溶液中,反应后只可能生成一种盐 |
| B.乙和甲中同种元素的质量分数相等,则乙既有氧化性,又有还原性 |
| C.丙与氧气的摩尔质量相同,则丙一定只含有极性键 |
| D.丁中含有第2周期ⅣA族元素,则丁一定是甲烷的同系物 |
您最近一年使用:0次



