名校
解题方法
1 . 下列分子中的中心原子杂化轨道的类型相同的是
| A.CO2与SO2 | B.CH4与NH3 |
| C.BeCl2与BF3 | D.C2H6与C2H2 |
您最近一年使用:0次
2022-11-30更新
|
1160次组卷
|
24卷引用:吉林省长春市榆树高级中学2020-2021学年高二下学期期中考试化学试题
吉林省长春市榆树高级中学2020-2021学年高二下学期期中考试化学试题吉林省通化市通化县综合高级中学2019-2020学年高二下学期期中考试化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第二节 分子的空间结构(人教版2019)选择性必修2 第二章 分子结构与性质 学科素养提升鲁科版2019选择性必修2第2章 微粒间相互作用与物质性质 第2章学科素养提升(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第2节 共价键与分子的空间结构高二选择性必修2(人教版2019)第二章 分子结构与性质 第二节 分子的空间结构 课时2 杂化轨道理论(已下线)2.2.1 分子空间结构的理论分析-2020-2021学年高二化学课时同步练(鲁科2019选择性必修2)福建省莆田第二十五中学2020-2021学年高二下学期第一次月考化学试题黑龙江省齐齐哈尔市第一中学2020-2021学年高二下学期4月月考化学试题新疆维吾尔自治区乌鲁木齐市第四中学2020-2021学年高二年级下学期期中考试化学试题福建省福州市金山中学2020-2021学年高二下期中考试化学试题四川省成都市蒲江县蒲江中学2020-2021学年高二3月月考化学试题福建省福州市格致中学2018-2019学年高二下学期期中考试化学试题福建省南安市侨光中学2019-2020学年高二下学期第一次阶段考化学试题河北省衡水市桃城区第十四中学2019-2020学年高二下学期摸底考试化学试题新疆生产建设兵团第四师第一中学2019-2020学年高二下学期期中考试化学试题江苏省盐城市东台市创新学校2019-2020学年高二下学期5月份月检测化学试题内蒙古赤峰市元宝山区第一中学2021-2022学年高二下学期4月月考化学试题专题4 分子空间结构与物质性质 第一单元 分子的空间结构 第1课时 分子的空间结构模型第二节 分子的空间结构 第2课时 杂化轨道理论四川省江油中学2022-2023学年高二上学期期中测试化学试题(已下线)2.2 分子空间结构-同步学习必备知识4.1.1杂化轨道理论 课中
名校
解题方法
2 . 氯的含氧酸根离子有ClO-、ClO 、ClO
、ClO 、ClO
、ClO 等,有关它们的下列说法正确的是
等,有关它们的下列说法正确的是
 、ClO
、ClO 、ClO
、ClO 等,有关它们的下列说法正确的是
等,有关它们的下列说法正确的是| A.ClO-中氯元素显+1价,具有很强的还原性 |
B.这些离子结合H+的能力,ClO 最强 最强 |
C.ClO 是NO 是NO 的等电子体,其空间构型为平面三角形 的等电子体,其空间构型为平面三角形 |
D.ClO 、ClO 、ClO 、ClO 、ClO 中的氯原子都采取sp3杂化,离子中相邻两个Cl−O键间键角依次增大 中的氯原子都采取sp3杂化,离子中相邻两个Cl−O键间键角依次增大 |
您最近一年使用:0次
2021-08-24更新
|
162次组卷
|
2卷引用:吉林省延边第二中学2020-2021学年高二下学期第一次考试月考化学试题
名校
解题方法
3 . (NH4)2Fe(SO4)2·6H2O,俗名为莫尔盐,是一种重要的化工原料,可用于医药、冶金、电镀等。回答下列问题:
(1)NH 离子中N的
离子中N的_______ 轨道与H的s轨道重叠形成σ键; 的空间构型为
的空间构型为_______ ,其O-S-O的键角比 中O-S-O的键角
中O-S-O的键角_______ (填“大”或“小”)。
(2)Fe与S形成的一种化合物晶体的晶胞结构及其纵向投影如图所示,该物质的化学式为_______ 。已知:晶体密度为ρg/cm3,阿伏加德罗常数的值为NA,晶胞六棱柱底面边长为apm,则该晶胞的高c=_______ pm(列出计算式)。

(1)NH
 离子中N的
离子中N的 的空间构型为
的空间构型为 中O-S-O的键角
中O-S-O的键角(2)Fe与S形成的一种化合物晶体的晶胞结构及其纵向投影如图所示,该物质的化学式为

您最近一年使用:0次
名校
4 . 三价铬离子( )是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、HO、N、S、Cr等。回答下列问题:
)是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、HO、N、S、Cr等。回答下列问题:
(1)Cr的价层电子排布式为_______ 。
(2)O、N、S的原子半径由大到小的顺序为_______ 。
(3) 分子的 VSEPR模型名称为
分子的 VSEPR模型名称为_______ ,其中心原子的杂化方式为_______ 。
(4)化学式为 的化合物有多种结构,其中一种可表示为
的化合物有多种结构,其中一种可表示为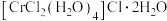 ,该物质的配离子中提供孤电子对的原子为
,该物质的配离子中提供孤电子对的原子为_______ ,配位数为_______ 。
(5) 分子可以与
分子可以与 结合生成
结合生成 ,这个过程发生改变的是
,这个过程发生改变的是_______ (填序号)。
a.微粒的空间结构 b.N原子的杂化类型 c.H-N-H键角 d.微粒的电子数
 )是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、HO、N、S、Cr等。回答下列问题:
)是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、HO、N、S、Cr等。回答下列问题:(1)Cr的价层电子排布式为
(2)O、N、S的原子半径由大到小的顺序为
(3)
 分子的 VSEPR模型名称为
分子的 VSEPR模型名称为(4)化学式为
 的化合物有多种结构,其中一种可表示为
的化合物有多种结构,其中一种可表示为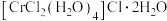 ,该物质的配离子中提供孤电子对的原子为
,该物质的配离子中提供孤电子对的原子为(5)
 分子可以与
分子可以与 结合生成
结合生成 ,这个过程发生改变的是
,这个过程发生改变的是a.微粒的空间结构 b.N原子的杂化类型 c.H-N-H键角 d.微粒的电子数
您最近一年使用:0次
2021-06-19更新
|
194次组卷
|
2卷引用:吉林省汪清四中2020-2021学年高二下学期第二阶段考试化学试题
名校
5 . 钙铜合金可用作电解法制备金属钙的阴极电极材料。回答下列问题:
(1)铜在元素周期表中位于_____ (填“s”、“p”、“d”或“ds”)区。
(2)基态Ca原子的价电子排布式为_____ 。Co与Ca位于同一周期,且最外层电子数相同,但金属Co的熔点、沸点均比金属Ca的高的原因是______ 。
(3)硫酸铜稀溶液呈蓝色,则硫酸铜稀溶液中不存在的作用力有____ (填标号),其中硫酸根的空间构型为_____ 。
A.配位键 B.金属键 C.共价键 D.氢键
(1)铜在元素周期表中位于
(2)基态Ca原子的价电子排布式为
(3)硫酸铜稀溶液呈蓝色,则硫酸铜稀溶液中不存在的作用力有
A.配位键 B.金属键 C.共价键 D.氢键
您最近一年使用:0次
6 . 已知A、B、C、D、E代表五种元素。A元素的三价离子3d能级处于半充满;B元素原子的最外层电子数是内层电子总数的2倍;C的原子轨道中有2个未成对的电子,且与B可形成两种常见的气体;D的原子序数小于A,D与C可形成DC2和DC3两种分子,且DC2是极性分子,DC3是非极性分子;E是短周期元素中除了稀有气体外原子半径最大的元素。试回答下列问题:
(1)写出A元素基态原子的价层电子排布图___ 。
(2)B、C、D三种元素的电负性由大到小的顺序为___ (写元素符号)。
(3)E与C以1:1形成的物质的电子式为___ 。该物质与BC2反应的化学方程式为___ 。
(4)用电子式表示BC2形成过程___ 。
(5)E元素焰色反应的原因是___ 。
(6)用VSEPR理论判断DC3分子的空间立体结构为___ 。
(7)上述元素中第一电离能最大的元素是___ (填元素符号)。
(1)写出A元素基态原子的价层电子排布图
(2)B、C、D三种元素的电负性由大到小的顺序为
(3)E与C以1:1形成的物质的电子式为
(4)用电子式表示BC2形成过程
(5)E元素焰色反应的原因是
(6)用VSEPR理论判断DC3分子的空间立体结构为
(7)上述元素中第一电离能最大的元素是
您最近一年使用:0次
7 . 以下分子或离子的结构为正四面体形且键与键夹角为109°28′的是
①CH4 ②SiCl4 ③CH3Cl ④P4
①CH4 ②SiCl4 ③CH3Cl ④P4
| A.①②④ | B.①②③④ | C.①② | D.①③ |
您最近一年使用:0次
名校
解题方法
8 . 原子结构与元素周期表存在着内在联系。根据已学知识,请你回答下列问题:
(1)指出31号元素镓(Ga)在元素周期表中的位置:___ 。
(2)写出原子序数最小的第Ⅷ族元素原子的核外的价电子排布图:____ 。其正三价离子的未成对电子数为____
(3)写出3p轨道上有2个未成对电子的元素的符号:____ 。
(4)日常生活中广泛使用的不锈钢,在其生产过程中添加了某种元素,该元素的价电子排布式为3d54s1,该元素的名称为___ 。
(5)基态原子的4s能级中只有1个电子的元素共有___ 种
(6)元素基态原子的M层全充满,N层有且只有一个未成对电子,其基态原子的电子排布式为___ ,属于____ 区元素;[Cu(NH3)4]SO4中所含的化学键有___ ,,[Cu(NH3)4]SO4的外界离子的空间构型为____ 。
(1)指出31号元素镓(Ga)在元素周期表中的位置:
(2)写出原子序数最小的第Ⅷ族元素原子的核外的价电子排布图:
(3)写出3p轨道上有2个未成对电子的元素的符号:
(4)日常生活中广泛使用的不锈钢,在其生产过程中添加了某种元素,该元素的价电子排布式为3d54s1,该元素的名称为
(5)基态原子的4s能级中只有1个电子的元素共有
(6)元素基态原子的M层全充满,N层有且只有一个未成对电子,其基态原子的电子排布式为
您最近一年使用:0次
9 . 用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是
| A.SO2、CS2、HI都是直线形的分子 |
| B.BF3键角为120°,SnBr2键角大于120° |
| C.CH2O、BF3、SO3都是平面三角形的分子 |
| D.PCl3、NH3、H2O都是三角锥形的分子 |
您最近一年使用:0次
名校
10 . 水是动物生命活动的必需物质,请判断水分子的VSEPR模型名称和中心原子O采取的杂化方式分别是
A.四面体形、 | B.V形、 | C.平面三角形、 | D.三角锥形、 |
您最近一年使用:0次
2021-04-09更新
|
230次组卷
|
6卷引用:吉林省白城市第一中学2020-2021学年高二下学期期中考试化学试题
吉林省白城市第一中学2020-2021学年高二下学期期中考试化学试题四川省成都外国语学校2020-2021学年高二4月月考化学试题(已下线)第2.2.2讲 杂化轨道理论-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)海南省儋州川绵中学2021-2022学年高二下学期期中考试化学试题专题4 分子空间结构与物质性质 第一单元 分子的空间结构 第1课时 分子的空间结构模型4.1.1杂化轨道理论 课后



