21-22高三上·江苏·期中
名校
解题方法
1 . 肼(N2H4)又称为联氨,熔、沸点分别为1.4°C、113.5°C,可用如下方法制备肼:CO(NH2)2+ClO- +2OH- =N2H4+Cl-+CO +H2O。下列有关说法正确的是
+H2O。下列有关说法正确的是
 +H2O。下列有关说法正确的是
+H2O。下列有关说法正确的是| A.N2H4中只存在极性键 |
B. CO 的空间构型为三角锥形 的空间构型为三角锥形 |
| C.CO(NH2)2中C、N、O三种元素第一电离能大小顺序是:C<N<O |
| D.肼的相对分子质量与乙烯接近,但沸点远高于乙烯的原因是能形成分子间氢键 |
您最近一年使用:0次
2021-11-28更新
|
420次组卷
|
5卷引用:山东省济宁市2021-2022学年高三上学期期末考试化学试题
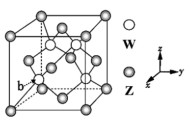
2 . X、Y、Z、W是原子序数依次增大的前四周期元素,X元素有1个2p空轨道,Y为同周期离子半径最小的金属元素,Z元素原子的最外层电子数比次外层电子数少2,W的内层电子已全充满,最外层只有2个电子。请回答下列问题:
(1)X能与氢、氮、氧三种元素构成化合物XO(NH2)2,该化合物分子中的σ键与π键的个数之比是___ ;该物质易溶于水的主要原因是___ 。
(2)元素Z的最高价氧化物中,Z原子的杂化方式是___ ,分子的空间构型是___ 。
(3)元素Z.与W形成的某种化合物的晶胞结构如图所示,则该化合物的化学式为___ 。原子的分数坐标,即将晶胞参数均看做“1”所得出的三维空间坐标,则晶胞中b原子的分数坐标为___ 。
(4)Y的氯化物气态时通常以二聚分子形式存在,分子式为Y2Cl6,分子中所有原子均达到8电子稳定结构,则Y2Cl6的结构式为___ 。
(1)X能与氢、氮、氧三种元素构成化合物XO(NH2)2,该化合物分子中的σ键与π键的个数之比是
(2)元素Z的最高价氧化物中,Z原子的杂化方式是
(3)元素Z.与W形成的某种化合物的晶胞结构如图所示,则该化合物的化学式为

(4)Y的氯化物气态时通常以二聚分子形式存在,分子式为Y2Cl6,分子中所有原子均达到8电子稳定结构,则Y2Cl6的结构式为
您最近一年使用:0次
名校
解题方法
3 . 下列说法中正确的是
A. 和 和 都是正四面体型分子,且键角相等 都是正四面体型分子,且键角相等 |
B.乙烯分子中,碳原子的 杂化轨道形成 杂化轨道形成 键,未杂化的 键,未杂化的 轨道形成 轨道形成 键 键 |
C. 成为阳离子时首先失去 成为阳离子时首先失去 轨道电子 轨道电子 |
D. 分子中孤电子对与成键电子对的排斥作用比成键电子对之间的排斥作用弱 分子中孤电子对与成键电子对的排斥作用比成键电子对之间的排斥作用弱 |
您最近一年使用:0次
2021-03-12更新
|
1021次组卷
|
11卷引用:山东省济宁市2021届高三3月模拟(一模)化学试题
山东省济宁市2021届高三3月模拟(一模)化学试题四川省成都市阳安中学2020-2021学年高二下学期3月月考化学试题安徽省宿州市十三所重点中学2020-2021学年高二下学期期中质量检测化学试题(已下线)押山东卷第04题 物质结构与性质选择题-备战2021年高考化学临考题号押题(山东卷)山东省临沂市第一中学2020-2021学年高二下学期6月月考化学试题(已下线)专题13 物质结构与性质基础-备战2022年高考化学真题及地市好题专项集训【山东专用】浙江省“南太湖”联盟2021-2022学年高二下学期第一次联考化学试题 安徽省合肥市肥东县综合高中2021-2022学年高二下学期期中考试化学试题四川省雅安中学2022-2023学年高二上学期10月月考化学试题海南省琼海市嘉积中学2022-2023学年高二上学期第二次月考(期中)化学试题广东省佛山市顺德市李兆基中学2022-2023学年高二下学期3月月考化学试题



