解题方法
1 . 卤族元素的化合物在科研和生产中有着重要的作用。请回答下列问题:
(1) (键角为180º)的中心Ⅰ原子价层电子对数为
(键角为180º)的中心Ⅰ原子价层电子对数为______ ;
______ (填“是”或“否”)具有极性;基态碘原子价电子排布式为______ 。
(2)物质磁性大小以磁矩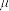 表示,
表示,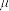 与未成对电子数之间的关系为:
与未成对电子数之间的关系为: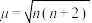 (n为未成对电子数)。配合物
(n为未成对电子数)。配合物 中配离子
中配离子 的
的 B.M(B.M磁矩单位),
B.M(B.M磁矩单位), 的杂化类型为
的杂化类型为______ 。
a. b.
b. c.
c.
配合物 中配离子
中配离子 的
的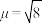 B.M,则配离子的空间构型为
B.M,则配离子的空间构型为______ 。
(3)在极高压强下,氯化钠可以和氯气化合生成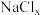 。
。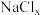 是立方系晶胞,结构如图所示,其中两个氯原子的坐标为
是立方系晶胞,结构如图所示,其中两个氯原子的坐标为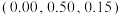 、
、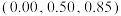 ,晶体的化学式为
,晶体的化学式为______ ;与Na距离最近的且相等的Cl有______ 个; 在晶体中键长为0.20nm,晶胞棱长为
在晶体中键长为0.20nm,晶胞棱长为______ nm(保留2位有效数字)。
(1)
 (键角为180º)的中心Ⅰ原子价层电子对数为
(键角为180º)的中心Ⅰ原子价层电子对数为
(2)物质磁性大小以磁矩
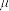 表示,
表示,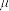 与未成对电子数之间的关系为:
与未成对电子数之间的关系为: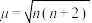 (n为未成对电子数)。配合物
(n为未成对电子数)。配合物 中配离子
中配离子 的
的 B.M(B.M磁矩单位),
B.M(B.M磁矩单位), 的杂化类型为
的杂化类型为a.
 b.
b. c.
c.
配合物
 中配离子
中配离子 的
的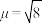 B.M,则配离子的空间构型为
B.M,则配离子的空间构型为(3)在极高压强下,氯化钠可以和氯气化合生成
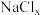 。
。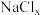 是立方系晶胞,结构如图所示,其中两个氯原子的坐标为
是立方系晶胞,结构如图所示,其中两个氯原子的坐标为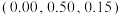 、
、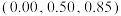 ,晶体的化学式为
,晶体的化学式为 在晶体中键长为0.20nm,晶胞棱长为
在晶体中键长为0.20nm,晶胞棱长为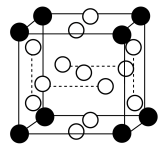
您最近一年使用:0次
名校
解题方法
2 . 下列说法正确的是
A. 分子的VSEPR模型: 分子的VSEPR模型: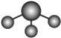 |
B.甲基是推电子基团,所以结合氢离子的能力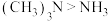 |
C.乙二胺( )的沸点比三甲胺 )的沸点比三甲胺 高的原因是乙二胺存在分子间氢键,三甲胺存在分子内氢键 高的原因是乙二胺存在分子间氢键,三甲胺存在分子内氢键 |
D.由铝原子核形成的下列三种微粒:a.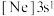 、b. 、b.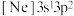 、c. 、c.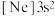 ,再失去一个电子所需最低能量由大到小的顺序是:c>a>b ,再失去一个电子所需最低能量由大到小的顺序是:c>a>b |
您最近一年使用:0次
3 . 下列每组分子的中心原子杂化方式相同的是
A.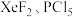 | B.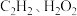 | C.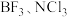 | D.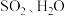 |
您最近一年使用:0次
名校
解题方法
4 . 检验微量砷的原理为 。
。 常温下为无色气体。下列说法正确的是
常温下为无色气体。下列说法正确的是
 。
。 常温下为无色气体。下列说法正确的是
常温下为无色气体。下列说法正确的是A.As的基态核外电子排布式为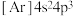 | B. 的空间构型为平面三角形 的空间构型为平面三角形 |
C.固态 属于共价晶体 属于共价晶体 | D. 既含离子键又含共价键 既含离子键又含共价键 |
您最近一年使用:0次
2023-06-02更新
|
1090次组卷
|
7卷引用:山东省济宁市第一中学2024届高三下学期4月份定时检测化学试题
山东省济宁市第一中学2024届高三下学期4月份定时检测化学试题江苏省扬州市2023届高三下学期三模化学试题江苏省淮安市2022-2023学年高二下学期6月期末考试化学试题(已下线)考点巩固卷06 物质结构与性质(4大考点55题)-2024年高考化学一轮复习考点通关卷(新高考通用)江苏省基地大联考2023-2024学年高三上学期第一次质量监测化学试题江苏省南京师范大学苏州实验学校2023-2024学年高三上学期零模考试热身练化学试题(已下线)热点17 分子结构与性质
名校
解题方法
5 . 下列图像正确的是
A. 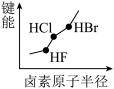 | B. 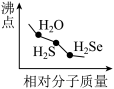 |
C. 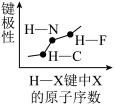 | D. 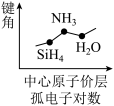 |
您最近一年使用:0次
2023-03-26更新
|
424次组卷
|
9卷引用:山东省济宁市兖州区2019-2020学年高二5月阶段性测试化学试题
山东省济宁市兖州区2019-2020学年高二5月阶段性测试化学试题江苏省泰州中学2020-2021学年高一下学期期末考试化学试题(已下线)第2章 章末综合测评B-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)河北省沧州市2021-2022学年高二下学期期末考试化学试题黑龙江省佳木斯市第十二中学2021-2022学年高二下学期期中考试化学试题河南省洛阳强基联盟2022-2023学年高二下学期3月联考化学试题湖北省宜昌市协作体2022-2023学年高二下学期期中考试化学试题湖南省岳阳市郡华学校2023-2024学年高二下学期入学考试化学试题江西省萍乡市2023-2024学年高二下学期4月期中考试化学试题
解题方法
6 . 近日,某科研所综述了在Cu基催化剂上催化 和CO制得
和CO制得 、
、 、
、 等物质的原理。回答下列有关问题:
等物质的原理。回答下列有关问题:
(1)基态 的价电子排布式为
的价电子排布式为_______ 。
(2)已知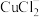 空间结构为直线形,则
空间结构为直线形,则 的杂化方式为
的杂化方式为_______ 。催化 还原的过程中可能产生
还原的过程中可能产生 ,该离子的空间构型为
,该离子的空间构型为_______ 。
(3)已知乙醇的挥发性比水的强,原因可能是_______ 。
(4) 是一种有机酸,广义酸碱理论认为:凡能给出质子(
是一种有机酸,广义酸碱理论认为:凡能给出质子( )的任何分子或离子都是酸;凡能结合质子(
)的任何分子或离子都是酸;凡能结合质子( )的分子或离子都是碱。按此理论,吡啶(
)的分子或离子都是碱。按此理论,吡啶(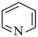 )属于
)属于______ (填“酸”“碱”或“盐”)。
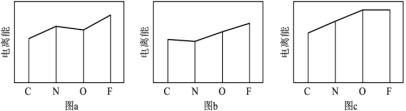
(5)图a、b、c分别表示C、N、O和F的逐级电离能I的变化趋势(纵坐标的标度不同)。第一电离能的变化图是_______ (填标号);第三电离能的变化图是_______ (填标号)。
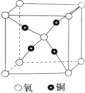
(6)某铜和氧形成的一种离子化合物的晶体结构如图,那么该离子化合物的化学式为_______ ,其中铜的配位数为_______ 。
 和CO制得
和CO制得 、
、 、
、 等物质的原理。回答下列有关问题:
等物质的原理。回答下列有关问题:(1)基态
 的价电子排布式为
的价电子排布式为(2)已知
 空间结构为直线形,则
空间结构为直线形,则 的杂化方式为
的杂化方式为 还原的过程中可能产生
还原的过程中可能产生 ,该离子的空间构型为
,该离子的空间构型为(3)已知乙醇的挥发性比水的强,原因可能是
(4)
 是一种有机酸,广义酸碱理论认为:凡能给出质子(
是一种有机酸,广义酸碱理论认为:凡能给出质子( )的任何分子或离子都是酸;凡能结合质子(
)的任何分子或离子都是酸;凡能结合质子( )的分子或离子都是碱。按此理论,吡啶(
)的分子或离子都是碱。按此理论,吡啶( )属于
)属于(5)图a、b、c分别表示C、N、O和F的逐级电离能I的变化趋势(纵坐标的标度不同)。第一电离能的变化图是

(6)某铜和氧形成的一种离子化合物的晶体结构如图,那么该离子化合物的化学式为

您最近一年使用:0次
解题方法
7 . VIA族的氧、硫、硒(Se)、碲(Te)等元素的化合物在科学研究和工业生产中有许多重要用途。回答下列问题:
(1)基态O原子中,未成对电子数与成对电子数之比为_______ 。
(2)亚硫酰氯 在有机合成中有重要应用,分子中S原子的杂化轨道类型为
在有机合成中有重要应用,分子中S原子的杂化轨道类型为_______ ,分子的空间结构为_______ 。
(3)气态电中性基态原子得到一个电子转化为气态基态负离子所放出的能量叫做第一电子亲和能。S、Se、Te三种元素的第一电子亲和能由大到小的顺序是_______ , 、
、 和
和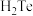 键角最小的是
键角最小的是_______ ,稳定性最强的是_______ 。
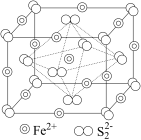
(4)黄铁矿是工业生产硫酸的原料,其晶胞结构如图所示,晶胞参数为anm,该晶体的电子式为_______ , 的配位数为
的配位数为_______ ,晶体的密度为_______  ,在1个晶胞中,由
,在1个晶胞中,由 围成的正八面体的个数为
围成的正八面体的个数为_______ 。
(1)基态O原子中,未成对电子数与成对电子数之比为
(2)亚硫酰氯
 在有机合成中有重要应用,分子中S原子的杂化轨道类型为
在有机合成中有重要应用,分子中S原子的杂化轨道类型为(3)气态电中性基态原子得到一个电子转化为气态基态负离子所放出的能量叫做第一电子亲和能。S、Se、Te三种元素的第一电子亲和能由大到小的顺序是
 、
、 和
和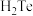 键角最小的是
键角最小的是(4)黄铁矿是工业生产硫酸的原料,其晶胞结构如图所示,晶胞参数为anm,该晶体的电子式为
 的配位数为
的配位数为 ,在1个晶胞中,由
,在1个晶胞中,由 围成的正八面体的个数为
围成的正八面体的个数为
您最近一年使用:0次
名校
解题方法
8 . 价层电子对互斥理论和杂化轨道理论都可以判断、解释分子或离子的空间构型,下列说法正确的是
A.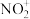 和 和 的键角相同 的键角相同 | B. 、 、 的中心原子价层电子对数相同 的中心原子价层电子对数相同 |
C. 、 、 中S原子的杂化方式相同 中S原子的杂化方式相同 | D. 、 、 都是直线形的分子 都是直线形的分子 |
您最近一年使用:0次
2022-07-15更新
|
284次组卷
|
3卷引用:山东省济宁市2021-2022学年高二下学期期末考试化学试题
山东省济宁市2021-2022学年高二下学期期末考试化学试题云南师范大学附属中学2023-2024学年高二上学期10月月考化学试题(已下线)第04讲 分子的空间结构-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)
解题方法
9 . 光电材料[氟代硼铍酸钾晶体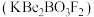 等]是目前科学家特别关注的材料。其结构如图,其中氧原子已省略,图中的原子分别位于立方体的顶点、棱及面上,可由BeO、
等]是目前科学家特别关注的材料。其结构如图,其中氧原子已省略,图中的原子分别位于立方体的顶点、棱及面上,可由BeO、 和
和 在一定条件下制得,同时放出
在一定条件下制得,同时放出 气体。
气体。
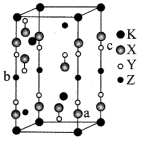
(1)基态B原子中有_______ 种能量不同的电子,存在未成对电子的能级电子云空间有_______ 种伸展方向。
(2)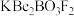 结构图中X表示
结构图中X表示_______ (填元素符号),组成元素中非金属元素的电负性由强到弱的顺序为_______ (填元素符号); 中B原子的杂化方式为
中B原子的杂化方式为_______ ,已知苯分子中含有大 键,可记为
键,可记为 (右下角“6”表示6个原子,右上角“6”表示6个共用电子),实验测得
(右下角“6”表示6个原子,右上角“6”表示6个共用电子),实验测得 分子中B-F键的键长远小于二者原子半径之和,所以
分子中B-F键的键长远小于二者原子半径之和,所以 分子中存在大
分子中存在大 键,可表示为
键,可表示为_______ 。
(3)已知卤化物的水解机理分亲核水解和亲电水解。发生亲核水解的结构条件:中心原子具有 和有空的价轨道;发生亲电水解的结构条件:中心原子有孤对电子,接受
和有空的价轨道;发生亲电水解的结构条件:中心原子有孤对电子,接受 的
的 进攻。则
进攻。则 发生水解的产物是
发生水解的产物是_______ 。
(4)已知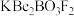 结构图中,X-Y的键长为r,a、b原子的分数坐标分别为
结构图中,X-Y的键长为r,a、b原子的分数坐标分别为 、
、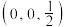 ,则c原子的分数坐标为
,则c原子的分数坐标为_______ ,若立方体边长分别为m,m,n(单位为pm),则该晶体的密度为_______  (列出计算式)。
(列出计算式)。
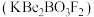 等]是目前科学家特别关注的材料。其结构如图,其中氧原子已省略,图中的原子分别位于立方体的顶点、棱及面上,可由BeO、
等]是目前科学家特别关注的材料。其结构如图,其中氧原子已省略,图中的原子分别位于立方体的顶点、棱及面上,可由BeO、 和
和 在一定条件下制得,同时放出
在一定条件下制得,同时放出 气体。
气体。
(1)基态B原子中有
(2)
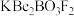 结构图中X表示
结构图中X表示 中B原子的杂化方式为
中B原子的杂化方式为 键,可记为
键,可记为 (右下角“6”表示6个原子,右上角“6”表示6个共用电子),实验测得
(右下角“6”表示6个原子,右上角“6”表示6个共用电子),实验测得 分子中B-F键的键长远小于二者原子半径之和,所以
分子中B-F键的键长远小于二者原子半径之和,所以 分子中存在大
分子中存在大 键,可表示为
键,可表示为(3)已知卤化物的水解机理分亲核水解和亲电水解。发生亲核水解的结构条件:中心原子具有
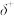 和有空的价轨道;发生亲电水解的结构条件:中心原子有孤对电子,接受
和有空的价轨道;发生亲电水解的结构条件:中心原子有孤对电子,接受 的
的 进攻。则
进攻。则 发生水解的产物是
发生水解的产物是(4)已知
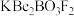 结构图中,X-Y的键长为r,a、b原子的分数坐标分别为
结构图中,X-Y的键长为r,a、b原子的分数坐标分别为 、
、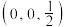 ,则c原子的分数坐标为
,则c原子的分数坐标为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
名校
解题方法
10 . 5-氨基四唑硝酸盐受热迅速生成以 为主的环境友好型气体,并放出大量的热,是制造HTPB火箭推进剂的重要原料,结构简式如图,其中五元环为平面结构,下列说法正确的是
为主的环境友好型气体,并放出大量的热,是制造HTPB火箭推进剂的重要原料,结构简式如图,其中五元环为平面结构,下列说法正确的是

 为主的环境友好型气体,并放出大量的热,是制造HTPB火箭推进剂的重要原料,结构简式如图,其中五元环为平面结构,下列说法正确的是
为主的环境友好型气体,并放出大量的热,是制造HTPB火箭推进剂的重要原料,结构简式如图,其中五元环为平面结构,下列说法正确的是 
| A.基态N原子核外电子的运动状态有3种 |
| B.阴离子的空间构型为三角锥形 |
| C.该化合物中五元环上的5个原子的杂化方式都相同 |
D.该化合物因存在类似于苯分子的大 键,所以非常稳定 键,所以非常稳定 |
您最近一年使用:0次
2022-04-29更新
|
981次组卷
|
7卷引用:山东省济宁市2022届高三第二次模拟考试化学试题



