名校
解题方法
1 .  (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度( 350℃)而成为颇具潜力的化学储氢材料之一,它可通过环硼氨烷、
350℃)而成为颇具潜力的化学储氢材料之一,它可通过环硼氨烷、 与
与 进行合成。
进行合成。
1.上述涉及的元素H、B、C、N、O原子半径最大的是___________ ,电负性最大的是___________ 。
2.键角:
___________  (填“
(填“ ”“
”“ ”或“
”或“ ”),原因是
”),原因是___________ 。
 (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度( 350℃)而成为颇具潜力的化学储氢材料之一,它可通过环硼氨烷、
350℃)而成为颇具潜力的化学储氢材料之一,它可通过环硼氨烷、 与
与 进行合成。
进行合成。1.上述涉及的元素H、B、C、N、O原子半径最大的是
2.键角:

 (填“
(填“ ”“
”“ ”或“
”或“ ”),原因是
”),原因是
您最近半年使用:0次
解题方法
2 . Cu2O溶于浓氨水中形成无色的[Cu(NH3)2]+,该无色溶液接触空气会很快变成深蓝色。
(1)[Cu(NH3)2]+中NH3的N原子提供___________,与中心离子形成___________。
| A.空轨道、离子键 | B.孤电子对、离子键 |
| C.空轨道、配位键 | D.孤电子对、配位键 |
| A.大于107° | B.小于107° | C.等于107° | D.等于120° |
完成并配平上述离子方程式。
您最近半年使用:0次
名校
3 . 稀土是一种重要的战略资源,我国是稀土储量最大的国家。铈( )是一种典型的稀土元素,其在自然界中主要以氟碳铈矿(主要成分为
)是一种典型的稀土元素,其在自然界中主要以氟碳铈矿(主要成分为 )形式存在。工业上利用氟碳铈矿制取
)形式存在。工业上利用氟碳铈矿制取 的一种工艺流程如图:
的一种工艺流程如图:

下列说法错误的是
 )是一种典型的稀土元素,其在自然界中主要以氟碳铈矿(主要成分为
)是一种典型的稀土元素,其在自然界中主要以氟碳铈矿(主要成分为 )形式存在。工业上利用氟碳铈矿制取
)形式存在。工业上利用氟碳铈矿制取 的一种工艺流程如图:
的一种工艺流程如图:
下列说法错误的是
A.倍烧过程中氧化剂与还原剂的物质的量之比为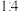 |
B.通过操作Ⅱ(包含酸溶、蒸发结晶)即可得到纯净的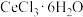 |
| C.酸浸过程中用稀硫酸和双氧水替代盐酸可体现环境友好 |
D. 中阴离子的空间构型为正四面体 中阴离子的空间构型为正四面体 |
您最近半年使用:0次
2024-01-09更新
|
381次组卷
|
4卷引用:上海市宜川中学2023-2024学年高三上学期期中考试卷(化学)
名校
4 . 生成氢气:在恒温恒容的反应器中,将水蒸气通过红热的炭即产生水煤气: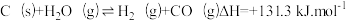 。
。
(1)以上涉及到的元素中,电负性最大的元素为_______。
(2)H2O的价层电子对空间结构为_______ (需过程)
(3)写出该反应的平衡常数表达式_______ 。
(4)下列能作为反应达到平衡的判据是_______。
(5)有利于提高H2平衡产率的条件是_______。
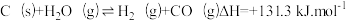 。
。(1)以上涉及到的元素中,电负性最大的元素为_______。
| A.碳 | B.氢 | C.氧 |
(3)写出该反应的平衡常数表达式
(4)下列能作为反应达到平衡的判据是_______。
| A.容器内气体的压强不变 |
| B.K值不变 |
| C.H2O和H2的物质的量之比不变 |
| D.CO和H2的物质的量之比不变 |
| A.低温低压 | B.低温高压 |
| C.高温低压 | D.高温高压 |
您最近半年使用:0次
名校
5 . 金属元素及其化合物在生活生产中应用十分广泛。
(1)磷酸亚铁锂(LiFePO4)和锰酸锂(LiMn2O4)均可用作锂离子电池正极材料。在周期表中,与Li化学性质最相似的邻族元素是______ ,基态Fe原子的最外层电子的轨道表示式为______ 。
(2)原子核外电子有两种相反的自旋状态,分别用+ 和﹣
和﹣ 表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为______ 。
(3)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下:
锰元素位于第______ 周期______ 族______ 区;比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,解释原因______ 。
(4)铍由于重量轻、弹性模数高和热稳定性好,已成为引人注目的飞机和导弹结构材料。铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的是______(填选项字母)。
(5)写出氧化铍和NaOH溶液反应生成Na2BeO2,写出该反应的离子方程式______ 。
(6)下列事实能说明氯与氧两元素非金属性相对强弱的有______(填选项字母)。
(7)下列分子或离子:①BCl3、②NH3、③H2O、④CH4、⑤BeCl2中,键角由大到小排列顺序的是______ (用序号表示)。
(1)磷酸亚铁锂(LiFePO4)和锰酸锂(LiMn2O4)均可用作锂离子电池正极材料。在周期表中,与Li化学性质最相似的邻族元素是
(2)原子核外电子有两种相反的自旋状态,分别用+
 和﹣
和﹣ 表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为(3)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下:
| 元素 | Mn | Fe | |
电离能/kJ•mol﹣1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(4)铍由于重量轻、弹性模数高和热稳定性好,已成为引人注目的飞机和导弹结构材料。铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的是______(填选项字母)。
| A.都属于轻金属 | B.失电子的能力都比镁弱 |
| C.原子核外电子云形状都是2种 | D.氯化物的水溶液pH均小于7 |
(6)下列事实能说明氯与氧两元素非金属性相对强弱的有______(填选项字母)。
| A.Cl原子最外层电子数比O多 | B.酸性:HCl>H2O |
| C.ClO2中氯元素为+4价,氧元素为﹣2价 | D.沸点:H2O>HCl |
您最近半年使用:0次
名校
6 . 新型半导体材料如碳化硅(SiC)、氮化镓(GaN)等在国防技术、航空航天及5G技术等领域扮演着重要的角色。
(1)基态Si原子中,核外电子占据的最高能层的符号为______ ,占据最高能级的电子的电子云轮廓图形状为______ 。
(2)基态Ga原子的核外电子排布为[Ar]3d104s2p1,其转化为下列激发态时,吸收能量最少的是______(填选项字母)。
(3)硼(B)与Ga是同主族元素,硼氢化钠(NaBH4)是有机合成中重要的还原剂,基态B原子核外电子有______ 种不同的空间运动状态,其负离子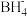 的空间结构为
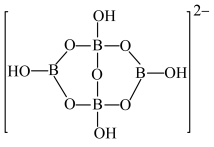
的空间结构为______ ;另一种含硼负离子的结构如下图所示,其中B原子的杂化轨道类型为______ 。
(4)NH4H2PO4中,除磷元素外,其余三种元素电负性由大到小的顺序是______ (填元素符号),N、P和S第一电离能由大到小的顺序是______ (填元素符号)。
(1)基态Si原子中,核外电子占据的最高能层的符号为
(2)基态Ga原子的核外电子排布为[Ar]3d104s2p1,其转化为下列激发态时,吸收能量最少的是______(填选项字母)。
A.[Ar]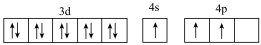 |
B.[Ar]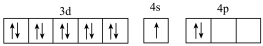 |
C.[Ar]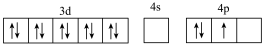 |
D.[Ar]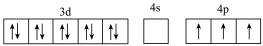 |
(3)硼(B)与Ga是同主族元素,硼氢化钠(NaBH4)是有机合成中重要的还原剂,基态B原子核外电子有
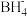 的空间结构为
的空间结构为
(4)NH4H2PO4中,除磷元素外,其余三种元素电负性由大到小的顺序是
您最近半年使用:0次
名校
解题方法
7 . 下列对有关事实的解释正确的是
| 选项 | 事实 | 解释 |
| A | 某些金属盐灼烧呈现不同焰色 | 电子从低能轨道跃迁至高能轨道时吸收光波长不同 |
| B | CH4与NH3分子的空间结构不同 | 二者中心原子杂化轨道类型不同 |
| C | 白磷为正四面体分子 | 白磷分子中P﹣P键间的夹角是109.5° |
| D | HF的热稳定性比HCl强 | H﹣F比H﹣Cl的键能大 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
8 . 氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。下列关于氯化亚砜分子的空间结构和中心原子(S)采取杂化方式的说法正确的是
| A.V形、sp2 | B.三角锥形、sp3 |
| C.平面三角形、sp3 | D.三角锥形、sp2 |
您最近半年使用:0次
9 . 水是清洁、可持续的氢能来源。利用太阳能从水中获取氢气符合可持续发展的理念。“太阳能直接热分解水制氢”通过集中阳光产生2000K以上高温,促使 分解为
分解为 和
和 ;若温度进一步升高至5000K,
;若温度进一步升高至5000K, 与
与 会分解为气态原子。
会分解为气态原子。
(1) 分解过程中断裂的化学键属于
分解过程中断裂的化学键属于___________ 。
A.离子键 B.极性共价键 C.非极性共价键
(2)在相同条件下,同时存在如下两个过程:
i.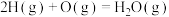 ii.
ii.
比较下列量的相对大小(均从选项中选择):①放出热量___________ ;②反应速率___________ 。
A.i>ii B.i=ii C.i<ii
“太阳能光催化分解水制氢”原理可以表示为: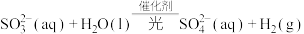 。
。
(3)已知 呈平面正三角形结构,推测
呈平面正三角形结构,推测 的立体构型为
的立体构型为___________ 。
A.平面正三角形 B.正四面体型 C.三角锥型
(4)能说明氯的非金属性比硫强的事实是___________。
(5) 与
与 结构相似,但
结构相似,但 的沸点高于
的沸点高于 ,原因是
,原因是___________ 。
(6)反应开始一段时间后,取出一定量溶液,写出检验溶液中 的操作方法:
的操作方法:________ 。
“太阳能热化学循环制氢”是将太阳能转化成化学能,通过多个化学过程产生 。如常见的铁氧化物循环制氢过程如图所示。
。如常见的铁氧化物循环制氢过程如图所示。
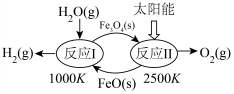
(7)写出反应I的化学方程式:___________ ;若该反应生成标准状况下 氢气,转移电子数目为
氢气,转移电子数目为___________ 。
(8)科学家想要用组成相似的钴氧化物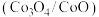 代替铁氧化物进行循环制氢。查阅资料发现,使用钴氧化物后反应I和反应II的
代替铁氧化物进行循环制氢。查阅资料发现,使用钴氧化物后反应I和反应II的 值随温度
值随温度 变化如图所示。
变化如图所示。
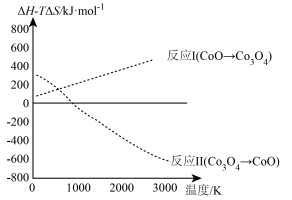
结合图像判断能否用钴氧化物代替铁氧化物进行热化学循环制氢?若可行,举出采用钴氧化物的一个优势;若不可行,说明理由___________ 。
(9)除了上述“直接热分解”、“光催化分解”和“热化学循环”外,请再设计一种利用太阳能从水中获取氢气的方法:___________ (简述即可,不必展开)。
 分解为
分解为 和
和 ;若温度进一步升高至5000K,
;若温度进一步升高至5000K, 与
与 会分解为气态原子。
会分解为气态原子。(1)
 分解过程中断裂的化学键属于
分解过程中断裂的化学键属于A.离子键 B.极性共价键 C.非极性共价键
(2)在相同条件下,同时存在如下两个过程:
i.
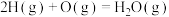 ii.
ii.
比较下列量的相对大小(均从选项中选择):①放出热量
A.i>ii B.i=ii C.i<ii
“太阳能光催化分解水制氢”原理可以表示为:
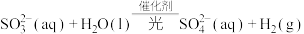 。
。(3)已知
 呈平面正三角形结构,推测
呈平面正三角形结构,推测 的立体构型为
的立体构型为A.平面正三角形 B.正四面体型 C.三角锥型
(4)能说明氯的非金属性比硫强的事实是___________。
A.溶解性: | B.氧化性: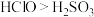 |
C.热稳定性: | D.酸性: |
(5)
 与
与 结构相似,但
结构相似,但 的沸点高于
的沸点高于 ,原因是
,原因是(6)反应开始一段时间后,取出一定量溶液,写出检验溶液中
 的操作方法:
的操作方法:“太阳能热化学循环制氢”是将太阳能转化成化学能,通过多个化学过程产生
 。如常见的铁氧化物循环制氢过程如图所示。
。如常见的铁氧化物循环制氢过程如图所示。
(7)写出反应I的化学方程式:
 氢气,转移电子数目为
氢气,转移电子数目为(8)科学家想要用组成相似的钴氧化物
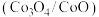 代替铁氧化物进行循环制氢。查阅资料发现,使用钴氧化物后反应I和反应II的
代替铁氧化物进行循环制氢。查阅资料发现,使用钴氧化物后反应I和反应II的 值随温度
值随温度 变化如图所示。
变化如图所示。
结合图像判断能否用钴氧化物代替铁氧化物进行热化学循环制氢?若可行,举出采用钴氧化物的一个优势;若不可行,说明理由
(9)除了上述“直接热分解”、“光催化分解”和“热化学循环”外,请再设计一种利用太阳能从水中获取氢气的方法:
您最近半年使用:0次
解题方法
10 . 以水分了为例分析分子空间结构,首先分析H2O中,成键电子对数为_______ ,再计算H2O中孤电子对数为________ ,确定氧原子的杂化轨道类型为_______ ,依据VSEPR理论H2O为_______ 形,实际因为________ ,H2O的键角______ (填“>”“<”)109°28′。
您最近半年使用:0次



